AniView系列多模式动物活体成像系统在纳米医学领域中的应用
《Journal of nanobiotechnology》
IF=9.429,一区期刊

近日,同济大学化学科学与工程学院石硕教授课题组联合附属东方医院乳腺肿瘤科主任董春燕教授课题组开展了跨学科合作研究,在乳腺癌的治疗策略方面取得了新的进展,相关研究成果已发表在国际期刊《Journal of nanobiotechnology》(IF=9.429,一区期刊)。
截至2020年,乳腺癌已取代肺癌成为世界上最常见的恶性肿瘤,属于女性恶性肿瘤中死亡率最高的一种。作为一种高度异质性的肿瘤,无序的代谢是乳腺癌治疗的一个难点。并且肿瘤血管网络的结构或功能紊乱以及快速增殖的肿瘤细胞与血管之间的扩散距离增加,会导致肿瘤缺氧。在缺氧状态下,肿瘤在激活缺氧诱导因子1α(HIF1α)信号的作用下产生多种致癌转化,促进肿瘤对缺氧的适应,如代谢适应、肿瘤微环境(TME)酸化、远处转移和血管生成。此外,表达高水平HIF1α 的乳腺癌患者有较 差的无障碍生存期(DFS)和较差的总生存期(OS)。
作为肿瘤新陈代谢的一个关键点,mTOR具有促进氨基酸、葡萄糖和其他癌细胞生长所需物质的合成,使肿瘤转移和抗凋亡的功能,成为抗肿瘤药物的一个有效靶点。同时mTOR也调节HIF1α的翻译,抑制mTOR不仅能作为肿瘤的治疗目标,还能减少HIF1α在乳腺癌中的表达。
mTORC1作为mTOR的复合体,可以被多种致癌途径激活,但PI3K/AKT信号是乳腺癌中mTORC1磷酸化激活的最常见途径。有研究阐明,酸能抑制mTORC1从细胞质向核周溶酶体表面的转移,从而阻止mTORC1被PI3K/AKT磷酸化。4-(2-氨基乙基)苯磺酰胺(ABS)作为一种CAIX抑制剂,可以引起细胞内酸化,显示出良好的抗肿瘤效果。
同时Dactolisib(NVP-BEZ235,BEZ235)是一种针对PI3K和mTOR(mTORC1和mTORC2)的抑制剂,它避免了反馈激活,对PI3K/AKT/mTOR途径的正反馈回路产生更强的抑制作用。
另外随着 "生物医学光学 "的出现,光动力疗法(PDT)和光热疗法(PTT)已成为现代医学的新兴领域。研究表明,PDT/PTT的协同作用可以提高疗效,减少每种治疗方式的局限性。PTT可以通过将肿瘤温度提高到42°C以上来实现热消融,从而诱发不可逆的组织损伤。同时,PTT的产热可以提高肿瘤的血流速度,促进光敏剂(PSs)或纳米材料向细胞的传递,增强PDT或纳米药物的疗效。然而,光敏剂或PTT剂和药物分子的药代动力学特性通常是不同的。因此,开发合适的载体以确保在体内同时发挥治疗作用和肿瘤特异性积累是癌症治疗的最佳策略之一。
为此,作者构建了HPDA-ABS/PEG-BEZ235/Ce6(H-APBC)与光疗相结合的药物输送纳米平台,以增加细胞内酸度,抑制PI3K/mTOR信号,减弱HIF-1α依赖性肿瘤缺氧适应。
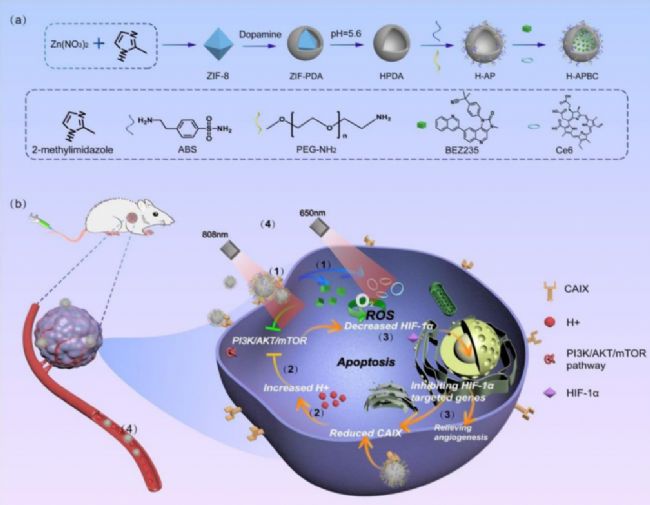
▲ 图1 H-APBC的合成和治疗的示意图
a.药物输送纳米平台H-APBC的合成方法
b.H-APBC对缺氧肿瘤细胞增强治疗效果的示意图
于小鼠静脉注射H-APBC,肿瘤部位的荧光强度逐渐增加,在6-12小时内达到峰值。之后,正位肿瘤的局部荧光逐渐减弱,表明H-APBC在小鼠体内的清除。24小时后,安乐死和切除小鼠后,在肝脏和肿瘤部位都观察到明显的荧光图像,表明H-APBC在肿瘤中迅速积累并最终被肝脏代谢。
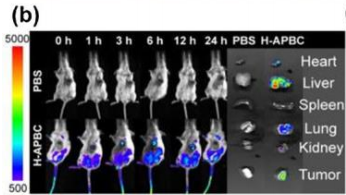
▲ 图2 小鼠静脉注射H-APBC后的荧光图像以及注射24小时后肿瘤和主要器官的体外成像
结合治疗14天后肿瘤的体积和重量,可以看出各治疗组与PBS组相比不同的抗肿瘤效果,特别是H-APBC +PDT(缩写为HD)、H-APBC +PTT(缩写为HT)和H-APBC +PDT +PTT(缩写为HDT)治疗组,表明作者所制备的纳米平台与光疗相结合后,抑制了正位乳腺癌的生长,实现了高效的共传递,为同时进行肿瘤的三种治疗方式开辟了新的可能性。
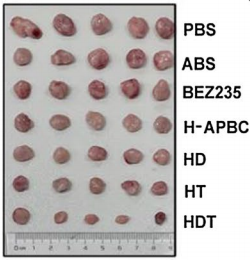
▲ 图3 不同治疗方式下的肿瘤组织
博鹭腾助力科研

文章中,评估H-APBC在肿瘤部位的积累能力,使用了AniView系列多模式动物活体成像系统拍摄。
论文链接:
https://doi.org/10.1186/s12951-022-01394-w






