高度稳定的NIR-II发光双自由基类化合物用于癌症光疗诊断
本文要点:NIR-II光疗剂已成为癌症早期诊断和精确治疗的重要药物。具有独特结构和窄带隙的有机开壳二自由基类化合物因其强烈的自旋耦合效应和近红外光捕获能力而成为光疗剂的有前景的候选者。然而,考虑到其高化学反应性和自吸收性,实现稳定有效的NIR-II发光二自由基类化合物至关重要,但也颇具挑战性。在此,通过采用受主平面化/π共轭扩展和施主旋转策略,成功制备了两种高度稳定的NIR-II发光二自由基化合物2PhNVDPP和PhNVDPP。在包封到水分散性纳米粒子(NPs)中后,2PhNVDPP NPs表现出NIR-II发光、53%的高PCE和改进的光/热稳定性。2PhNVDPP NPs的体内实验证明了血管和肿瘤的清晰可视化,以及成功的NIR-II成像引导的肿瘤光热消融。这项研究不仅开发了一种具有NIR-II发光的开创性稳定的二自由基类光疗剂,还为多模式抗癌治疗的有效性提供了独特的视角。
在此,通过采用包括受体平面化、π-共轭扩展和供体旋转策略的协同方法,构建了NIR-II FLI引导的癌症PTT的高度稳定的二己二酸。设计并合成了两种化合物,即2PhNVDPP和PhNVDPP,它们都具有相同的共面受体,但扭曲的供体结构不同。变温电子自旋共振(VT-ESR)和密度泛函理论(DFT)表明,这两种化合物具有开壳二自由基特性。正如预期的那样,这两种二羟基化合物都显示出NIR-II荧光发射,其特征是尾部发射达到1300 nm区域。在将两种共轭二自由基组装成水溶性纳米粒子(NPs)以提高其生物相容性和生物稳定性后,2PhNVDPP NPs在808 nm下表现出卓越的光捕获能力(1.8×104 M–1 cm–1),理想的NIR-II发光(1013 nm),53%的高PCE和优异的光/热稳定性。同时,2PhNVDPP NPs显示出非凡的实时血管系统和肿瘤成像能力。2PhNVDPP NPs在肿瘤中的明显积累促进了它们在4T1荷瘤小鼠模型中用于NIR-II FLI引导的PTT抗癌治疗。这项工作为开发高度稳定的NIR-II发光双自由基材料,提高癌症诊断和治疗研究的准确性提供了有前景的指导。
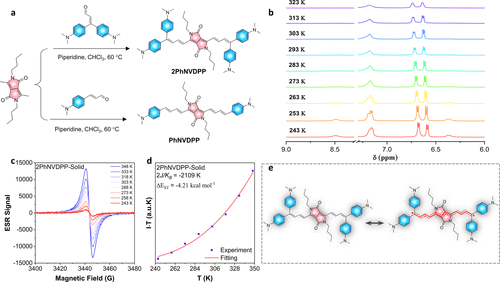
图1. 合成路线和表征
如图1a所示,精心合成了两个分子,即2PhNVDPP和PhNVDPP。为了验证二自由基特征,在d4-1,2-二氯乙烷(C2D4Cl2)中对2PhNVDPP进行了VT 1H NMR测量。随着温度从323 K降低到243 K,与芳香环和共轭二烯相关的质子峰(δ=8.49、7.19-7.15、6.68、6.59、6.37和5.39)逐渐变尖和增强(图1b),表明共轭骨架内的潜在二自由基性质。此外,为了避免分子旋转在高温区域表征2PhNVDPP的二自由基性质时产生干扰,在不同浓度下进行了1H NMR测量。在将2PhNVDPP浓度提高到30mM以抑制分子旋转后,质子峰仍然表现出加宽,揭示了2PhNV的二自由基性质。
为了更好地了解两种二自由基的自由基物种和自旋多样性变化,使用相同量的固态每种化合物进行了VT ESR测量(图1c、d)。固态2PhNVDPP和PhNVDPP的ESR信号表现出2.0030的g因子,表明存在未配对的碳中心自由基。由于2PhNVDPP增强了分子内D-A相互作用,促进了自旋离域并反映了其二自由基特性,因此其ESR信号比PhNVDPP更强。两个样品的ESR信号强度的增加与粉末测量结果一致,在2PhNVDPP中表现出更明显的开壳形式(图1e)。然而,ESR信号从固体到溶液减弱。因此,这些二自由基性质背后的驱动力可能归因于共轭诱导的离域能增强和聚集状态下的分子内运动受限。
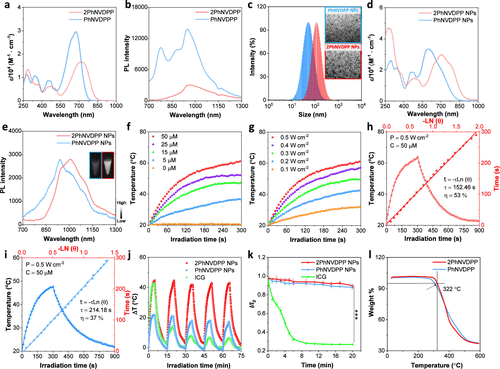
图2. 光物理和光热特性的表征
获得了PhNVDPP和2PhNVDPP的紫外-可见近红外吸收光谱和PL光谱。PhNVDPP和2PhNVDPP的最大吸收峰分别在677和720 nm处测量(图2a)。与PhNVDPP相比,2PhNVDPP表现出明显的约43 nm的红移。这种转变归因于四个供体单元的掺入,这增强了分子内D-A相互作用,导致更强的电子自旋离域和2PhNVDPP的更长吸收波长此外,这两种二自由基类化合物都表现出延伸至1300 nm的NIR-II发射(图2b)。这一发现有望极大地推动二自由基类化合物在高分辨率近红外-II FLI研究中的应用。PhNDVDPP的PL光谱显示出多个发射峰,这可能是由于其溶解度差,在THF溶液中形成了不同大小和形态的聚集体。
为了获得用于生物应用的水分散NPs,将PhNVDPP和2PhNVDPP封装在两亲性共聚物基质DSPE-PEG2000中。通过透射电子显微镜(TEM)和动态光散射(DLS)分析证实了PhNVDPPNPs和2PhNVDPP NPs的均匀球形形态,分别显示平均流体动力学尺寸为57和117 nm(图2c)。此外,还评估了上述NPs的紫外-可见近红外吸收和PL光谱。吸收光谱在500-950 nm处显示出宽的吸收范围,PhNVDPPNPs的最大吸收波长为DPP NPs和2PhNVDPP NPs分别在595和703 nm处(图2d)。2PhNVDPP NPs在808 nm处的摩尔吸光系数(ε)为1.8×104 M–1 cm–1,是PhNVDPP NPs(0.29×104 M-1cm–1)的6倍这清楚地表明2PhNVDPP NPs具有显著强的近红外光吸收特性,这对于开发新型纳米药物和高性能光疗研究至关重要。此外,PhNVDPP NPs和2PhNVDPP NPs分别在929和1013 nm处显示出最大发射峰(图2e)。PhNVDPP NPs和2PhNVDPP NPs的荧光量子产率(QYs)分别为0.05%和0.15%。通过测定QY×ε值来评估NIR-II荧光亮度。2PhNVDPP NPs在850-1500 nm光谱范围内的亮度值为45.3,是PhNVDPP NPs(16.8)的2.7倍。
利用长波长和优异的光吸收性能,我们研究了含有2PhNVDPP NPs和PhNVDPP NPs的水溶液在808 nm激光照射下的光热性能。在808nm激光照射下,纯水溶液没有明显的温度变化(图2f)。值得注意的是,2PhNVDPP NPs水溶液的温度变化与溶液浓度和808 nm激光的功率密度呈正相关(图2f,g)。在暴露于808 nm激光(0.5 W cm–2)照射5分钟后,含有2PhNVDPP NPs(50μM)的溶液的温度从20.0°C升高到61.5°C,从而有利于其二自由基PTT应用。计算出2PhNVDPP NPs的PCE为53%(图2h)在808 nm激光照射(0.5 W cm–2)下,含37%PCE的PhNVDPP NPs(50μM)的水溶液温度从20.1°C升至47.7°C(图2i)。因此,2PhNVDPP NPs显示出优异的光热性能,突出了它们在实体瘤PTT方面的潜力。
阻碍二自由基类化合物更广泛利用的主要限制是其固有的不稳定性。首先,通过间歇打开和关闭808 nm激光(0.5 W cm–2),以FDA批准的临床荧光染料吲哚菁绿(ICG)作为对照,评估2PhNVDPP NPs和PhNVDPP NPs的光热稳定性。2PhNVDPP NPs和PhNVDPP NPs即使在五次加热-冷却循环后也保持稳定(图2j),显示出优异的光热稳定性。随后,在808 nm(0.5 W cm–2)激光照射下研究了2PhNVDPP和PhNVDPP NPs的光稳定性。连续激光照射20分钟后,PhNVDPP NPs和2PhNVDPP NPs的时间依赖性荧光强度没有明显变化(图2k)。然而,ICG中明显存在明显的光漂白效应。这些结果表明,PhNVDPP NPs和2PhNVDPP NPs溶液显示出非凡的荧光光稳定性。此外,我们对两种二自由基类化合物进行了热重分析,以确定其热稳定性。2PhNVDPP的热分解温度为322°C,高于307°C的PhNVDPP(图2l)。在与GSH或H2O2孵育不同时间后,2PhNVDPP NPs和PhNVDPP NPs的吸收光谱仅略有变化,表明其具有相对较好的生物稳定性。同时,在7天的监测期间,它们的粒径没有显著变化。总的来说,这些结果证明了这两种二自由基在光照射、热条件和生理环境下的稳定性。
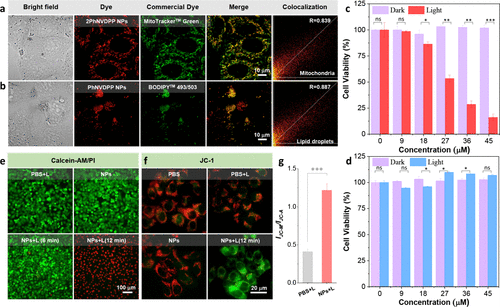
图3. 体外细胞成像和细胞活力测定
使用HeLa细胞作为模型细胞系研究了2PhNVDPP NPs和PhNVDPP NPs的细胞成像和亚细胞分布(图3)。共聚焦激光扫描显微镜分析显示,2PhNVDPP NPs和线粒体染色探针MitoTracker Green之间共定位,Pearson相关系数为0.839(图3a),突显了2PhNVDPP NPs对线粒体的显著靶向能力。此外,探针BODIPY 493/503观察到PhNVDPP NPs对脂滴的高度特异性,Pearson相关性系数为0.887(图3b)。
接着进一步研究了2PhNVDPP NPs的体外抗肿瘤性能。最初,在没有808nm激光照射的情况下,2PhNVDPP NPs的细胞毒性可忽略不计,表明它们对进一步实验的安全性和适用性(图3c)。在暴露于NIR激光照射(808 nm,0.5 W cm–2)12分钟后,观察到与2PhNVDPP NPs孵育的癌症细胞的死亡显著增加。随着2PhNVDPP NPs浓度从0增加到45μM,细胞存活率从100%降低到16%,表明2PhNVDPP NPs具有有效的抗肿瘤特性。2PhNVDPP NPs的半数最大抑制浓度(IC50)接近28μM。相比之下,即使在45μM和808nm的高浓度激光照射下,使用PhNVDPP NPs也观察到超过95%的细胞存活率,表明PhNVDPP NPs对肿瘤细胞的光毒性较弱(图3d)。因此,2PhNVDPP NPs更适合光热抗肿瘤治疗。
此外,我们进行了活/死模拟,以观察2PhNVDPP NPs的光热细胞毒性,其中钙黄绿素AM的绿色荧光表示活细胞,PI的红色荧光表示死细胞。用2PhNVDPP NPs(50μM)或激光照射(808 nm,0.5 W cm–2)处理12分钟的细胞仅显示强烈的绿色荧光,表明对细胞存活率没有影响(图3e)。在暴露于2PhNVDPP NPs和激光照射6和12分钟后,细胞荧光信号逐渐从绿色荧光转变为红色荧光,最终在照射12分钟后通过光疗完全抑制细胞活力。结果表明,2PhNVDPP NPs表现出优异的PTT性能,使其可用于进一步的体内应用。
由于线粒体是2PhNVDPP NPs靶向的亚基,因此检测了经PTT处理的HeLa细胞的线粒体膜电位(MMP),以研究光热对MMP的影响。在黑暗中将HeLa细胞与2PhNVDPP NPs和JC-1共培养后,未检测到MMP的显著变化。然而,暴露于808 nm激光(0.5 W cm–2)12分钟导致绿色荧光逐渐增加,绿色与红色荧光强度的比值增加了1.2倍(图3f,g)。这一结果表明,PTT诱导线粒体破坏,随后MMP减少。因此,2PhNVDPP NPs在生物医学应用方面具有巨大潜力,特别是在近红外光激活的PTT方面。
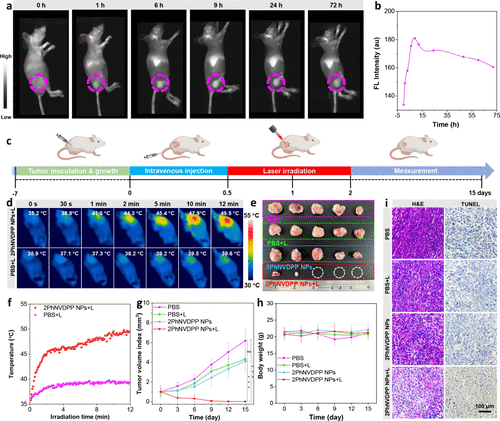
图4. 2PhNVDPP NPs的体内高对比度NIR-II荧光成像和光热治疗
为了评估地拉西烷类化合物的NIR-II成像能力,我们利用2PhNVDPP NPs在裸鼠体内进行了高对比度NIR-II全身血管FLI。该评估涉及砷化铟镓(InGaAs)探测器与不同长通(LP)滤光片(900、1000、1100和1300 nm)的结合使用。在我们的实验中,使用808nm激光作为激发光,它可以深入生物组织而不会伤害小鼠。静脉注射2PhNVDPP NPs后,小鼠腹部血管变得可识别(图S30)。重要的是,使用LP滤波器在900、1000、1100和1300 nm处捕获的图像分别显示出1.09、1.15、1.26和5.03的SBR依次提高。2PhNVDPP NPs的体内成像结果证明了它们适用于NIR-II二自由基成像。
为了确定体内PTT的最佳治疗时间,研究者使用NIR-II FLI研究了2PhNVDPP NPs在4T1荷瘤裸鼠模型中的积累(图4a)。静脉注射2PhNVDPP NPs后,肿瘤区域的实时NIR-II荧光强度信号逐渐增加。信号在注射后9小时达到最高荧光亮度,与初始注射相比增加了1.35倍(图4b)。静脉注射2PhNVDPP NPs后,小鼠腹部血管变得可识别。重要的是,使用LP滤波器在900、1000、1100和1300 nm处捕获的图像分别显示出1.09、1.15、1.26和5.03的SBR依次提高。2PhNVDPP NPs的体内成像结果。
本文进一步研究2PhNVDPP NPs在FLI引导的PTT在4T1乳腺肿瘤携带BALB/c小鼠上的应用,皮下肿瘤体积为100 mm3,作为动物模型(图4c)。对于2PhNVDPP NPs+L组,肿瘤温度在2分钟内从35.2°C迅速升高到44.3°C,随后稳定在约49.5°C(图4f),有利于肿瘤消融。相反,在激光照射后,PBS+L组观察到温度略有升高(ΔT=3.7°C),表明在没有2PhNVDPP NPs的情况下光热效应最小。连续15天每3天测量一次所有组的肿瘤体积和体重。治疗15天后采集了肿瘤组织的代表性图像(图4e)。PBS、PBS+L和2PhNVDPP NPs组对肿瘤的生长抑制没有差异。相比之下,对于2PhNVDPP NPs+L组,观察到几乎完全抑制了肿瘤进展,治疗后15天内未观察到复发(图4g)。此外,在15天的治疗期间,各组体重没有明显差异,表明2PhNVDPP NPs治疗在808 nm激光照射下对小鼠的毒性作用最小(图4h)。因此,这些结果表明,2PhNVDPP NPs具有作为具有成像和治疗功能的光疗剂的潜力。
总之,研究者通过采用受体平面化、π共轭扩展和供体旋转的协同操纵策略,成功制备了高度稳定的NIR-II发光二自由基光致变色剂。通过在DPP受体核心侧翼引入共轭二烯并在分子骨架上外部添加4-(N,N-二甲氨基)苯基,合成了两种创新的二自由基化合物2PhNVDPP和PhNVDPP。这两种二自由基类化合物都表现出的NIR-II发射,延伸到1300 nm。单晶结构分析表明,共轭二烯DPP受体核的高平面性和分子两端扭曲供体的空间位阻通过增强自旋离域和抑制分子间π-π堆积效应,共同促成了高度稳定的NIR-II二自由基发光性能。在形成水分散性NPs后,2PhNVDPP NPs表现出增强的NIR光收集能力,在808nm处的摩尔吸光系数是PhNVDPP NPs的6倍。更重要的是,凭借出色的稳定性、良好的生物相容性、53%的卓越PCE和NIR-II发射能力,2PhNVDPP NPs成功地促进了高质量的全身血管和肿瘤成像。此外,2PhNVDPP NPs已被用于NIR-II FLI引导的PTT体内抗肿瘤。据我们所知,据报道,2PhNVDPP是用于成像引导的癌症治疗的具有NIR-II荧光发射的开创性稳定的双向光镜剂。这项研究有望激励研究人员开发稳定的NIR-II发光二羟基化合物,并促进NIR-II二羟基化合物染料在成像引导疾病诊断和治疗中的广泛应用。
参考文献
Feng L, Tuo Y, Wu Z, et al. Highly Stable Near-Infrared II Luminescent Diradicaloids for Cancer Phototheranostics[J]. Journal of the American Chemical Society, 2024, 146(47): 32582-32594.
⭐️ ⭐️ ⭐️
动物活体荧光成像系统 - MARS
In Vivo Imaging System
高分辨率 - 定制高分辨大光圈红外镜头,空间分辨率优于3um
荧光寿命 - 分辨率优于 5us
高速采集 - 速度优于1000fps (帧每秒)
多模态系统 - 可扩展X射线辐照、荧光寿命、光声和光热成像、原位成像光谱,CT等
显微镜 - 高分辨显微成像系统,兼容成像型光谱仪
⭐️ ⭐️ ⭐️
恒光智影
上海恒光智影医疗科技有限公司,被评为“国家高新技术企业”,“上海市专精特新中小企业”,荣获“科技部重大仪器专项立项项目”,上海市“科技创新行动计划”科学仪器领域立项单位。
恒光智影,致力于为生物医学、临床前和临床应用等相关领域的研究提供先进的、一体化的成像解决方案。
专注动物活体成像技术,成像范围覆盖 400-1700 nm,同时可整合CT, X-ray,超声,光声,光热成像等技术。
可为肿瘤药理、神经药理、心血管药理、大分子药代动力学等一系列学科的科研人员提供清晰的成像效果,为用户提供前沿的生物医药与科学仪器服务。





