荧光计算机断层扫描技术(FLECT)成像原理及应用
导读
由于精诺真光学成像的专利保护早已经结束,近几年市场的光学成像设备品牌在增加,尤其是国内品牌的增加。生物发光成像的技术门槛比较低,这种品牌的增多是有利于终端用户的,在未来的2-3年,二维光学技术为主的设备市场价格会进一步降低,应该接近其合理的价位:80-120万人民币,考虑到质保年限,3-5年全保的价位应该在150万以内,这里的全保是包括CCD的。
但是真正的三维小动物光学成像设备,还没有拉开竞争的序幕。虽然原PE(Revvity)在市场上销售了不少Spectrum,这仅仅是商业上的成功,而并非技术上的进步。三维光学活体成像的目标是高分辨率、真实定量、全深度、微量检测、类PET的结果分析能力。
15年前科学家已经深入研究了影响光学小动物活体成像结果的因素[1],归纳为以下几点:
1)不同成像设备的结果不一致;2)动物操作误差;3)缺乏组织、疾病和免疫靶向的特异性染料;4)组织对比度;5)皮肤和组织的自发荧光;6)解剖学位置与荧光信号配准困难;7)缺乏成像仪器性能规范和标准;8)研究级别的光学小动物成像分辨率与临床设备不平行;9)高背景光干扰;10)光子在生物组织中的自然散射;11)穿透深度。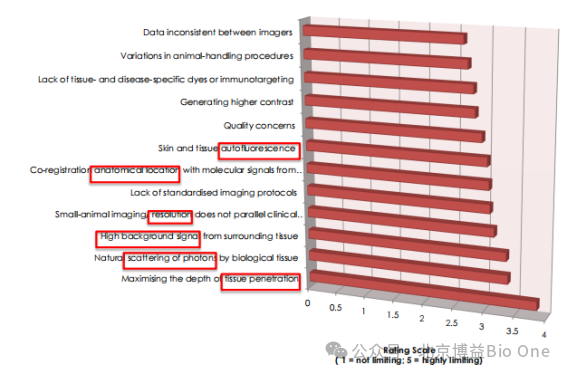
本文以下内容如果没有写明光学、荧光/生物发光等,仅针对荧光成像技术。
一、荧光成像
1、技术原理
荧光(Fluorescence)是自然界的一种常见发光现象。当荧光物质受到激发光照射时,内部的分子或原子吸收光子从基态跃迁到激发态,随后释放能量发出波长更长的发射光,这种发射光就是荧光。将荧光物质共价结合或物理吸附在所要研究分子的某个基团上[2],具有无放射物污染、操作简便、容易观察等优点,可借助荧光特性对被标记对象进行定性、定位以及定量分析。2、荧光发射计算机断层扫描成像技术
荧光发射计算机断层扫描(Fluorescence Emission Computed Tomography,FLECT)专利技术,荣获科学杂志评选的“2011年十大创新技术”之一,是业界第一台能够提供定量荧光三维数据的设备,为临床前小动物模型的全身成像和体内表征提供了无与伦比的检测能力。如图2所示,成像时激光直接导入FLECT准直器组件中,激发小鼠体内的荧光。一个由48个光电二极管组成的探测器环环绕在小鼠周围,收集发出的荧光信号。通过激光光源和探测器围绕待测动物旋转,可设置不同层厚进行全角度断层扫描,从而获得3D数据。采集完成后,所获取的FLECT数据被重建服务器重建成一个立体图像,进行三维可视化观察。
美国TriFoil Imaging开发了首台断层扫描技术融合的双模态影像设备--InSyTe FLECT/CT。将FLECT和同轴一体的X射线CT断层扫描成像整合到一个仪器中,提供具有解剖学参考的分子成像能力。采用其专利的旋转龙门架设计收集完整角度的动物体内的光学和X射线投影,FLECT类同与PET和SPECT技术的光学成像,具有无放射性性,高性价比的优势。探测器旋转360°对荧光信号进行采集,结合600-900nm之间的近红外激光光源,荧光断层扫描技术重建算法使得荧光在实验动物体内可实现无损耗三维重现,从而获得动物深层组织的荧光信号,彻底解决了传统设备荧光探测深度不够、二维光斑不能精确定量等问题。
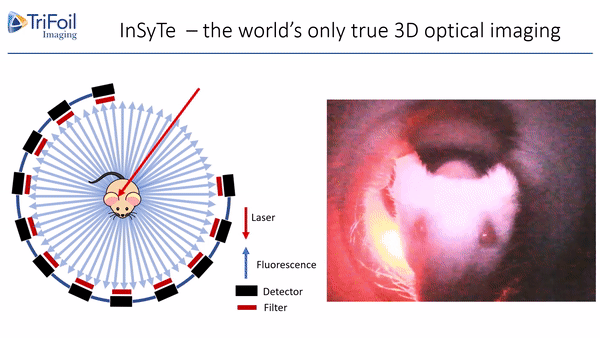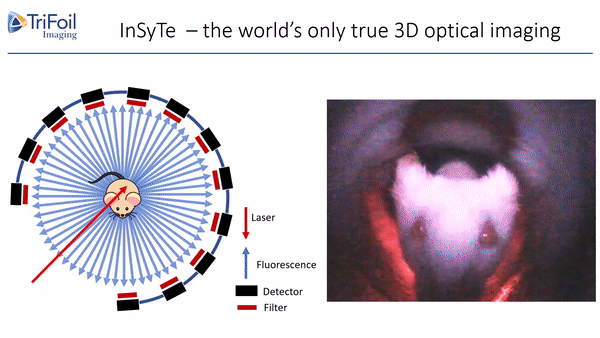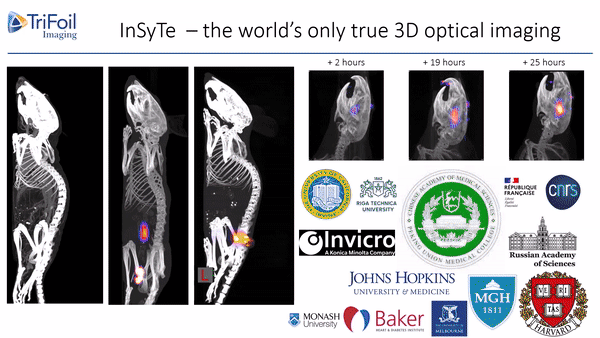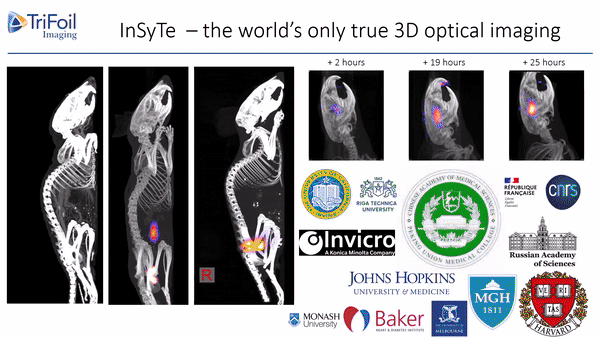 图2.FLECT技术原理示意图
图2.FLECT技术原理示意图二、重建高分辨图像的能力
InSyTe FLECT/CT系统有两个重建引擎,一个用于荧光图像重建,另一个用于CT图像重建。
1、荧光图像
荧光图像重建是将被测物体的表面信息与采集到的荧光数据结合起来,形成荧光源在被测物体中分布的三维表征。将表面信息和荧光数据提交至专用的重建服务器。采用荧光重建专用引擎(FluoroTom),利用辐射传递方程和球谐函数,基于组织中光传播的正演模型以“有限差分”方法导入传递方程。考虑了组织的光散射、吸收和反射等光学特性,以及组织结构的影响,模拟光在组织中的传播路径、分布和吸收情况,是目前最精确的光学定量技术。FLECT能够提供多角度重建方法和360°三维荧光成像功能,获取全角度成像三维影像,可从冠状,矢状,横断观察感兴趣区域(Region of Interest,ROI),定位光斑位置,生成沿着z轴旋转的动态最大密度投影动画(Maximum Intensity Projection,MIP),并能保存所有深度精准的荧光信号点的三维信息及总含量信息。如图3所示,FLECT可对荧光信号的反射、散射吸收和校正,在不同的荧光浓度中具有一致的线性(R²=0.9985),确保了准确性和重复性。
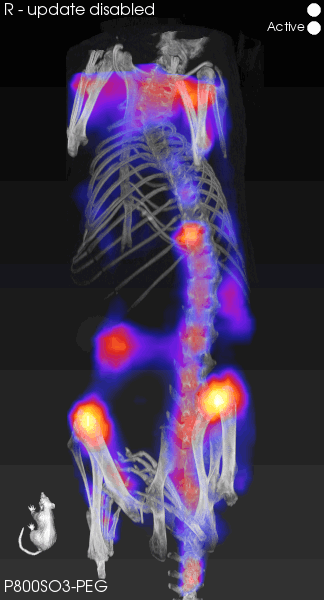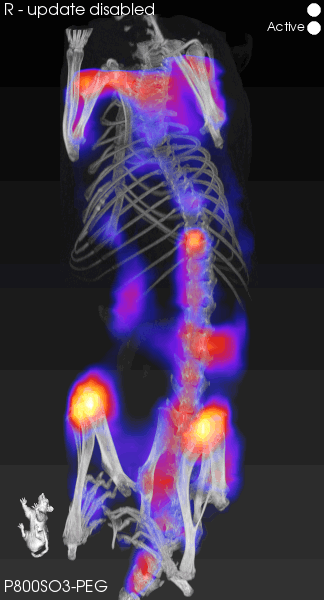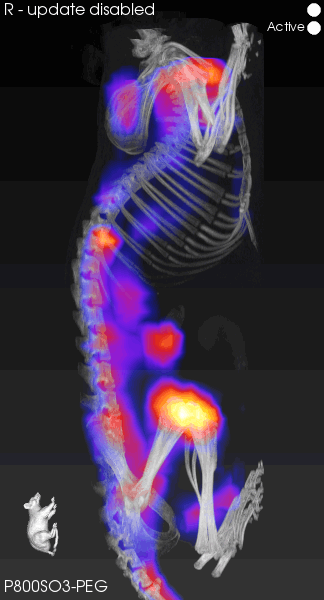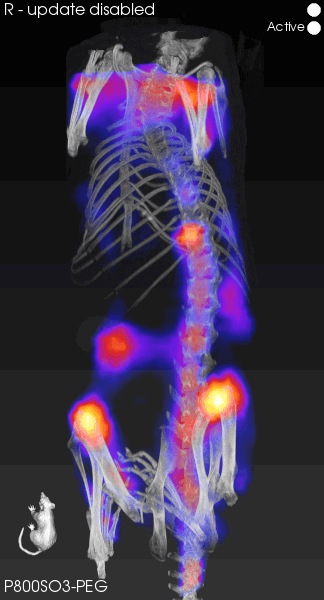
FLECT可以精确地追踪荧光信号,将解剖学位置与荧光信号共配准融合,极大地提高了定位的准确性和数据的可靠性。虽然我们的常规成像设备在小动物成像上表现出色,但在深层的组织成像中,我们仍面临分辨率不足的问题。如图4所示,FLECT的分辨率能够达到1mm3,展现出临床水平的成像效果。覆盖大多数组织的深度,可以达到2.4-4cm的检测能力,利用先进算法对荧光信号的反射、散射吸收和校正,直接输出无背景光的图片,更清晰地观察到深层的荧光信号,体现了技术的可靠性和算法的先进性。
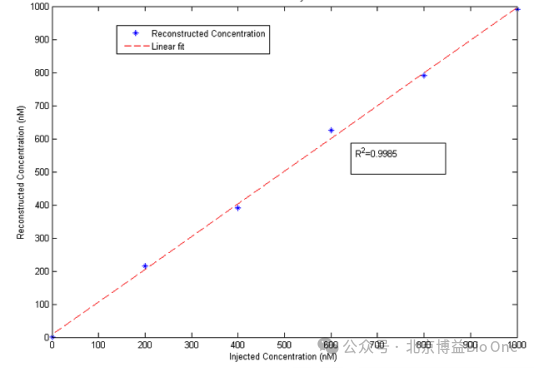
图3.重建浓度与注射浓度拟合曲线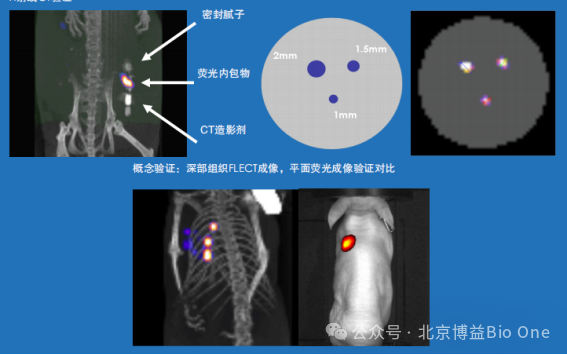
图4.高分辨率荧光图像重建
2、CT图像
利用X线穿透不同密度和厚度组织结构后,发生不同程度吸收而产生的影像对比,形成不同灰阶图像。高密度组织(如:骨骼),具有较高的衰减系数,CT上显示亮;低密度组织(如:肺),具有较低的衰减系数,CT上显示暗。
采用COBRA锥形线束算法,真正在轴位旋转扫描时实现三维图像的采集和重建。使用CT滤光片(铝、钼和锡)来增强软组织对比度并减少束流硬化效应,通过去除、降低锥形线束引起的伪影来获得最佳的CT图像质量。可以对整个ROI或部分ROI区域的X射线投影进行重建。投影次数越多,重建时间越长,得到的图像分辨率越高。
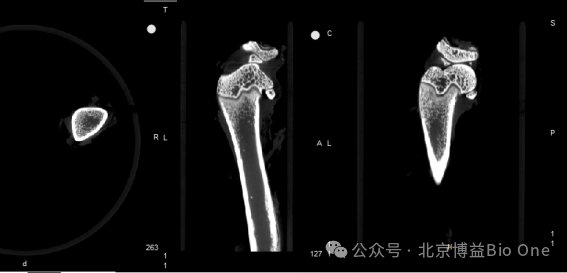
图5.FLECT/CT骨骼成像效果(可见骨小梁结构)
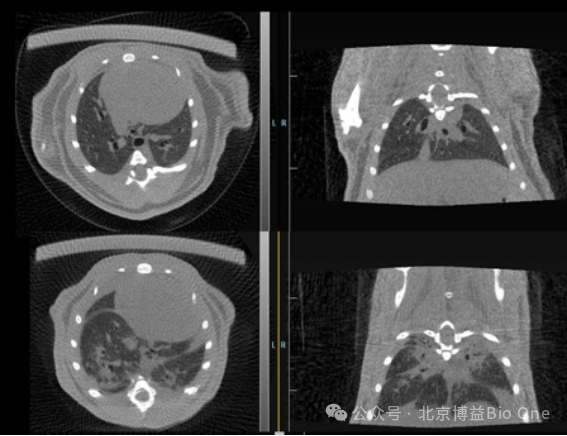
图6.FLECT/CT软组织成像效果(可评估肺结节纤维化程度)
3、共配准融合
InSyTe FLECT/CT采用双滑环技术,微型X射线管(激光光源)与高灵敏度探测器一同围绕摄影对象(小鼠)连续做断面扫描。具备多模态同轴化扫描,可多模态图像精准融合。CT成像单元和FLECT成像单元采用同轴化双模态设计,一次性扫描成像,无需重新摆放或移动样本。避免了多模态图像融合的潜在问题:如:融合位置不精确、延迟等。CT系统不仅能提供解剖学相关信息,还能改善散射校正,提高光学成像精度。
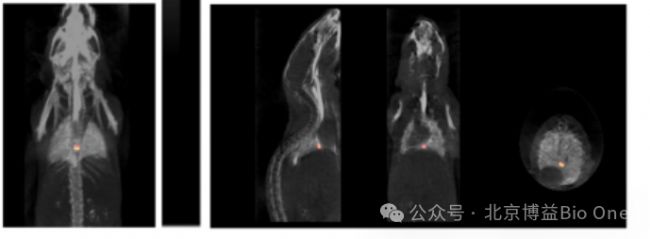
图7.FLECT/CT用于肺静脉栓塞诊断成像[3]
(应用实例[3]:研究团队开发了一种特异性荧光探针(Targ-Cy7),单链抗体scFv靶向结合血栓中活化血小板受体GPIIb/IIIa,用于颈动脉血栓、肺静脉栓塞体内成像。)
三、深层组织检测能力
1、生物组织对光线的吸收
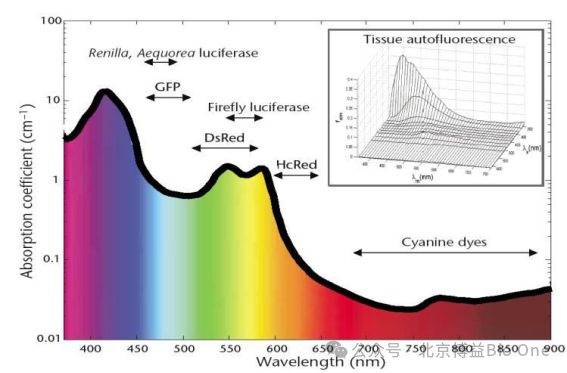
在700-900nm这段近红外区域内,存在一个“光谱窗”(Spectral Window)。在这个“光谱窗”内,生物组织对光线的吸收作用大大降低,光线可以进入更深一些的组织。同时,由于血红蛋白和细胞色素含氧量不同导致的吸收光谱的差异仍然可以分辨。当波长大于900nm时,组织中的水成分对光子的吸收作用十分强烈,光子进入组织数毫米就会被吸收殆尽。而在低于700nm的可见光范围内,血红蛋白对光线的吸收作用大大增加,同时,组织的散射作用也十分厉害[4]。因此,在医学研究中通常使用波长位于光谱窗内的近红外光作为探测光源。FLECT采用被称作“医学光谱之窗”的介于600-900nm之间的近红外光,如图8所示,利用该波段光谱低自发荧光、低组织吸收以及良好的组织穿透能力等优点。该波段荧光染料具备全身、深部组织断层成像所需的最佳特性。
2、激发荧光的光源
FLECT采用激光作为激发光,对荧光源的激发效率较高,远远优于宽带光源,安装在超低反射率、0.1Na准直器中进行聚焦,覆盖动物周围360度,使得激光光束能够穿透组织较深的部位,在接收器上生成清晰而集中的图像。如图9所示它的荧光检测器是由48个高灵敏度、低噪声的硅光电二极管组成的探测器环(量子效率>85% @ 500-900 nm),扫描时每一层的每一个角度都被采集48次,通过算法的优化和校正,得到的数据更准确。


四、活体内三维定位能力
在光学活体成像中,理想情况下,信号与靶标的实际位置能够100%的重合。然而,倘若检测到的信号发生偏移,导致错误定位,那么这种情况相较于没有信号,实则更加糟糕!我们注意到,二维成像的荧光强度受拍照角度的限制和检测深度的限制,如果对小鼠的正面、背面、侧面不同方向的荧光成像,它的荧光强度和位置是不一致的。此外,受背景光的干扰,不得不解剖小鼠,离体成像得到结果,不仅增加了实验的复杂性和难度,也限制了一些实验方案的设计,其原因主要包括光学特性和成像设备的检测方法等。从光学特性角度来看,当光子从组织表面某处进入组织,并以一个固定的速度传输。这个速度取决于该介质的光折射率(即光速(mm/sec)=3.0×1011/n,n是该介质中的折射率)。光子在传输过程中会发生两种情况:一种情况是光子在某个传播位置上被组织内的载色体吸收而停止继续传播;另一种情况是光子遇到一个可以被看成散射源的粒子,这时就会发生随机性的弹性碰撞(即只改变其传输方向而速度保持不变)。光子由于弹性碰撞改变了飞行方向,并沿着这个方向继续传播,而后此光子或被吸收或再次发生散射。这个过程不断进行,直到光子被吸收或逸出介质[4]。
从光学成像设备的检测方法来看,现有的光学成像系统借助单个检测器通过反射(a)或透射(b)方式,实现探针在样本体内成像。在反射成像时,激发光(输入)照射样本表面,然后收集来自样本同一表面发出的荧光(输出)。透射光是从检测器的相反方向照射样本,因此光传播路径是穿透样本的。这两种方法都存在明显弊端:反射法仅能从动物体表面收集到准确的数据;而透射法由于使用单个检测器,使得整个样本的成像质量并不统一,输出侧的灵敏度和分辨率都要高于输入侧[6]。
FLECT技术是从样本的全方位角度进行激发并精确测量发射光子,避免了局部断层成像方案中出现的扭曲失真和伪影情况。因为激发光和荧光发射光是要透过动物样本这个散射介质,光的散射会影响分辨率和定量结果。FLECT先进的重建算法已将这些因素考虑在内,通过在动物样本实际体积内建立3D分布模型并使用精确的光在组织中传播模型来解决这些问题。这种方法与以前的方法相比少了很多的假定,从而提高了成像性能。
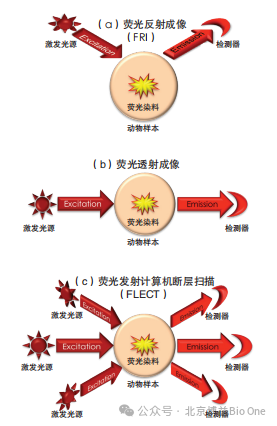
图10光学成像系统检测方法[5]
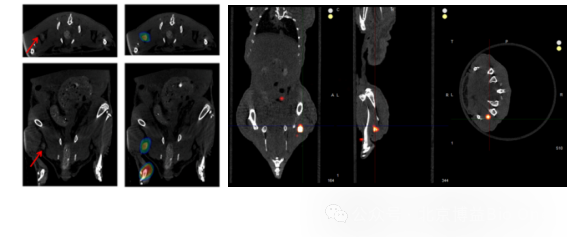 图11.FLECT/CT用于肿瘤靶向探针多模态成像[7]
图11.FLECT/CT用于肿瘤靶向探针多模态成像[7]
应用实例[7]:研究团队利用荧光染料Cy7和放射性Cu64,双标记转铁蛋白包裹的纳米探针(64Cu-GdF3@Tf-Cy7 NPs)上,能够进行PET和光学成像。探针会靶向结合到肿瘤上,如果肿瘤发生淋巴转移,会先被前哨淋巴结中的巨噬细胞吞噬,前哨淋巴结出现荧光。作用利用CT、PET/CT、FLECT/CT三种成像结果,可视化原发肿瘤是经前哨淋巴结转移的。
五、荧光绝对定量能力
随着市场上各种荧光标记试剂盒的出现、分子探针以及报告基因转染的进展,荧光成像变得更加容易,并且可以在大多数实验室进行。传统上,二维光学成像在高通量筛选中有着典型的应用,而三维光学成像则被用于定量研究。二维光学成像在探测生物发光和表面荧光信号、筛选“是/否”定性方面非常有效;然而,由于生物组织对可见光和近红外(NIR)波段光的非线性衰减,随着荧光源深度的增加,数据变得更加不确定性和不可靠。二维光学成像由于缺乏深度信息而产生数据采集缺失,同时缺乏解释光子的算法理论问题。例如,肾部成像时,动物应处于俯卧位,肝/膀胱显像时,动物应处于仰卧位。研究人员必须手动改变动物的位置,从不同角度观察它,这就是二维荧光成像的所谓“位置敏感”问题。
FLECT同时获取透射信号和反射的全角度信号。利用CT采集的数据进行基于对比度的分割,将光学数据应用于CT选择的指定区域,并执行重建。在动物周围360°采集信号,因此,FLECT克服了“位置敏感”问题。FLECT是目前最精确的光学定量技术,此突破性的光学成像性能助力研究人员产出真正前所未有的实验成果,实现荧光信号的绝对量化。
1、不同深度的定量结果
利用光学特性的圆柱形模拟假体(µa = 0.1 cm-1, µs’=10 cm-1),距表面12 mm和5 mm的深度含有2个直径为3 mm的内腔,用于模拟浅表层和深层的检测深度。通过将倍比稀释后的,不同浓度的荧光染料填充到假体进行扫描,建立浓度-荧光强度的标准曲线(1-13 μM)。FLECT/CT的定量结果:R2(@5 mm)=0.9814;R2(@12 mm)=0.9921
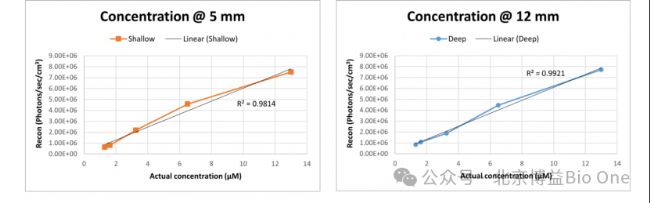
图12.不同深度的定量结果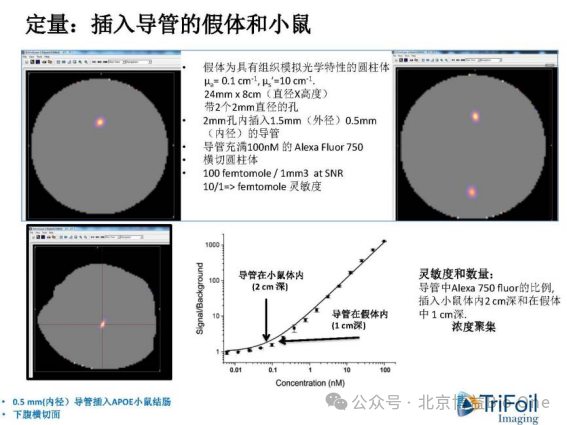
图13.测试用假体与小鼠体内荧光强度拟合曲线
2、不同方向的定量结果
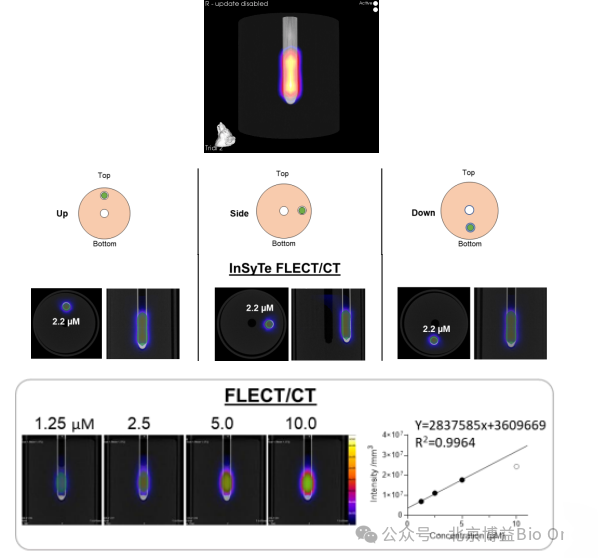
将不同浓度的ICG荧光染料(1.25μM、2.5μM、5μM、10μM)填充到假体进行扫描,建立浓度-荧光强度的标准曲线。注射已知浓度(2.5μM)ICG,调整假体方向,进行成像并计算浓度。
如图14所示,FLECT/CT的定量结果:R2(@12 mm)=0.9964,检测浓度是2.2μM;不仅准确定位到假体中的荧光信号,而且不同角度的成像结果是一致的;说明FLECT采用360°检测荧光信号,成像结果不受检测方向的影响,克服了位置敏感性的问题。
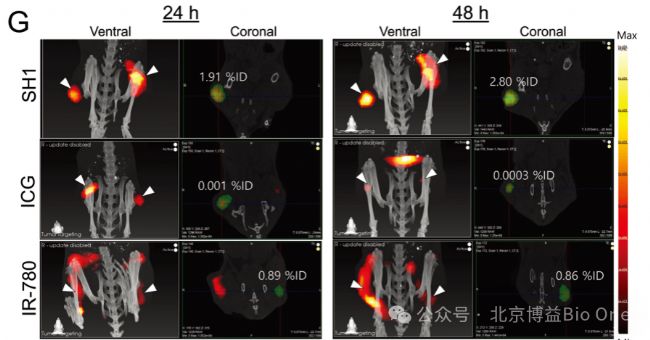
结论
综上所述,荧光发射计算机断层扫描技术(FLECT)克服了已有荧光成像的局限,解决荧光在动物体内的精准三维定位、检测深度、高分辨率图像、定量实验,实现功能成像与结构成像两种方法学的结合,为科研工作者提供了更为准确、高效的临床前研究工具。
参考文献:
[1]Comley, J. IN VIVO PRECLINICAL IMAGING- An essential tool in translational research. Drug Discovery World Summer 2011, 1–13 (2011).
[2]骆清铭.生物分子光子学研究前沿[M].上海交通大学出版社,2014.
[3]Bock L , Yu Y , Lin-I H A ,et al.A Unique Recombinant Fluoroprobe Targeting Activated Platelets Allows In Vivo Detection of Arterial Thrombosis and Pulmonary Embolism Using a Novel Three-Dimensional Fluorescence Emission Computed Tomography (FLECT) Technology[J].Theranostics, 2017, 7(5):1047-1061.
[4]张艳.光学CT成像算法研究---生物组织中光子传输的计算机仿真模型[D].沈阳工业学院,1999.
[5]Wang H , Kang H , Dinh J ,et al.P800SO3-PEG: a renal clearable bone-targeted fluorophore for theranostic imaging[J].Biomaterials research, 2022, 26(1):51.
[6]Wunder A , Klohs J .Optical imaging of vascular pathophysiology[J].Archiv für Kreislaufforschung, 2008, 103(2):182-190.
[7]Shi X , Gao K , Xiong S ,et al.Multifunctional Transferrin Encapsulated GdF 3 Nanoparticles for Sentinel Lymph Node and Tumor Imaging[J].Bioconjugate Chemistry, 2020, 31(11):2576-2584.
[8]Tumor-Associated Immune Cell Mediated Tumor Targeting Mechanism with NIR-II Fluorescence Imaging[J].Advanced Materials, 2021.
若您想要了解更多关于FLECT/CT成像系统的内容,或预约使用FLECT/CT设备进行相关实验,欢迎您通过以下方式联系我们:
应用支持Tel:13810910943 Email:13810910943@139.com
联系电话:010-64841721/1727,64842355/2356,58294864/4669,13810818543
E-mail:13810818543@139.com





