类器官和CRISPR 筛选在疾病建模中的应用
【能量补给站】
CRISPR/Cas 被认为是细菌或古细菌在抵抗来自质粒或噬菌体的外来 DNA 的过程中进化出的“获得性免疫系统”。基本原理是通过一段与靶标 DNA 相同的 gRNA 指导 Cas9 核酸酶对靶向基因进行 DNA 修饰,以此造成基因的功能突变或缺失[1]。
结直肠癌 (Colorectal cancer, CRC) 是男性和女性中第三大最常见的新诊断癌症类型,其特点是患者之间存在显著的遗传和表型异质性。虽然外显子组测序有助于复发性遗传病变的识别,但检测频率较低。
为了促进肿瘤驱动因素的高通量基因测试和功能鉴定,Michels BE 等人开发了一个在人类结肠类器官中进行 CRISPR-Cas9 联合筛选的平台,使得利用类器官进行体外和体内移植后肿瘤抑制基因的筛选鉴定成为可能[2]。
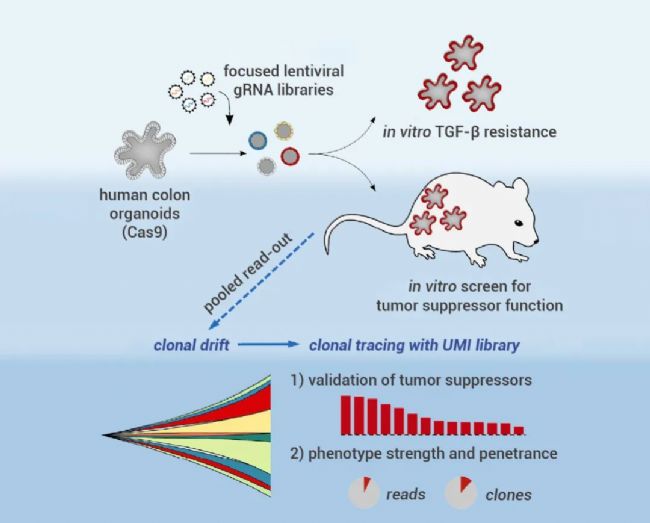
基于类器官的 CRISPR-Cas9 联合筛选的平台[2]。
 首先,作者通过药筛系统将携带 Cas9 蛋白的慢病毒载体转入结肠类器官,建立了稳定表达 Cas9 的人结肠类器官培养体系。正常人结肠类器官对转化生长因子-β (TGF-β) 敏感,在培养体系中添加 TGF-β 可以有效杀死类器官,而敲除 TGF-B 的受体基因 (TGFBR) ,即用针对 TGFBR2 的慢病毒 gRNA 转导则可以挽救 TGF-β 导致的细胞毒性。
首先,作者通过药筛系统将携带 Cas9 蛋白的慢病毒载体转入结肠类器官,建立了稳定表达 Cas9 的人结肠类器官培养体系。正常人结肠类器官对转化生长因子-β (TGF-β) 敏感,在培养体系中添加 TGF-β 可以有效杀死类器官,而敲除 TGF-B 的受体基因 (TGFBR) ,即用针对 TGFBR2 的慢病毒 gRNA 转导则可以挽救 TGF-β 导致的细胞毒性。
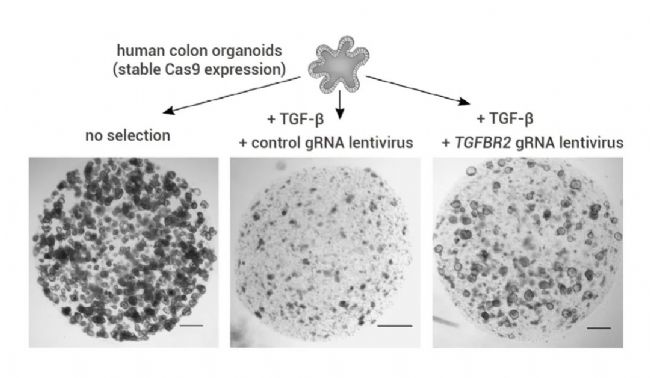
图 1. 稳定表达 Cas9 的结肠类器官的组织形态学[2]。
在对照培养基中(左)以及在对照 gRNA(中)或 TGFBR2 gRNA 慢病毒(右)存在下进行 TGF-β 选择 3 周后稳定表达 Cas9 的类器官的形态学。
【参考操作】[2]:
(一)类器官的培养:
1.完全培养基:含DMEM/F12,10 mM HEPES, 1x Glutamax, 1x penicillin/streptomycin, 2% B27, 1mM Nicotinamide, 12.5 mM N-Acetylcysteine, 500 nM A83-01, 10 mM SB202190, 50% Wnt3a, 20% R-spondin-1, 10% Noggin、50 ng/mL human EGF。
2. 类器官培养基每 2-3 天更换一次,每周传代一次,并在 Rho 激酶抑制剂 Y-27632 (10 mM) 的存在下培养在基底膜基质胶中。
(二)类器官的转染:1. 通过移液多次机械分散类器官,然后进行 Accutase 消化以获得单细胞。
2. 洗涤后,将细胞重悬于含有 Rho 激酶抑制剂 (10 μM) 和 Polybrene(8 μg/mL) 的培养基中,并进行旋转转染 (500*g,1 小时,32°C)。
3. 37°C 孵育 3-5 小时后,将细胞接种到 Matrigel 中。转染后 2 天开始选择。
随后,作者设计了针对 TGF-β 通路的 6 个关键组分 (图 2A) 和 94 个对照基因。每个基因都被 20 个独立的 gRNA 靶向,整个文库包含 2,200 个 gRNA,并被转导到稳定表达 Cas9 的正常人结肠类器官中 (图 2 B)。以混合方式提取基因组DNA,并通过 NGS 分析慢病毒条形码。针对 TGFBR1 和 TGFBR2 的单个 gRNA 富集程度最高,证实了筛选系统的有效。
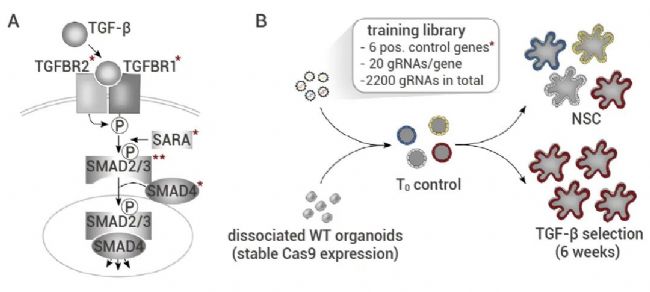
图 2. 使用 TGF-β 耐药性训练库进行类器官筛选[2]。
接着,作者对异种移植类器官中的肿瘤抑制功能进行体内筛选。作者构建了一种预致瘤类器官系,AK 类器官 (APC-KO/KRASGG12D),即缺失 APC 和致癌 KRASG12D 等位基因的结肠类器官。其仅在敲除 TGFBR2 (AKT 类器官) 后才显示出生长。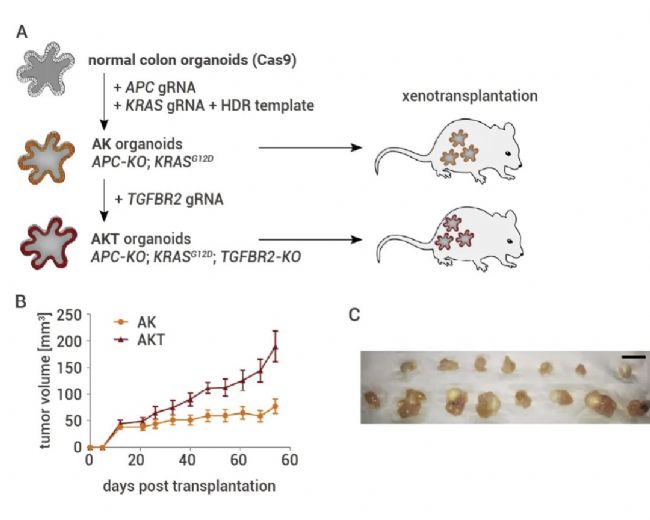
图3. 肿瘤抑制功能可移植类器官模型的开发[2]。
(A) 实验设置。致瘤前类器官系(AK:APC-KO 和 KRASG12D)和皮下移植后致瘤系(AKT:额外 TGFBR2 -KO)。(B) NSG 小鼠(n = 7 和 8 只小鼠)中移植 AK 和 AKT 类器官后肿瘤体积 (±SEM) 的测量。(C) AK(上排)和 AKT 类器官(下排)移植后的肿瘤形态。
【参考操作】[2]:
(一)AK(APC−/−,KRASG12D)类器官:
1. AK (APC−/−, KRASG12D) 类器官按照使用 WT 类器官的描述生成。该类器官用含有 Cas9 和 APC gRNA 的 lentiCRISPR v2 转导,并在连续嘌呤霉素选择 (0.5 μg/μL),不含 Wnt、Rspondin 的情况下培养。
2. 分离、扩增单个克隆,并通过 Sanger 测序证实 APC 突变。
3. KRASG12D 是通过将 KRAS gRNA 与单链修复模板一起瞬时共转染到质粒 gRNA_GFP-T2 中而引入的。在不含 Wnt、Rspondin 和 EGF 且添加 0.5-1.0 mM EGFR 抑制剂的培养基中选择类器官。
4. 扩增克隆系,并通过 Sanger 测序证实 KRASG12D 突变。(二)AKT 类器官:
通过慢病毒 gRNA 将 TGFBR2-KO 引入 AK 类器官中,然后在缺乏 TGF-β 抑制剂 (A83-01) 且补充有 5 ng/mL 重组人 TGF-β 的培养基中进行选择,然后通过 Sanger 测序进行确认。
作者设计了一个泛癌 TSG gRNA 库,其中包含先前研究中发现的 85 个 TSG。对于每个靶标,设计了 20 个独立的 gRNA,包括对照在内,整个文库包含 2,600 个 gRNA。转导后,AK 类器官注射移植到 8-10 只 NSG 小鼠皮下(图 4)。11 至 12 周后,汇集所有肿瘤的基因组 DNA,并在 3 个实验重复中进行筛选,通过检测 sgRNA 序列的富集情况来判断发生突变的功能因子。筛选结果显示, TGFBR2是所有三个重复中富集度最高的 gRNA,表明 TGF-β 在肿瘤微环境中具有主导的生长抑制作用。提示该筛选体系可以有效的进行肿瘤抑制因子的体内筛选。
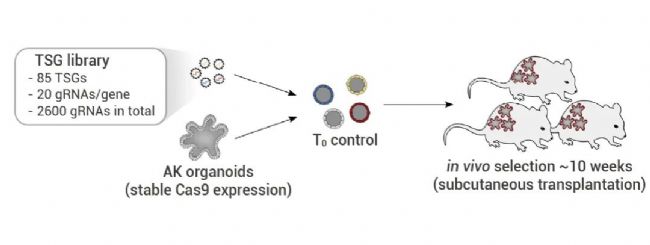
图 4. 移植人体类器官中肿瘤抑制功能的体内文库筛选[2]。
此外,也有一些针对非功能基因的 gRNA 被富集,表明存在假阳性。作者通过在sgRNA 载体引入 UMI (unique molecular identifiers) 的方式,显著提高了筛选的准确性,降低了假阳性率。该方法体系还可以扩展到结肠以外其它上皮细胞的筛选,将来可能用于个性化的肿瘤治疗。
看了这么多,相信大家对类器官的培养方法有了大概的了解。 MCE 现已推出类器官相关产品 55 折活动,截止到 2024.04.30,心动不如行动,来 MCE 官网查询具体的产品信息吧!
▐ 关于 MCE
MCE 可为类器官研究提供 11 种肿瘤类器官培养基,9 种正常组织类器官培养基,3,000+ 细胞因子与生长因子,以及类器官研究需要的 9 款基质胶。
MCE 类器官产品适用多个研究领域,批次间稳定性高,类器官分化生长效果好。部分产品如下 :







 MCE 的所有产品仅用作科学研究或药证申报,我们不为任何个人用途提供产品和服务。
MCE 的所有产品仅用作科学研究或药证申报,我们不为任何个人用途提供产品和服务。
[1] Zhu Y. Advances in CRISPR/Cas9. Biomed Res Int. 2022 Sep 23;2022:9978571.
[2] Michels BE, et al. Pooled In Vitro and In Vivo CRISPR-Cas9 Screening Identifies Tumor Suppressors in Human Colon Organoids. Cell Stem Cell. 2020 May 7;26(5):782-792.e7.





