癌症药物研发新方向KRAS 抑制及其相关药物解读
KRAS "一夜成名”
KRAS 突变是最常见的致癌驱动因子之一,一直被认为是 “不可成药” 靶点,直到2021 年 FDA 加速批准安进研发的 KRASG12C 抑制剂 Lumakras (Sotorasib) 上市,一时间,KRAS 炙手可热,耗时将近 40 年成功逆袭。毫无疑问,KRAS 是本次 年会中是最受关注的靶点之一。
表1. KRAS 相关药物
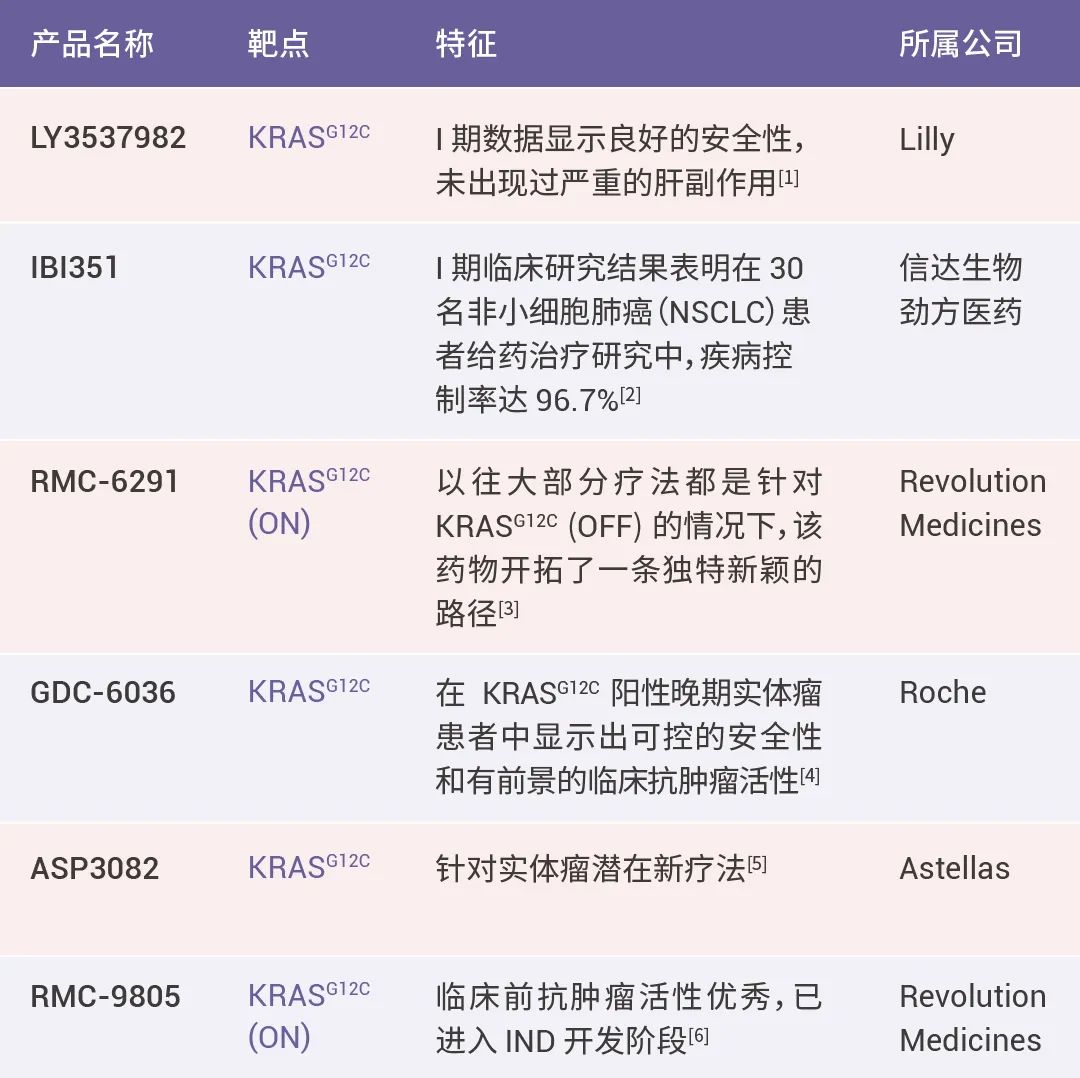
Kras 抑制剂 “一夜成名” 之后,引得多家医药巨头公司下场研发,然而 KRAS 的耐药性与高副作用,是亟待解决的难题。本次大会中多家医药公司带来的相关疗法从提高 KRASG12C 安全性、有效性入手,推动了 KRAS 抑制剂用于不同突变体、不同类型疾病的宽度,有望深入解决初代 KRAS 疗法的局限性,解答 KRAS 如何更好成药的疑问。
 KRAS 往期盘点 :
KRAS 往期盘点 :“不可成药靶点” KRAS: 关门才是大吉
打破魔咒,靶向“不可成药”!
还叫 “不可成药” 靶点?KRAS 已逆袭!
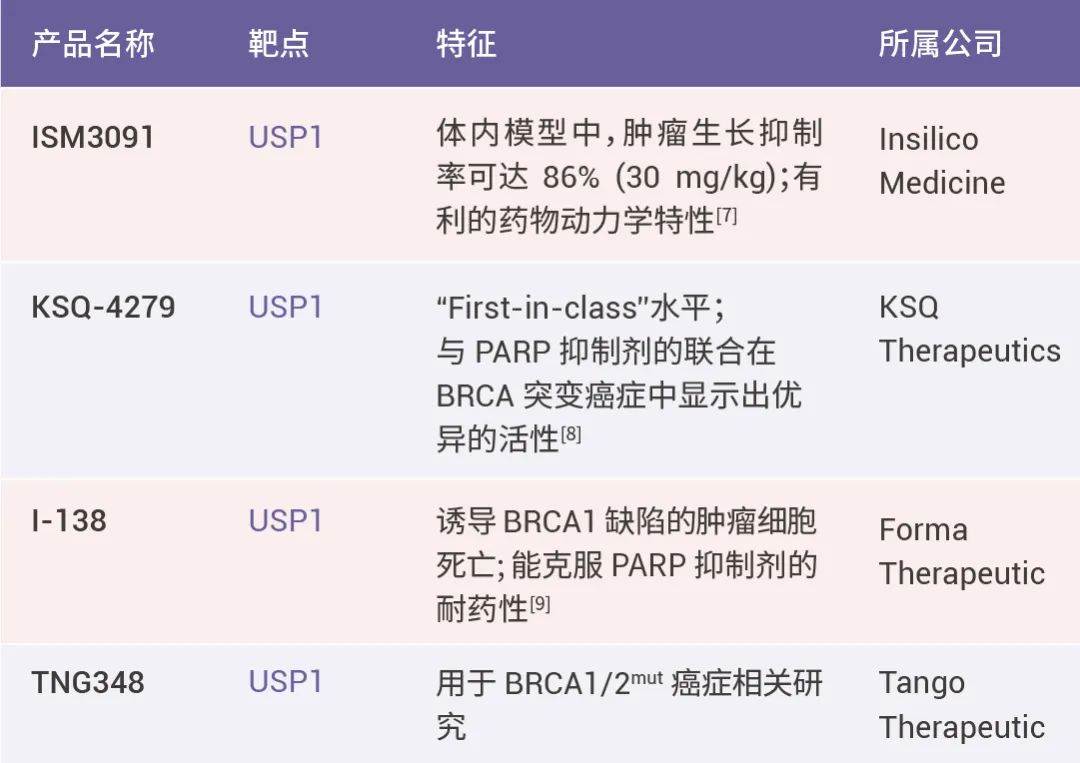
USP1——BRCA 缺陷肿瘤治疗 “突破口”
USP1 是本次 AACR 大会中的另一个高关注度抗肿瘤靶点。泛素特异性蛋白酶 1 (USP1) 是去泛素化酶家族成员,具有从各种靶蛋白中切割泛素的能力。USP1 在各种 DNA 损伤修复过程中发挥重要作用,是癌症发生的常见驱动因素之一。USP1 的缺失会降低 BRCA1 缺陷细胞的存活率并导致复制叉的退化,表明 USP1 抑制剂是BRCA 缺陷肿瘤的潜在有效疗法,并有望突破临床已有 PARP 抑制剂(PARPi)疗法的耐药性问题[7]。
表 2. USP1 相关药物
ADC "争奇斗艳"
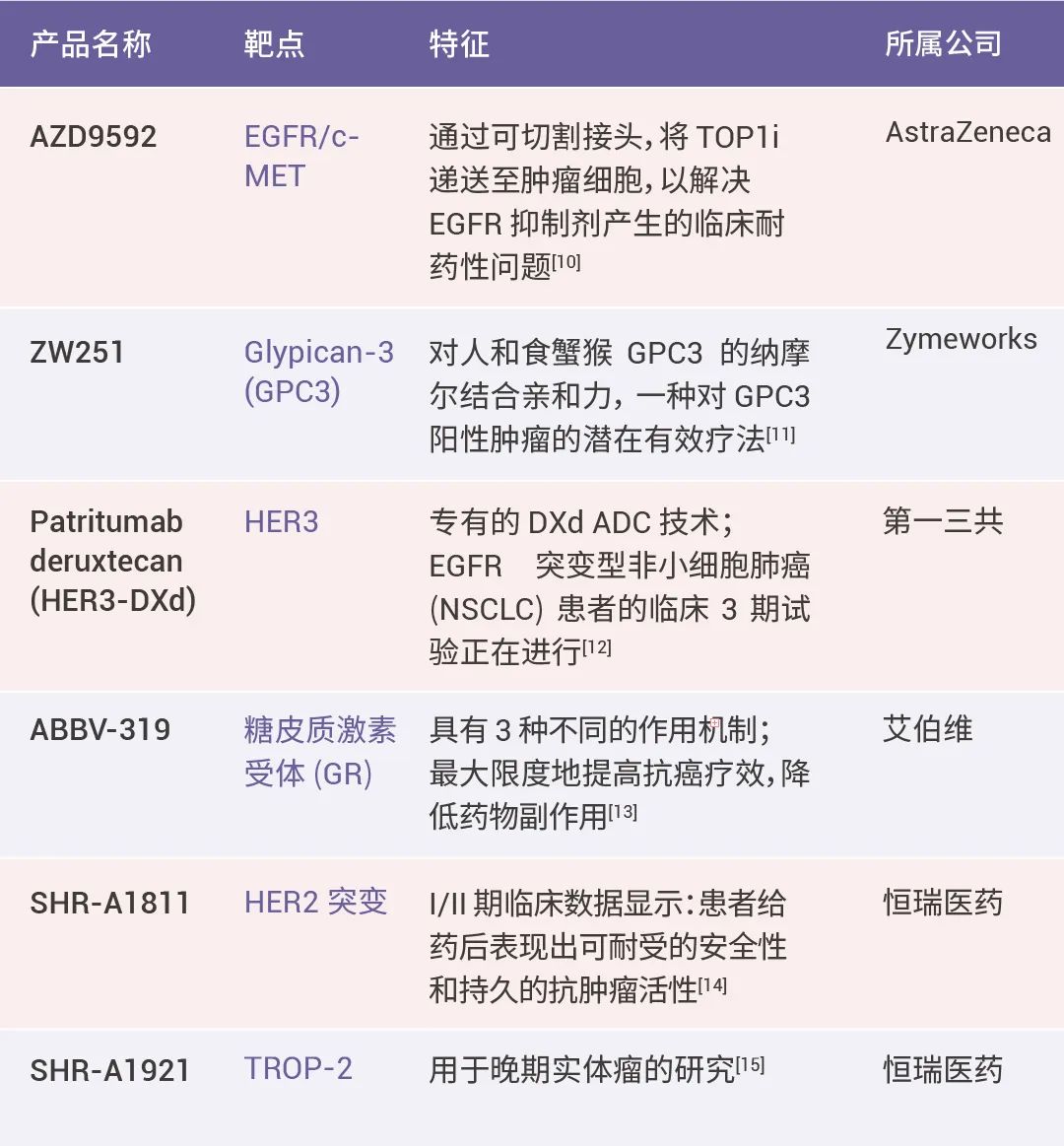
2022 年美国 FDA 加速批准首个用于铂耐药卵巢癌的抗体-偶联药物(ADC) Elahere® (Mirvetuximab soravtansine-gynx) 上市,自此 ADC 药物掀起了抗肿瘤领域的新一轮风浪。近日,百时美施贵宝 (BMS) 押注超 10 亿美元,和德国 Tubulis 达成合作,用于开发差异性 ADC 药物。
表3. ADC 相关药物
ADC 将抗体与小分子偶联以提高抗肿瘤疗效,新一代的 ADC 已经取得了非常优异的临床数据,然而,不可避免地出现药物稳定性、有效性及耐药性等问题。此次会议表明,通过优化结构设计和拓宽作用机制是改善 ADC 药代动力学特征,保证高疗效的同时避免耐药性的未来发展侧重点。
 ADC 往期盘点 :
ADC 往期盘点 :“魔法子弹”ADC
肿瘤靶向治疗的新浪潮:ADC
狂飙百亿!抗体偶联药物 ADC 究竟有什么魔力?
PROTAC "角力" AACR
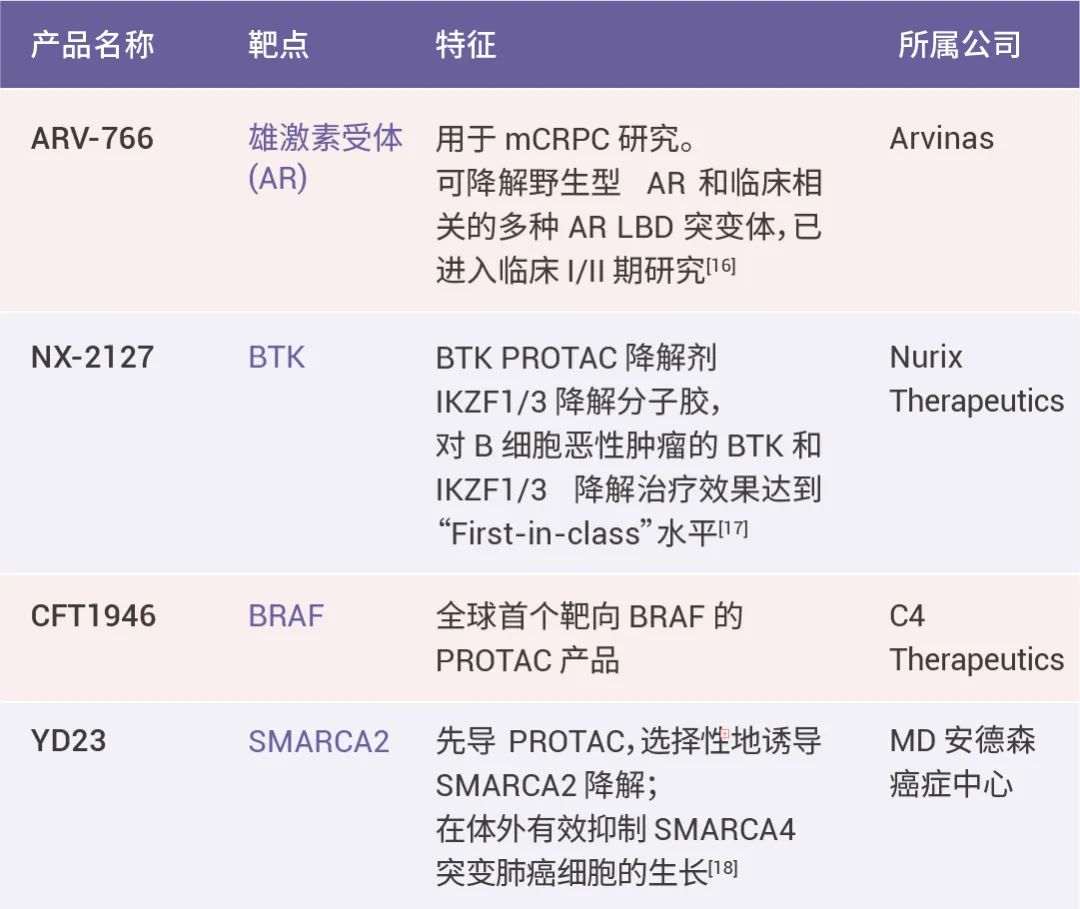
蛋白水解靶向嵌合体 (PROTAC) 具有两个共价连接配体,可以实现同时募集靶蛋白和 E3 泛素连接酶,以启动泛素-蛋白酶体系统 (UPS) 对靶蛋白的降解效果。在抗肿瘤治疗领域,占据着重要的一席之地。作为双功能新型分子剂型,本次大会中不少 PROTAC 令人瞩目。
表 4. PROTAC 相关药物
PROTAC 已广泛用于抗肿瘤治疗,但存在分子量过大而导致的膜渗透性低、药物动力学差、生物利用率低等不足,基于优化设计,开发多靶点 PROTAC 是解决目前困境的有效途径之一。
 PROTAC 往期盘点 :
PROTAC 往期盘点 :干货 | PROTAC 知多少
PROTAC——靶点选择与设计
PROTAC——靶点选择与设计 (二)
PROTAC——模块化构建药物分子的未来
Cell 重磅丨不依赖泛素蛋白酶降解途径的新型 PROTAC
AI 制药:新赛道,新惊喜
由于药物研发周期长、耗资高,近年来,不少药企另辟蹊径,专注于将人工智能 (AI)与实验结合,用于开发新药。AI 算法的加持,能大幅降药物研发成本,缩短药物研发周期。例如最近火爆的自然语言处理模型 ChatGPT,就能运用在药物研发领域的文献挖掘与“种子”药物识别,大大降低前期批量筛选成本。在这条新赛道中,不少药企带来了惊喜。
上述提及的领军者英矽智能报告了 4 款药物,针对不同靶点都有十分良好的临床前抗肿瘤活性与安全性,但临床效果如何还有待进一步验证。值得一提的是,首个英矽智能 AI 药物平台发现的小分子抑制剂 ISM001-055 已于 2022 年 3 月获批临床,用于治疗特发性肺纤维化,是AI制药领域的里程碑进展[19]。百图生科则专注于大分子预测,所开发的 xTrimoABFold++ 模型与 AlphaFold2 相比,在抗体上的预测精度提高了 30%,将大大推动虚拟筛选甚至是整个药物研发领域的进程[20]。
尽管目前 AI 制药仍然存在很多不足,例如模型可解释性、可靠性、药效在实验验证中是否与预测具有一致性等,与传统药物发现途径相比,这一领域仍然处于初期发展阶段,但也意味着随着 AI 技术的不断发展,这一领域的可挖掘空间巨大,或许能在将来掀起一场医药发现的革命热潮。
总结
本次大会集合了众多领域的优秀产品,可谓一场饕餮盛宴。由这次大会的亮点报告可知,针对不同的 KRAS 突变体与不同适应症 KRAS 抑制是新一代实体瘤疗法的热点方向,未来发展关注点为保证疗效的同时,降低副作用与耐药性。
而对于 PPARi 的耐药性 BRCA 缺陷肿瘤患者,开发 USP1 抑制剂是新的突破口。ADC 药物的设计优化与作用机制多元化是解决 ADC 药物低稳定性、高耐药性问题的关键。开发多靶点 PROTAC 药物是改善 PROTAC 疗效低的侧重点;AI 对于药物研发的加持,可大幅降低药物发现成本,是未来的大势所趋。
| 相关产品 |
| Sotorasib Sotorasib (AMG-510) 是一种有效的,口服生物可利用的,选择性的 KRAS G12C 共价抑制剂。 |
| RMC-6291 RMC-6291 是一种口服有效的 KRASG12C(ON) 共价抑制剂。RMC-6291 在 KRASG12C(ON) 和亲环蛋白 A (CypA) 之间的肿瘤细胞内形成三复合物。 |
| GDC-6036 GDC-6036 是一种具有口服生物利用度,选择性的 KRASG12C 抑制剂,IC50 为 <0.01 μM。 |
| KSQ-4279 KSQ-4279 (USP1-IN-1, Formula I) 是 USP1 和 PARP 的抑制剂。 |
| I-138 I-138 诱导 MDA-MB-436 细胞中 FANCD2 和 PCNA 的单泛素化,增加 HAP-1 USP1 WT 细胞中的 PCNA 和 FANCD2 单泛素化。 |
| MC-GGFG-AM-(10Me-11F-Camptothecin) ZW251 的 Linker-Payload,ZW251 是一种靶向人 GPC3 的抗体-药物偶联物 (ADC)。 |
| Patritumab deruxtecan Patritumab deruxtecan (HER3-DXd) 由全人抗 HER3 IgG1 单克隆抗体 Patritumab (HY-P99275) 通过基于四肽的可裂解接头连接到拓扑异构酶 I 抑制剂有效载荷组成。 |
| Glucocorticoid receptor agonist-1 phosphate Ala-Ala-Br 用于合成 ZW251 的 Linker-Payload 偶联物。 |
| ARV-766 ARV-766 是一种口服有效的 PROTAC。ARV-766 降解野生型雄激素受体 AR,但也降解相关的 AR LBD 突变体,包括最普遍的致病性 AR L702H、H875Y 和 T878A 突变。 |
| NX-2127 NX-2127 是一种口服有效的 BTK 抑制剂,可诱导细胞中突变的 BTKC481S 降解。 |
| CFT1946 CFT1946 是一种具有口服活性和选择性的 BRAF 激酶靶向配体,可用于肿瘤研究。 |
| YD23 YD23 是一个 SMARCA2 PROTAC。YD23 诱导 SMARCA2 的降解,而 SMARCA2 对 SMARCA4 是合成致死的。 |
MCE 的所有产品仅用作科学研究或药证申报,我们不为任何个人用途提供产品和服务
参考文献
[1] Drost J, et al. Organoids in cancer research. Nat Rev Cancer. 2018 Jul;18(7):407-418.
[2] Malia Alexandra Foo, et al. Clinical translation of patient-derived tumor organoids- bottlenecks and strategies Preclinical tumor models are an important platform for mechanistic research and testing of new drugs.Biomark Res. 2022 Mar 10;10(1):10.
[3] Nuciforo S, et al. Organoid Models of Human Liver Cancers Derived from Tumor Needle Biopsies. Cell Rep. 2018;24(5):1363-1376.
[4] Tiriac H, et al. Successful creation of pancreatic cancer organoids by means of EUS-guided fine-needle biopsy sampling for personalized cancer treatment. Gastrointest Endosc. 2018;87(6):1474-1480.
[5] Matano M, et al. Modeling colorectal cancer using CRISPR-Cas9-mediated engineering of human intestinal organoids. Nat Med. 2015;21(3):256-262.
[6] Yang H, et al. Tumor organoids for cancer research and personalized medicine [published online ahead of print, 2021 Sep 14]. Cancer Biol Med. 2021;19(3):319-332.
[7] Herpers B, et al. Functional patient-derived organoid screenings identify MCLA-158 as a therapeutic EGFR × LGR5 bispecific antibody with efficacy in epithelial tumors. Nat Cancer. 2022;3(4):418-436.
[8] Marc van de Wetering M, et al. Prospective derivation of a living organoid biobank of colorectal cancer patients. Cell. 2015;161(4):933-945.
[9] Neal JT, et al. Organoid Modeling of the Tumor Immune Microenvironment. Cell. 2018;175(7):1972-1988.e16.
[10] Cattaneo CM, et al. Tumor organoid-T-cell coculture systems. Nat Protoc. 2020;15(1):15-39.
[11] Clarke SR, et al. Characterization of the ovalbumin-specific TCR transgenic line OT-I: MHC elements for positive and negative selection. Immunol Cell Biol. 2000;78(2):110-117.
[12] Zhou Z, etc. An organoid-based screen for epigenetic inhibitors that stimulate antigen presentation and potentiate T-cell-mediated cytotoxicity. Nat Biomed Eng. 2021 Nov;5(11):1320-1335.
[13] Hidalgo M, et al. Patient-derived xenograft models: an emerging platform for translational cancer research. Cancer Discov. 2014;4(9):998-1013.
[14] Tuveson D, et al. Cancer modeling meets human organoid technology. Science. 2019;364(6444):952-955.
[15] Lau HCH, et al. Organoid models of gastrointestinal cancers in basic and translational research. Nat Rev Gastroenterol Hepatol. 2020;17(4):203-222.
[16] Gao D, Vela I, et al. Organoid cultures derived from patients with advanced prostate cancer. Cell. 2014;159(1):176-187.
[17] Kim M, et al. Patient-derived lung cancer organoids as in vitro cancer models for therapeutic screening. Nat Commun. 2019;10(1):3991. Published 2019 Sep 5.
[18] Yao Y, et al. Patient-Derived Organoids Predict Chemoradiation Responses of Locally Advanced Rectal Cancer. Cell Stem Cell. 2020;26(1):17-26.e6.
[19] Vlachogiannis G, et al. Patient-derived organoids model treatment response of metastatic gastrointestinal cancers. Science. 2018;359(6378):920-926.
[20] Ooft SN, et al. Patient-derived organoids can predict response to chemotherapy in metastatic colorectal cancer patients. Sci Transl Med. 2019;11(513):eaay2574.
[21] Hu Y, et al. Lung cancer organoids analyzed on microwell arrays predict drug responses of patients within a week. Nat Commun. 2021;12(1):2581. Published 2021 May 10.