Nrf2蛋白转录因子在诱导机体的抗氧化应答中的重要作用
外界刺激 (如药物、紫外线和电离辐射) 和内源性自由基和活性氧 (ROS) 会直接或者间接地损伤蛋白质、脂质和 DNA 等细胞成分,为了抵御这些不利影响,机体形成了一套复杂的氧化应激应答系统来缓解细胞所受的损害。而 Nrf2,作为调控抗氧化应激的一种关键转录因子,在诱导机体的抗氧化应答中起着重要作用,如调节氧化还原平衡、药物代谢和排泄、能量代谢、铁代谢、氨基酸代谢、生存、增殖、自噬、蛋白酶体降解、DNA 修复和线粒体生理机能。另外,Keap1-Nrf2 系统已成为癌症和神经退行性疾病以及许多自身免疫和炎性疾病的重要治疗靶点。
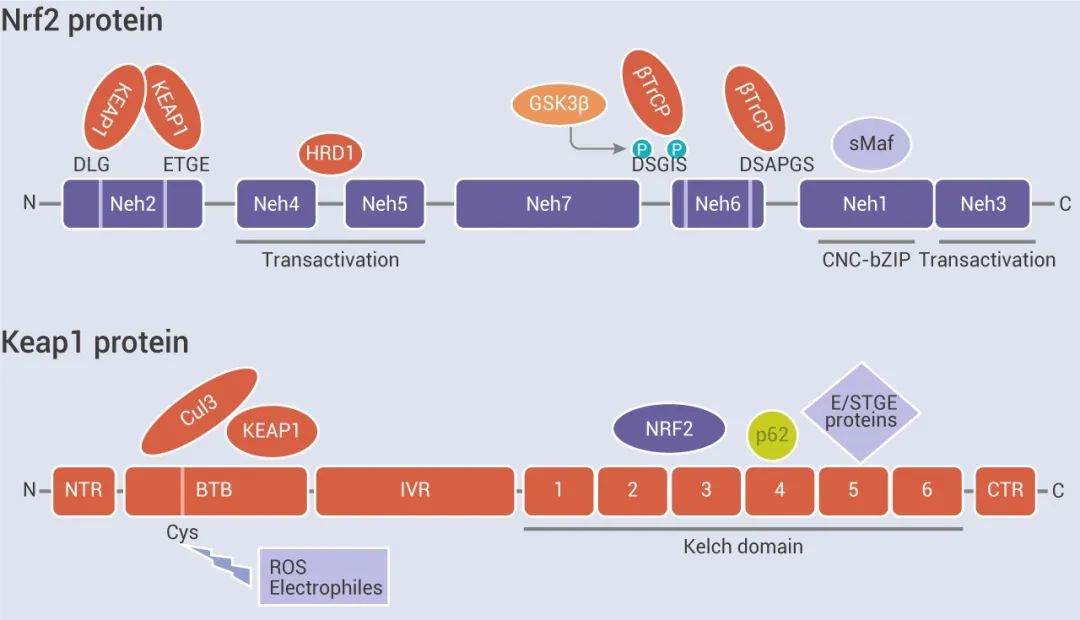
Nrf2 的自我介绍:大家好,我是 Nrf2~我是 Cap'n'collar (CNC) 转录因子家族成员,我的“身体”由七个 Neh 域 (Nrf2 ECH 同源结构域) 组成,每个域具有不同的功能,如 Neh1 CNC-bZIP 域负责与 small Maf (sMAF) 蛋白结合和二聚化;Neh2 结构域通过 DLG 和 ETGE 基序介导与 Keap1 的相互作用;Neh4、Neh5 和 Neh3 域对于 Nrf2 的反式激活非常重要;Neh6 结构域是一个富含丝氨酸的区域,可调节我的稳定性。大家猜猜,我是怎么被激活的呢?
图 1. Nrf2 及 Keap1 蛋白结构域[2]
Nrf2 的激活“大戏”
1、经典途径——Keap1-Nrf2 途径
说到 Nrf2 的经典激活机制,不得不提一提 Nrf2 老搭档——Keap1 (Kelch ECH 相关蛋白 1)。Keap1 是一种 Cullin3 (Cul3) 依赖性的 E3 泛素连接酶复合物的底物衔接蛋白,可与 Cul3 和 Rbx1 组装成功能性 E3 泛素连接酶复合物 (Keap1-Cul3-E3),进而对 Nrf2 进行调控。Keap1 含有三个功能域,包括一个 BTB 结构域,一个 IVR 和一个 Kelch 或 DGR 结构域。BTB 结构域结合 Cul3,是 Keap1 二聚化所必需的。Kelch/DGR 结构域可与上面提到的 ETGE 和 DLG 基序相互作用,这对于维持 Nrf2 和 Keap1 之间的相互作用至关重要。IVR 连接了 BTB 和 Kelch/DGR 结构域,含有一些可调节 Keap1 的活性的半胱氨酸残基。
在正常的生理条件下,Keap1-Cul3-E3 泛素连接酶靶向位于 Nrf2 N 端的 Neh2 结构域 (位于 DLG 和 ETGE 基序之间) 的多个赖氨酸残基,并促进泛素化,随后泛素化的 Nrf2 被递送至 26S 蛋白酶体进行降解。[PS: DLG 和 ETGE 与 Keap1 中的 Kelch 域相互作用,一般称为“铰链和闩锁” (Hinge-and-latch model) 模型]。
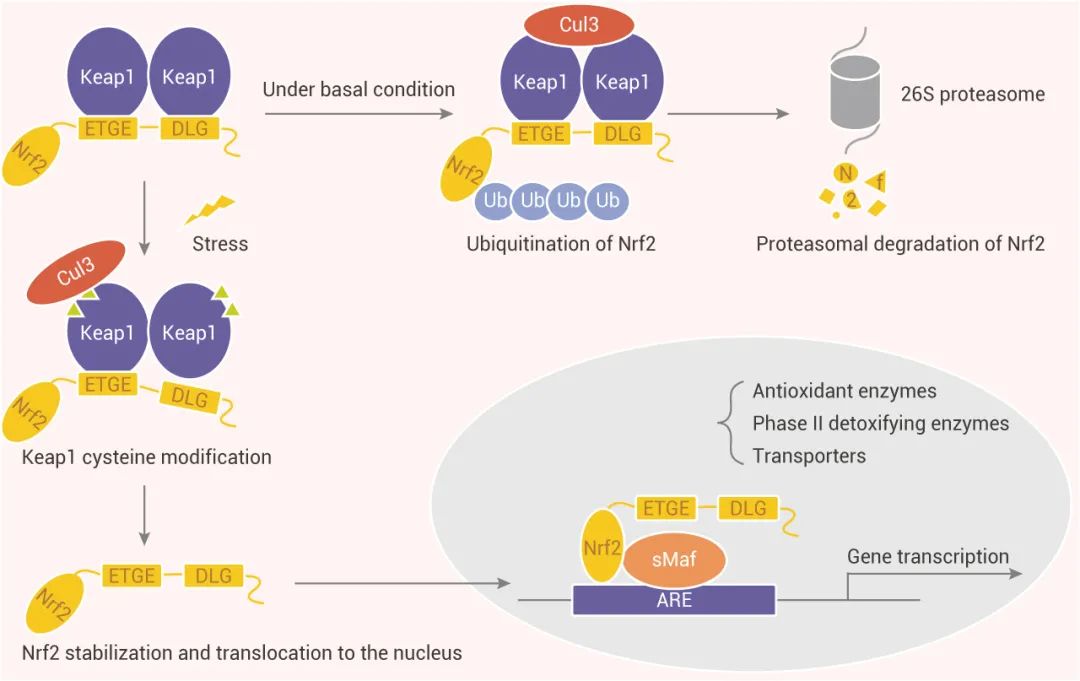
图 2. Nrf2 信号传导经典途径[9]
而暴露于 ROS、亲电胁迫会使 Keap1 中特定的半胱氨酸残基被修饰,引起 Keap1-Cul3-E3 泛素连接酶的构象变化,干扰 Nrf2 泛素化,随后 Nrf2 易位至细胞核,通过与 sMAF 蛋白的异二聚化作用结合到靶基因的 ARE/EpRE (抗氧化反应元件/亲电响应元件) ,诱导一系列细胞保护性基因表达,如 NQO1、GST、HMOX1、GCL、GSH 等。
2、非经典途径——自噬-溶酶体途径
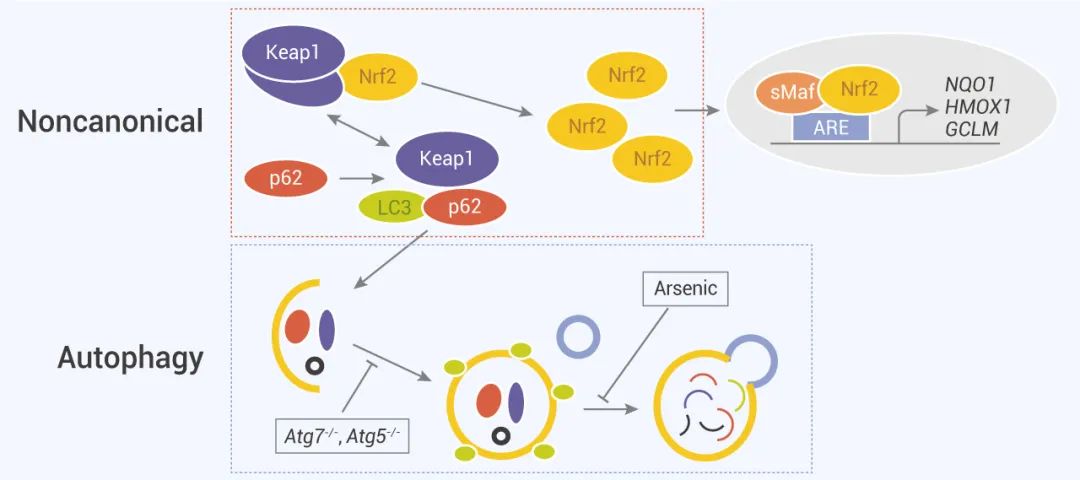
除 Keap1-Nrf2 途径外,Nrf2 激活的非典型机制,即自噬-溶酶体途径是由自噬功能障碍驱动的,自噬-溶酶体途径在介导氧化应激中也起关键作用。自噬是一种严格调控的细胞降解途径,负责清除受损的蛋白质和细胞器,包括氧化受损的蛋白质和功能异常的线粒体,自噬可以是非选择性的,也可以是选择性的 (自噬详细介绍见:Hello~自噬)。p62/SQSTM1 (以下称 p62) 是一种选择性自噬的经典受体,用于降解泛素化的底物。p62 参与许多信号转导途径,其中包括 Keap1-Nrf2 途径。
图 3. Nrf2 信号传导非经典途径[16]
自噬功能障碍 (如 Atg5、Atg7 缺失,砷毒物环境等引起) 则会导致自噬衔接蛋白的 p62 的积累。由于 p62 是能与许多蛋白相互作用的多域蛋白,它的积累会导致许多结合蛋白的隔离和功能丧失,包括 Keap1。研究表明,p62 与 Nrf2 竞争结合 Keap1,这种相互作用使 p62 可以将 Keap1 螯合到自噬体中,从而阻止了 Keap1 介导的 Nrf2 降解,导致 Nrf2 通路激活。
Nrf2 在癌症中的两面做派
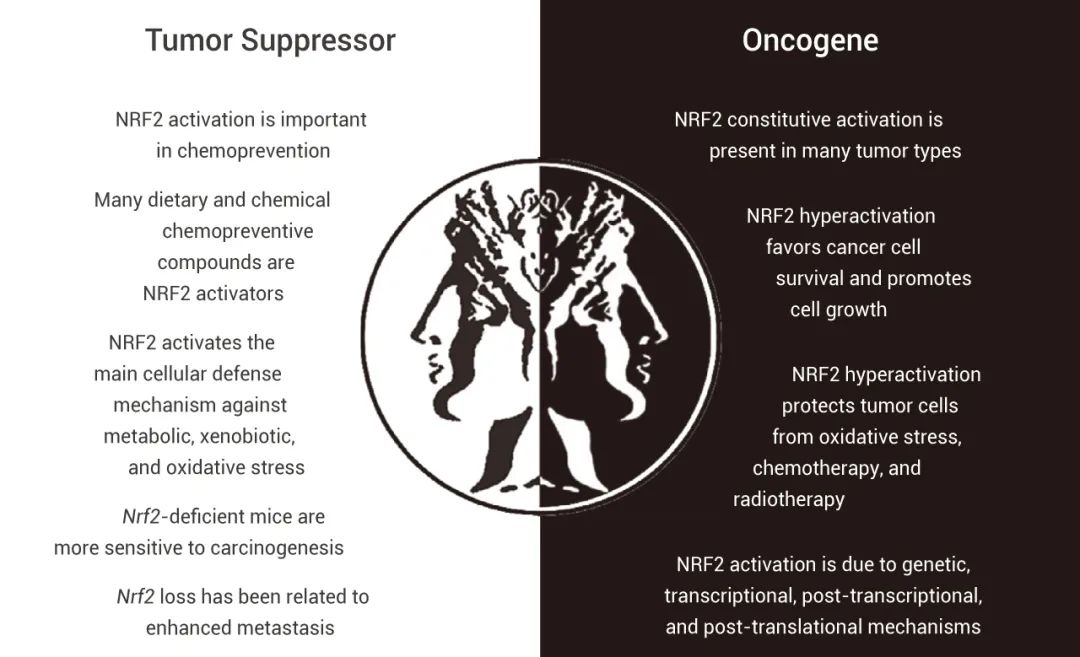
在生理条件下,Nrf2 维持细胞的氧化还原稳态,并发挥抗炎功能和进一步的抗癌活性,从而支持细胞存活。因此,Nrf2 的激活在癌症化学预防中很重要。但是,Nrf2 的过度活化也会赋予癌细胞多种优势,比如保护癌细胞免于凋亡和衰老,促进细胞生长,介导癌细胞对化疗和放疗的抗性等。
图 4. Nrf2 在癌症发生和发展中的双重作用[14]
1、Nrf2 的阳光面——激活抑制肿瘤发生
Nrf2-Keap1 途径的激活是抗肿瘤发生的最重要机制之一。通过靶向 Nrf2/ARE 途径来调控基因,进而发挥化学预防作用的一些化合物,不仅包括合成化合物如 Oltipraz,还有一些植物来源的化合物,例如 Sulforaphane、Curcumin、Resveratrol 等。
2、Nrf2 的阴暗面——组成型激活促进癌症的发展
一些研究表明在各种癌症中 Nrf2 信号通路组成性激活会促进癌细胞的生长和增殖,阻止细胞凋亡,增强癌症干细胞 (CSC) 的自我更新能力,更重要的是,可增强癌细胞的化学耐药性和放射抗性。因此,阻断 Nrf2 信号是一种有前途的癌症治疗方法,特别是对于 Nrf2 水平升高的癌症。靶向 Nrf2 的抑制剂也有很多,比如 Brusatol、ML385、Luteolin、Ochratoxin A、Retinoic acid (ATRA)、Trigonelline 等。
另外,据报道有几种机制可增强癌症中 Nrf2 的活性,如 (1) 体细胞的 KEAP1、CUL3 或 Nrf2 突变;(2) Keap1 的表观遗传沉默;(3) 破坏 Nrf2 和 Keap1 之间相互作用的蛋白质异常积累,如改变 Nrf2-Keap1 结合的 p21、p62;(4) 通过癌基因依赖性信号传导导致的 Nrf2 转录上调,如癌基因 K-Ras 通过 Mek-Erk-Jun 信号通路激活 Nrf2 转录;(5) 通过代谢中间体修饰 Keap1 等。
总而言之,Nrf2 的激活在癌症中作用是双重的。为了预防氧化和炎症应激导致的慢性疾病和癌症,增强 Nrf2 的活性仍然是一种传统而有效的方法。但 Nrf2 在各种癌症中的组成性激活又会促进癌细胞增殖并导致癌细胞的化学抗性、放射抗性。因此,想知道 Nrf2 的激活是否会导致癌症,如何靶向 Nrf2 (直接或间接抑制上游蛋白激酶),以及对 Keap1 结构进一步确定,还需要大家继续努力搞科研啦!
|
Nrf2 激活剂 |
|
可以激活 Nrf2,并通过 AMPK 依赖性信号传导抑制高糖诱导的胰腺癌。 |
|
乙酰转移酶 p300/CREB 结合蛋白特异性抑制剂;通过 Keap1 半胱氨酸修饰诱导 Nrf2 蛋白的稳定。 |
|
广泛使用的 Nrf2 激活剂,通过激活 Nrf2 来免受 Doxorubicin (DOX) 诱导的心脏毒性。 |
|
天然多酚,具有抗氧化、抗炎、保护心脏和抗癌的特性。它的靶点广泛,例如 mTOR、JAK、β-amyloid、Adenylyl cyclase、IKKβ、DNA polymerase,也是 Nrf2 激活剂。 |
|
一种 HIF-1α 激活抑制剂,也是强效的 Nrf2 激活剂。 |
| Carnosol 一种有效的核糖体 S6 激酶 (RSK2) 抑制剂;Nrf2 激活剂,能提高细胞核内 Nrf2 的水平。 |
|
Nrf2 抑制剂 |
|
可抑制 Nrf2,通过一种不依赖于 Keap1、蛋白酶体和自噬蛋白降解系统的机制激发 Nrf2 的消耗。 |
|
有效的 Nrf2 抑制剂,具有抗炎和抗癌特性。 |
|
RAR 核受体的天然激动剂,对 RARα/β/γ 作用的 IC50 为 14 nM;可以通过激活视黄酸受体抑制 Nrf2。 |
|
有潜在抗糖尿病活性的生物碱;有效的 Nrf2 抑制剂,能阻断 Nrf2 依赖性的蛋白酶体活性。 |
缩写:
BTB domain: Broadcomplex/tramtrack/bric-a-brac domain
IVR: Intervening region
DGR domain: Double glycinerepeat domain
参考文献
↓ 下滑查看更多文献
1. Tonelli C, et al. Transcriptional Regulation by Nrf2. Antioxid Redox Signal. 2018; 29(17): 1727-1745.
2. Rojo de la Vega M, et al. NRF2 and the Hallmarks of Cancer. Cancer Cell. 2018; 34(1): 21-43.
3. Qin JJ, et al. Dual roles and therapeutic potential of Keap1-Nrf2 pathway in pancreatic cancer: a systematic review. Cell Commun Signal. 2019; 17(1): 121.
4. Zhang DD, et al. Keap1 is a redox-regulated substrate adaptor protein for a Cul3-dependent ubiquitin ligase complex. Mol Cell Biol. 2004; 24(24): 10941-10953.
5. Canning P, et al. Structural basis of Keap1 interactions with Nrf2. Free Radic Biol Med. 2015; 88(Pt B): 101-107.
6. Jaramillo MC, et al. The emerging role of the Nrf2-Keap1 signaling pathway in cancer. Genes Dev. 2013; 27(20): 2179-2191.
7. Taguchi K, et al. Molecular mechanisms of the Keap1–Nrf2 pathway in stress response and cancer evolution. Genes Cells. 2011; 16(2): 123-140.
8. Zimta AA, et al. The Role of Nrf2 Activity in Cancer Development and Progression. Cancers (Basel). 2019; 11(11): 1755.
9. Wu S, et al. Nrf2 in cancers: A double-edged sword. Cancer Med. 2019; 8(5): 2252-2267.
10. Dodson M, et al. Non-canonical activation of NRF2: New insights and its relevance to disease. Curr Pathobiol Rep. 2017; 5(2): 171-176.
11. Silva-Islas CA, et al. Canonical and non-canonical mechanisms of Nrf2 activation. Pharmacol Res. 2018; 134: 92-99.
12. Katsuragi Y, et al. p62/SQSTM1 functions as a signaling hub and an autophagy adaptor. FEBS J. 2015; 282(24): 4672-4678.
13. Robledinos-Antón N, et al. Activators and Inhibitors of NRF2: A Review of Their Potential for Clinical Development. Oxid Med Cell Longev. 2019; 2019: 9372182.
14. Menegon S, et al. The Dual Roles of NRF2 in Cancer. Trends Mol Med. 2016; 22(7): 578-593.
15. Wu S, et al. Nrf2 in cancers: A double-edged sword. Cancer Med. 2019; 8(5): 2252-2267.
16. Jiang T, et al. p62 links autophagy and Nrf2 signaling. Free Radic Biol Med. 2015; 88(Pt B): 199-204.