Megazyme方法β‑葡聚糖检测试剂盒使用说明书
引言
一段时间以来,酿造、食品和配料行业已经确定需要开发一种准确、方便和可靠的方法来检测大麦、麦芽、麦芽汁和啤酒中混合糖苷键的 β‑葡聚糖。Megazyme方法满足所有这些要求。它使用简单,一天可以检测 50‑100 个样本。该方法还适用于燕麦和燕麦纤维产品中 β‑葡聚糖的检测(改进型方法,第 5 页)。
反应原理
将样品置于 pH 6.5 的缓冲溶液中悬浮和水合,然后与纯化的地衣聚糖酶一起孵育并过滤,之后用纯化的 β‑葡糖苷酶将等分的滤液水解至完全,最后使用葡萄糖氧化酶/过氧化物酶试剂测定产生的 D‑葡萄糖。
将样品置于 pH 6.5 的缓冲溶液中悬浮和水合,然后与纯化的地衣聚糖酶一起孵育并过滤,之后用纯化的 β‑葡糖苷酶将等分的滤液水解至完全,最后使用葡萄糖氧化酶/过氧化物酶试剂测定产生的 D‑葡萄糖。
准确性
在我们的实验室中,燕麦和大麦样品测试的标准误差通常为± 3%。
评估
精简的 β‑葡聚糖方法已被 AOAC 国际(方法 995.16)、AACC(方法 32‑23.01)和 ICC(方法 166)成功评估。该方法的原始版本也成功地通过了澳大利亚皇家化学研究所分析委员会以及欧洲酿造公约的评估。
特异性
该测定对混合键 [(1‑3)(1‑4)]‑β‑D‑葡聚糖具有特异性。
试剂盒
Megazyme 提供可进行 100 次检测的试剂盒。该试剂盒包含完整的检测方法以及:
瓶 1:地衣聚糖酶 [特异性,内切‑(1‑3)(1‑4)‑β‑D‑葡聚糖 4‑葡聚糖水解酶] 悬浮液 (1 mL)。在 4°C 下可稳定储存 3 年以上。
瓶 2:β‑葡萄糖苷酶 (1 mL) 悬浮液。在 4°C 下可稳定储存 3 年以上。
瓶 3:GOPOD 试剂缓冲液。缓冲液(50 mL,pH 7.4),含对羟基苯甲酸和叠氮化钠(0.09% w/v)。在 4°C 下可稳定储存 4 年以上。
需要的设备
瓶 4:GOPOD 试剂酶。含葡萄糖氧化酶、过氧化物酶和 4-氨基安替比林。冻干粉。在-10°C 下可稳定保存 4 年以上。
瓶 5:D-葡萄糖标准溶液(5 mL,1.0 mg/mL),溶剂为 0.2% (w/v) 苯甲酸。室温保存,可稳定保存 5 年以上。
瓶 6:标准化大麦粉质控样。小瓶标签上显示的是 β‑葡聚糖含量。室温保存,可稳定保存 5 年以上。
瓶 7:标准化燕麦粉质控样。小瓶标签上显示的是 β‑葡聚糖含量。室温保存,可稳定保存 5 年以上。
试剂/悬液的制备:
1. 用 20 mM 磷酸钠缓冲液(pH 6.5)将瓶 1(地衣聚糖酶)的内容物稀释至 20.0mL,将其等分后储存于聚丙烯管中,在低于‑10°C 可保存 2 年以上。使用期间需尽可能保持低温。
注:该酶不得与 β‑葡萄糖苷酶发生交叉污染。
2. 用 50 mM 醋酸钠缓冲液(pH 4.0)将瓶 2(β‑葡萄糖苷酶)的全部内容物稀释至 20.0 mL,将其等分后储存于聚丙烯管中,在低于‑10°C 可保存 2 年以上。
使用期间需尽可能保持低温。
3. 将瓶 3(GOPOD 试剂缓冲液)用去离子水定容至 1L,配制完成后立即使用。
注:
(1)储存时,浓缩缓冲液中可能会形成盐晶体。当该缓冲液用去离子水稀释至 1L时,它们必须完全溶解。
(1)储存时,浓缩缓冲液中可能会形成盐晶体。当该缓冲液用去离子水稀释至 1L时,它们必须完全溶解。
(2)该缓冲液含有 0.09% (w/v) 叠氮化钠。这是一种有毒化学品,配制时请做好安全防
护。
4. 先将瓶 4 中的内容物溶于 20mL 的溶液 3 中,再将其和剩余的溶液 3 混匀。
用铝箔纸将试剂瓶包裹以避光放置。此试剂称之为为葡萄糖测定试剂(GOPODReagent)。在 2-5°C 下可稳定储存约 3 个月。在-10°C 下可稳定保存 12 个月以上。
注:
(1)如果该试剂以冷冻状态储存,最好将其分装为约 200 mL 的等分试样,在使用过程中仅冷冻/解冻一次。
(1)如果该试剂以冷冻状态储存,最好将其分装为约 200 mL 的等分试样,在使用过程中仅冷冻/解冻一次。
(2)新配制的试剂可能呈淡黄色或淡粉色。在 4°C 储存的 2-3 个月内,溶液颜色会逐渐转变为更深的粉红色,但不影响使用。
试剂配制(本试剂盒不提供)
试剂 1 磷酸盐缓冲液 (20mM,pH 6.5)
将 3.12 g 二水磷酸二氢钠(NaH2PO4.2H2O)溶解在 900 mL 蒸馏水中,通过加入100 mM 氢氧化钠(4 g/L)(大概需要 50 mL)调节 pH,并定容至 1L,最后加入叠氮化钠 0.2 g。
在 4°C 下可稳定储存 2 个月。
试剂 2 醋酸钠缓冲液 (50mM,pH 4.0)
将 2.9mL 的冰醋酸添加到 900mL 蒸馏水中。通过添加 1M (40g/1L)氢氧化钠溶液将 pH 值调节至 4.0,定容至 1L。
在 4°C 下可稳定储存 2 个月。
试剂 3 醋酸钠缓冲液 (200mM,pH 4.0)
将 11.6mL 的冰醋酸添加到 900mL 蒸馏水中。通过添加 1M (40g/1L)氢氧化钠溶液将 pH 值调节至 4.0,定容至 1L。
在 4°C 下可稳定储存 2 个月。
需要的设备
1. 带盖的聚丙烯管/容器(35 mL 容量)
2. 玻璃试管(12 mL 容量)
3. 移液枪,例如 Gilson Pipetman® (100 μL 和 200 μL)
4. 容积式移液器,例如带有 5.0mL 注射器吸嘴的 Eppendorf Multipette®
5. 可调节容量分配器:
⚫ 0‑5.0 mL(用于磷酸盐缓冲液)
⚫ 3.0 mL(用于葡萄糖氧化酶/过氧化物酶试剂)
⚫ 0‑25.0 mL(蒸馏水)
6. 实验室烘箱
7. 分析天平
8. 分光光度计(可设置 510nm)
9. 涡旋混合器
控制和预防措施
操作流程
10. 恒温水浴锅(设置为 50°C,或根据第 10 页原始版本中的方法设为 40°C)
11. 计时器
12. Whatman No.41 滤纸
13. 离心机(可用于麦芽,麦芽汁和啤酒的制备)。
14. 带 0.5mm 筛网的实验室用研磨机(例如 Frisch pulverisette 14®)
15. 沸水浴装置
控制和预防措施
1.每组测定均包含 100 µg 的空白试剂和 D‑葡萄糖标准品,一式两份。空白试剂包含 0.1 mL 蒸馏水 + 0.1 mL 醋酸钠缓冲液 + 3.0 mL GOPOD 试剂。
葡萄糖标准品包括 0.1 mL 醋酸钠缓冲液 + 0.1 mL D‑葡萄糖标准品 (100 µg/0.1mL) + 3.0 mL GOPOD 试剂。
2. 每组至少测定一个大麦质控样。
3. 每批新的 GOPOD 试剂均应检查 100 µg D‑葡萄糖标准品的最大显色时间,这通常大约为 15 分钟。
4. 地衣聚糖酶不能与 β‑葡萄糖苷酶制剂交叉污染。
操作流程
(a) 燕麦、大麦粉和纤维样品的测定程序 ‑ 简化方法(AOAC 方法 995.16、AACC 方法 32‑23 和 ICC 标准方法 No. 166)
该程序适用于所有干燥样品,尤其是那些含有高水平 β‑葡聚糖的样品(例如加工过的燕麦麸产品)。
1. 使用 Fritsch pulverisette 14® (Fritsch GmbH Idar Oberstein, Germany)或类似的离心磨将大麦、燕麦或纤维样品(约 50 克)磨碎以通过 0.5 毫米筛网。
2. 将面粉样品(80‑120 mg;准确称重)加入玻璃试管(16 x 120 mm;17 mL 容量)中,轻敲试管以确保所有样品都落到试管底部。
3. 用 0.2 mL 乙醇水溶液 (50% v/v) 润湿样品,加入磷酸钠缓冲液(4.0 mL,20mM,pH 6.5),涡旋混匀。
4. 混匀后,立即将试管放入沸水浴中孵育 60 秒。在涡旋混合器上剧烈搅拌混合物,在 100°C 下再孵育 2 分钟并再次搅拌。
5. 将试管和内容物在 50°C 水浴锅中孵育 5 分钟。
6. 加入地衣聚糖酶(0.2 mL,10 U)并搅拌试管内容物。用封口膜封住试管,将其置于 50℃水浴锅中孵育 1 小时,在旋涡搅拌器上进行有规律的剧烈搅拌 3-4次。连续搅拌设备推荐:Megazyme Multi-stir IncubationBath (Cat. no. D-IBMKIII)。
7.加入醋酸钠缓冲液(5.0 mL,200 mM,pH 4.0),在涡旋混合器上剧烈混合试管内容物。
8.让试管温度平衡至室温(约 5 分钟)并离心(1,000 g 离心力,10 分钟)。使用Gilson Pipetman®或 Rainin EDP‑2®将等分试样 (0.1 mL) 小心准确地分配到三个试管(容量为 12 mL)的底部。
9.将 溶解于 50 mM 醋酸钠缓冲液 (pH 4.0) 中的 β‑葡萄糖苷酶 (0.1 mL, 0.2 U)添加到其中两个试管中(反应组)。向第三个试管中(空白组)添加 50 mM 醋酸钠缓冲液(0.1 mL,pH 4.0)。将所有试管在 50°C 下孵育 10 分钟。
10.在各试管中加入 3.0mLGOPOD 试剂,混匀后在 50°C 水浴中孵育 20min。
11.从水浴中取出试管,冷却后在 1h 内于 510nm 处测量溶液吸光度(以空白溶液为参照)。
注意:试管中存在的 D‑葡萄糖量(即在被分析的 0.1 mL 样品中)应在 4 到 100μg之间。 β‑葡萄糖苷酶处理前的样品溶液必须用 200 mM 醋酸钠缓冲液 (pH 4.0)充分稀释,以使糖浓度在 0.04 和 1.0 g/L 之间,约相当于原始样品中 0.35% 和8.5% 的 β‑葡聚糖。例如,如果样品中含有 20%的 β‑葡聚糖,则应先用 200 mM醋酸钠缓冲液(pH 4.0)将其稀释 3 倍,然后再进行分装,与 β‑葡萄糖苷酶一起孵育。
或者,对于含有高 β‑葡聚糖的样品,例如 Oatwell(β‑葡聚糖含量> 50%),样品量应减少至 50 mg,体积应在地衣聚糖酶处理后用 200 mM 醋酸钠缓冲液(pH4.0)调整至 100 mL。
(b) 煮熟、烘烤或挤压谷物产品的测定程序 ‑ 简化方法(AOAC 方法 995.16、AACC 方法 32‑23 和 ICC 标准方法 166)
在分析煮熟、烘烤或挤压谷物产品中的 β‑葡聚糖时,应使用乙醇水溶液对样品进行预提取,以去除游离糖并降低脂肪和油的含量。
1. 使用 Fritsch pulverisette 14® (Fritsch GmbH Idar Oberstein, Germany)或类似的离心磨将食品(约 50 克)磨碎以通过 0.5 毫米筛网。
2. 将样品(约 200mg;准确称重)加入玻璃试管(16 x 120 mm;17 mL 容量)中,轻敲试管以确保所有样品都落到试管底部。
3. 加入 5.0 mL 乙醇水溶液 (50% v/v),将试管置于沸水浴中孵育 5 分钟。在涡旋搅拌器上混合内容物后,再加入 5.0 mL 50% (v/v) 乙醇水溶液,混合均匀。
4. 以 1,800 g(约 3,000 rpm)离心 10 分钟,弃去上清液。
5. 将沉淀重悬于 5.0 mL 的 50% (v/v) 乙醇水溶液中,并在涡旋混合器上搅拌。再加入 5.0 m 的 50% 乙醇水溶液。在涡旋混合器上搅拌后,离心并弃去上清液(同步骤 4)。
6. 将沉淀悬浮在 4.0 mL 磷酸钠缓冲液(20 mM,pH 6.5)中,将试管在 50°C水浴锅中孵育 5 分钟。
7. 加入地衣聚糖酶(0.2 mL,10 U)并搅拌试管内容物。用封口膜封住试管,将其置于 50℃水浴锅中孵育 1 小时,在旋涡搅拌器上有规律的剧烈搅拌 3-4 次。
连续搅拌设备推荐:Megazyme Multi-stir IncubationBath (Cat. no. D-IBMKIII)。
8.加入醋酸钠缓冲液(2.0 mL,200 mM,pH 4.0),在涡旋混合器上剧烈混合试管
内容物。
9. 从方法(a)中步骤 8 开始,剩余步骤与其一致。
(c) 奶昔、酸奶和其他液体样品(乙醇沉淀)的测定程序
1. 准确称量玻璃离心管(16 x 120 mm;17 mL 容量)。
2. 向试管中加入 3.0 mL 样品,在沸水浴中加热 5 分钟。让其冷却至室温。
3. 向试管中加入 3.0 mL 乙醇水溶液 (95% v/v),在涡旋搅拌器上混合内容物后,再加入 5.0 mL 95% (v/v) 乙醇水溶液,在涡旋搅拌器上混合均匀。
4. 以 1,800 g(约 3,000 rpm)离心 10 分钟,弃去上清液。
计算(固体样品)
5. 将沉淀重悬于 8.0 mL 的 50% (v/v) 乙醇水溶液中并在涡旋混合器上搅拌,离心并弃去上清液(同步骤 4)。
6. 将沉淀悬浮在 4.0 mL 磷酸钠缓冲液(20 mM,pH 6.5)中,将体积调整至 4.0mL(按重量计),将试管在 50°C 水浴锅中孵育 5 分钟。
7. 从方法(a)中步骤 6 开始,剩余步骤与其一致。
注意:如果样品吸光度值超过葡萄糖标准品的吸光度值,则必须用 200mM 醋酸钠缓冲液(pH 4.0)稀释样品,以便在分配等分试样与 β‑葡萄糖苷酶孵育之前使其处于合适的浓度范围内。
计算(固体样品)

其中:
ΔA = β‑葡萄糖苷酶处理后的吸光度减去空白样品溶液的吸光度
F = 将吸光度值转换为葡萄糖 μg 量的转换系数
=
100(D−葡萄糖的 μg 量)
100μgD−葡萄糖的吸光度
FV =最终体积(即,对于示例 (A) 中的燕麦和大麦粉为 9.4 mL;对于示例 (B)中煮熟、烘烤和挤压的谷物产品,为 6.4 mL;对于含有 > 50% β‑葡聚糖的样品,为 100mL,见第 6 页注解)。
0.1 = 分析的样品量。
1/1000 = 从 μg 转换为 mg。
100/W = 以 β-葡聚糖含量占样品重量的百分比为因子。
W = 所分析样品的重量(以 mg 为单位)。
162/180 = 从确定的游离 D-葡萄糖转化为脱水-D-葡萄糖的因子,如在 β-葡聚糖中发生的一样。
D = 在与 β‑葡萄糖苷酶孵育之前进一步稀释(如果需要)
 计算(液体样品;g/100 mL)
计算(液体样品;g/100 mL)
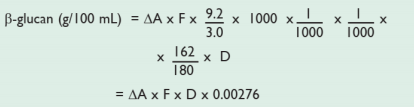

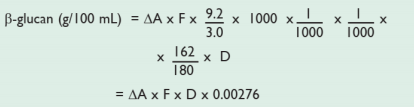
其中:
ΔA = β-葡萄糖苷酶处理后吸光度(反应)减去空白试剂的吸光度。
F = 将吸光度值转换为葡萄糖 μg 量的转换系数
=
100(D−葡萄糖的 μg 量)
100μg D−葡萄糖的吸光度
9.2/3.0 = 体积校正因子:3.0 mL 样品用 IMS 处理,体积调整为 9.2 mL)(如 4.0 mL + 0.2 mL 地衣聚糖酶+ 5.0 mL 醋酸缓冲液)。
1000 = 体积调节因子(检测 0.1 mL,但结果以每 100 mL 样品表示)。
1/1000 = 从 μg 转换为 mg。
1/1000 = 从 mg 转换为 g。
162/180 = 从确定的游离 D-葡萄糖转化为脱水-D-葡萄糖的因子,如在 β-葡聚糖中发生的一样。
D = 在与 β‑葡萄糖苷酶孵育之前进一步稀释(如果需要)。
注意:使用 Megazyme 的 Mega-CalcTM 可以简化这些计算,可在 Megazyme 网站上下载(www.megazyme.com)。
(d) 欧洲酿造公约批准的大麦检测程序(EBC 方法 3.10.1)
有用的提示:
1. 用地衣聚糖酶孵育样品后,建议通过分配器加入 24.0 mL 蒸馏水,将反应混合物* 的体积调整至 30.0 mL。
* 假设体积为 6.0 mL;大约在加热步骤中损失了 0.2 mL。
2. 在测定程序的第 5 步中,如果溶液在沸腾 5 分钟后变得非常粘稠,加入 5.0mL 蒸馏水并在涡旋混合器上充分搅拌。与地衣聚糖酶反应后,加入 19.0 mL 蒸馏水,将体积调节至 30.0 mL。
注意:如果溶液非常粘稠,随着地衣聚糖酶的扩散,可能会出现一些问题。加入 5.0 mL蒸馏水可缓解这个问题。
3. 如果在步骤 5 中使用玻璃管而不是聚丙烯管,在测定过程中,首先将在沸水浴中的孵育时间减少到 45 秒,涡旋内容物然后在沸水浴中再孵育 45 秒(即总共 1.5 分钟)。
方法:
1. 使用 Tecator Cyclotec® 研磨机碾磨大麦以通过 0.5 mm 的筛网(均匀、精细的研磨是必不可少的)。
2. 将已知水分含量的大麦面粉样品(约 0.5 克)准确称重,放入聚丙烯管中(参见设备,第 3 页,第 1 点)。
*参见第 11 页“示例结果表”下的脚注。
3. 在每个试管中加入等分试样 (1.0 mL) 的乙醇水溶液 (50% v/v),以分散样品。
4. 加入 5.0 mL 磷酸钠缓冲液(20 mM,pH 6.5),使用涡旋混合器搅拌试管。
5. 试管在沸水浴中孵育大约 2 分钟(参见有用的提示的第 2 点和第 3 点)。取出试管,在旋涡搅拌器上用力搅拌。在沸水浴中再加热 3 分钟(2 分钟后混合防止形成凝胶块)
6. 将试管冷却至 40°C,并在每个试管中加入 0.2 mL 地衣聚糖酶 (10 U)。盖上试管盖,搅拌并在 40°C 下孵育 1 小时。
7. 通过添加蒸馏水将每管中的体积调整到 30.0 mL(参见有用的提示的第 1 点)。
8. 彻底混合管中的内容物,通过 Whatman No. 41 滤纸过滤从每个试管中分离出来的混合物(或以大约 1000g 的离心力离心 10 分钟)。
9. 小心准确地从每个滤液中转移等分试样(0.1 mL)到三个试管的底部。
10. 在其中一个(空白组)中加入 0.1 mL 的醋酸钠缓冲液(50 mM, pH 4.0),在另两个(反应组)中加入 0.1 mL 用 50 mM 醋酸缓冲液(pH 4.0)稀释的 β-葡萄糖苷酶(0.2U)。40°C 下孵育 15 分钟。
11. 每管加入 3.0 mL GOPOD 试剂,在 40°C 下孵育 20 分钟(见第 4 页,控制和预防措施中的第 3 点)。
12. 测量每个反应组(EA)和空白组 (EBl)在 510 nm 处的吸光度。
注意:本试剂盒使用的 GOPOD 试剂,形成的显色配合物在室温下至少能稳定 2小时。
结果示例表:
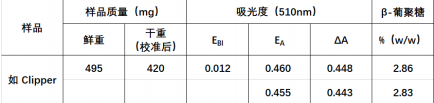
麦糟:
啤酒或麦芽汁(EBC 方法 8.13.1):

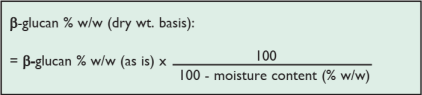
干重=鲜重 x(100-水分含量%)* /100
*
一般来说,这是由近红外反射率决定的。另外,这也可以通过观察面粉样品(0.5 g)在 80℃下存放 20 小时的质量下降情况来确定。谷物面粉样品的水分含量始终保持在 10-14%的范围内(e) 欧洲酿酒公约认可的麦芽、麦糟、啤酒和麦芽汁的检测程序
麦芽(EBC 方法 4.16.1):
1. 加入 1.0 g 麦芽粉(研磨至通过 0.5 mm 筛)或在麦芽制造过程中除去的冻干大麦样品,加入 5.0 mL 乙醇(50% v/v)。
2. 在沸水浴中孵育 5 分钟后,在涡旋搅拌器上混合内容物,再加入 5.0 mL的 50% (v/v) 乙醇水溶液,混合。
3. 以 1,000 g 的离心力离心 10 分钟,弃去上清液。
4. 将沉淀重悬于 10.0 mL 50% (v/v) 乙醇水溶液中,离心并弃去上清液(如上述步骤 3)。
5. 将颗粒悬浮在 5.0 mL 磷酸钠缓冲液中(20 mM, pH 6.5)。
6. 从大麦测定流程中步骤 5 开始,剩余步骤与其一致。
麦糟:
用热水(约 75°C)清洗麦糟,然后冻干,或不清洗冻干。将该材料磨碎至通过 0.5 mm 的筛,分析 β-葡聚糖含量,之后使用与麦芽样品相同的程序进行计算。
啤酒或麦芽汁(EBC 方法 8.13.1):
1. 在沸水浴中加热啤酒各等分试样至约 80°C 来脱气,之后让其冷却。
2. 在预先称重的离心管(容量为 12 mL)中加入 5.0mL 麦芽汁或脱气啤酒,再加入 2.5 克精细研磨的硫酸铵晶体。
3. 用 Parafilm®密封试管,小心的上下倒置以溶解硫酸铵(避免起泡)。
4. 让试管静置,然后在 4°C 下放置 20 小时。
5. 以 1,000 g 的离心力离心 10 分钟。
6. 弃去上清液。
7. 用 1.0 mL 50% (v/v)乙醇水溶液重悬颗粒,并完全涡旋。再加入 10.0 mL的 50% (v/v)乙醇,通过试管来回倒置混合均匀。
8. 以 1,000 g 的离心力离心 5 分钟,弃去上清液。
9. 重复上述步骤 7 和 8 中的乙醇洗涤程序,重新悬浮颗粒。
10. 弃去上清液。
注:对于含有低水平 β-葡聚糖的麦芽汁样品,请用 β-葡萄糖苷酶孵育较大等份的样品溶液(最多 0.5 mL), 对空白组也应使用这个更大的等份容量。同时,D-葡萄糖标准液也必须用蒸馏水进行相应调整,并相应地修改计算。
计算:
11. 将颗粒重新悬浮在磷酸钠缓冲液(20 mM,pH 6.5)中:对于麦芽汁,将
体积调整到 4.8 mL(按重量计);对于啤酒,将体积调整到 1.8 mL(按重量计)。
12. 加入 0.2 mL 地衣聚糖酶 (10 U) 并在 40°C 下孵育 5 分钟。以 1,000 g 的离心力离心 10 分钟,从大麦测定流程中步骤 9 开始,剩余步骤与其一致。
注:对于含有低水平 β-葡聚糖的麦芽汁样品,请用 β-葡萄糖苷酶孵育较大等份的样品溶液(最多 0.5 mL), 对空白组也应使用这个更大的等份容量。同时,D-葡萄糖标准液也必须用蒸馏水进行相应调整,并相应地修改计算。
计算:
对于大麦、麦芽和麦糟:
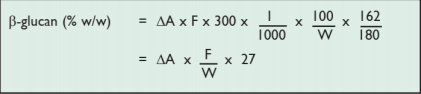 对于麦芽汁
对于麦芽汁
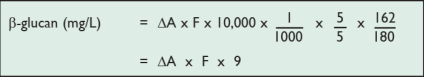 对于啤酒:
对于啤酒:
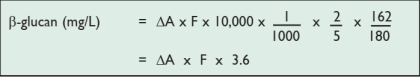
不同方法的比较
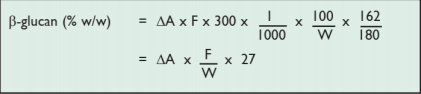
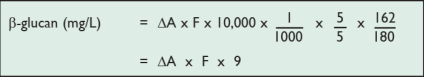
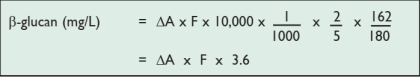
其中:
ΔA = β-葡萄糖苷酶处理后的吸光度(反应)减去空白试剂的吸光度。
F = 将吸光度值转换为葡萄糖 μg 量的转换系数
=100(D−葡萄糖的 μg 量)/100μg D−葡萄糖的吸光度
300=容积校正(如从 30.0mL 中取 0.1mL)
10000=容积校正系数(分析了 0.1 mL,但结果显示为每升样品)
1/1000 = 从 μg 转换为 mg。
100/W = 以 β-葡聚糖含量占干面粉重量的百分比为因子。
W = 所分析样品的重量,以 mg 为单位(请参阅第 6 页的示例结果表)。
5/5=体积校正因子。对于麦芽汁样品,5.0 mL 的等分样液用沉淀剂(硫酸铵)处理,体积调整为 5.0 mL(即 4.8 mL + 0.2 mL 地衣聚糖酶)。
2/5=体积校正因子。对于啤酒样品,5.0mL 的等分样液用沉淀剂(硫酸铵)处理,体积调整为 2.0 mL(即 1.8mL+ 0.2mL 地衣聚糖酶)。
162/180 = 从确定的游离 D-葡萄糖转化为脱水-D-葡萄糖的因子,如在 β-葡聚糖中发生的一样。
注意:使用 Megazyme 的 Mega-CalcTM 可以简化这些计算,可在 Megazyme 网站上下载(www.megazyme.com)。
不同方法的比较
在实验室间的评估中,已将 Megazyme 改进型 β-葡聚糖方法与 AACC 方法32-22(原始 Megazyme 方法的 AACC 修改)1 进行了比较,两种方法获得的结果非常相似。 Megazyme“改进型方法”的结果如表 1 所示。
使用这种方法,一个分析人员一天可以分析 100 多个样品。与之相比,使用AACC 方法 32-22 ,只能分析大约 20 个样品。
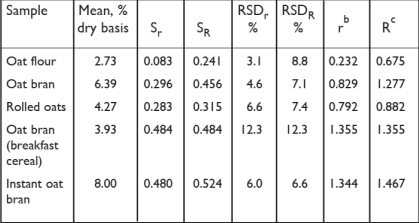
表 1:采用改进型酶法测定燕麦中 β-D-葡聚糖的方法性能. a

a
基于 8 个实验室的结果; 未发现异常值
b
r = 2.8 x sr
c
R = 2.8 x sR
酶活性的标准化:
使用对硝基苯基 β-葡萄糖苷作为底物对 β-葡萄糖苷酶进行标准化。一个单位定义为在 pH 4.0 和 40°C 条件下每分钟从对硝基苯基 β-葡萄糖苷 (10 mM) 中释放 1 微摩尔对硝基苯酚所需的酶量。使用 Nelson/Somogyi 还原糖程序,在 40°C的磷酸钠缓冲液 (pH 6.5) 中测定大麦 β-葡聚糖 (10 mg/mL) 的地衣聚糖酶活性。一单位活性定义为在规定的测定条件下,每分钟释放 1 微摩尔 D-葡萄糖还原糖当量所需的酶量。
标签:
β‑葡聚糖[混联]检测





