LNPs选择性共递送mRNA和TLR4至脾脏发挥强效肿瘤免疫作用的研究
LNPs选择性共递送mRNA和TLR4激动剂至脾脏发挥强效的肿瘤免疫治疗作用
2023年5月,来自郑州大学第一附属医院的秦志海教授团队在药剂学领域权威期刊J Control Release上发表了题为“Spleen-selective co-delivery of mRNA and TLR4 agonist-loaded LNPs for synergistic immunostimulation and Th1 immune responses”的研究论文。
脾脏是机体最大的外周免疫器官,也是启动和扩增抗原特异性免疫反应的理想场所。选择性地递送抗原至脾脏可诱导快速的抗原特异性免疫应答,由于针对mRNA编码抗原的免疫反应,不足以诱导强效的细胞毒性T细胞免疫应答,目前已发表的脾脏选择性递送mRNA编码抗原的肿瘤治疗效果有限。
秦志海教授团队开发了一种硬脂酸掺杂的脂质纳米颗粒(LNPs),通过共载编码卵清蛋白(OVA)的未修饰mRNA和TLR4激动剂(MPLA)制备了脾脏选择性mRNA肿瘤疫苗。静脉注射后,该新型的mRNA疫苗可选择性地在脾脏中翻译mRNA编码的蛋白抗原,通过激活抗原提呈细胞细胞膜上的TLR4和细胞内TLR7/8,增加mRNA肿瘤疫苗的免疫原性,引发Th1型的免疫应答和持久的免疫记忆,发挥强效的肿瘤免疫治疗作用。
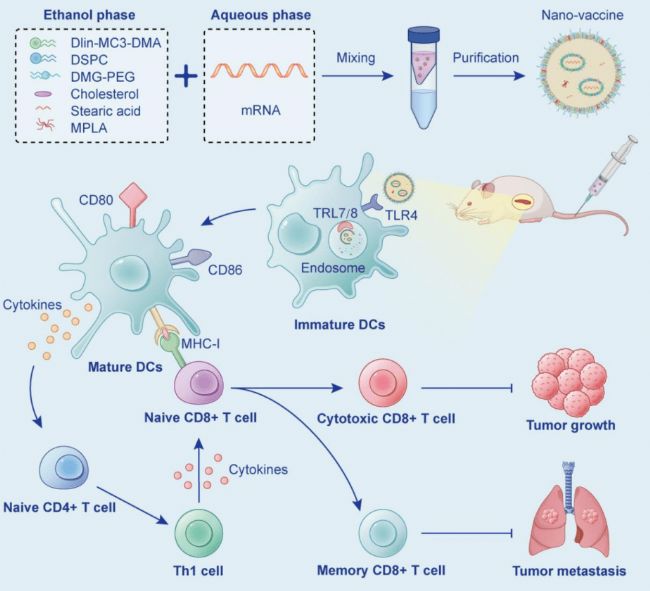
图1 LNPs选择性联合递送mRNA和MPLA至脾脏,协同免疫刺激和Th1免疫反应,从而实现癌症免疫治疗的示意图
该研究发现sLNPs-OVA/MPLA 在静脉注射后促进了脾脏中组织特异性mRNA的表达,并通过激活多个TLR引发了Th1免疫反应的增强佐剂活性。
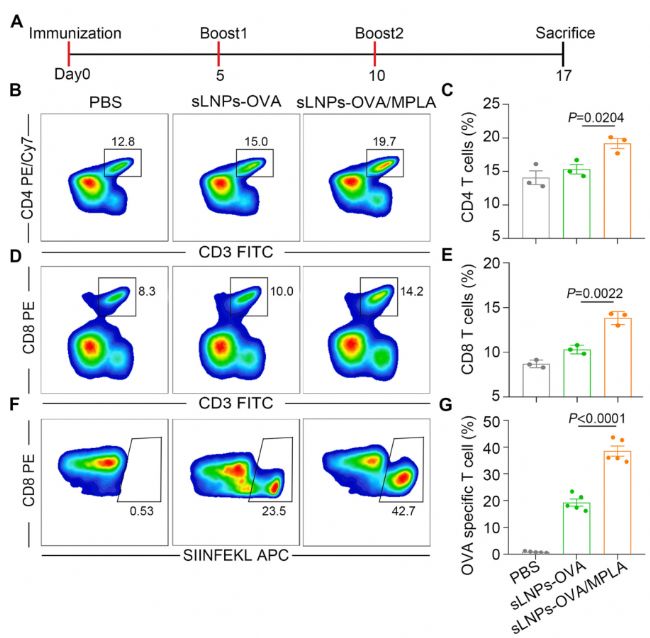
图2 与sLNPs-OVA相比,sLNPs-OVA/MPLA诱导Th1细胞反应增强,脾脏中抗原特异性CD8+细胞毒性T细胞反应更强
在预防性小鼠模型中,sLNPs-OVA/MPLA诱导了一种有效的抗原特异性细胞毒性T细胞免疫反应,并最终通过持久的免疫记忆保护阻止了EG.7-OVA肿瘤的生长。
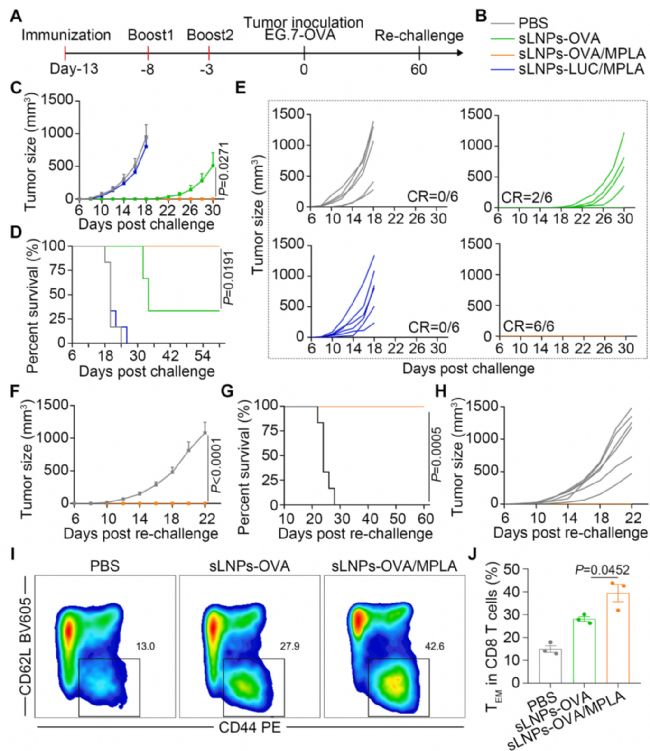
图3 sLNPs-mRNA/MPLA对EG.7-OVA同种异体移植肿瘤模型的免疫预防作用及长期保护作用
此外,sLNPs-OVA/MPLA有效延缓了EG.7-OVA皮下移植淋巴瘤的肿瘤生长和B16F10-OVA静脉注射黑色素瘤的肺转移形成。
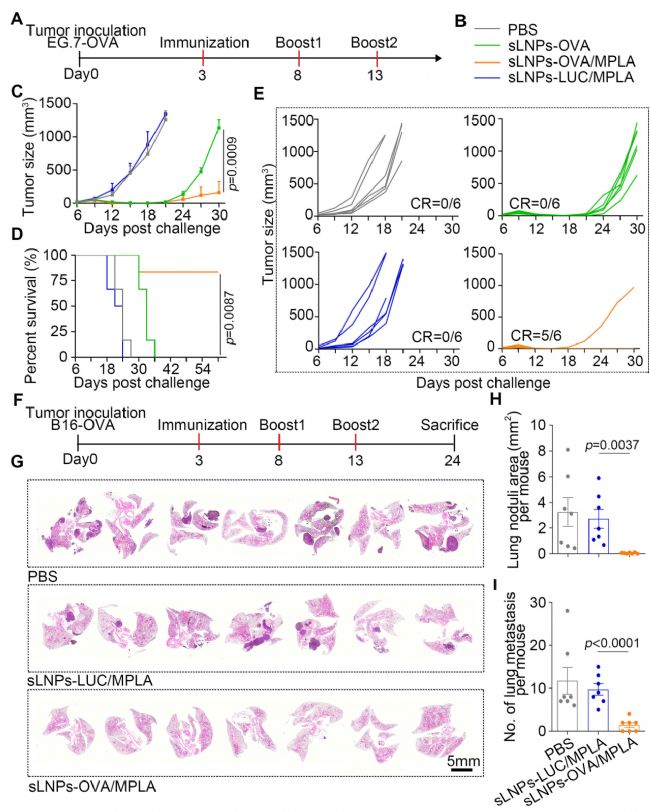
图4 sLNPs-OVA/MPLA对小鼠EG.7-OVA淋巴瘤和B16F10-OVA黑色素瘤实验性肺转移的免疫治疗效果
该研究表明,mRNA 抗原和适当的 TLR 激动剂的共同递送可以通过协同免疫刺激和Th1免疫反应显著提高脾靶向 mRNA 疫苗的抗肿瘤免疫治疗效果。
参考文献
Pan L, Zhang L, Deng W, Lou J, Gao X, Lou X, Liu Y, Yao X, Sheng Y, Yan Y, Ni C, Wang M, Tian C, Wang F, Qin Z. Spleen-selective co-delivery of mRNA and TLR4 agonist-loaded LNPs for synergistic immunostimulation and Th1 immune responses. J Control Release. 2023 May;357:133-148.





