RT-PCR基本原理与实验步骤及常见问题的处理方案
1概述
反转录-聚合酶链式反应(Reverse Transcription-Polymerase Chain Reaction, RT-PCR),也称逆转录PCR,是聚合酶链式反应(PCR)的一种广泛应用的变形。其灵敏度比传统的RNA印迹法高1000〜10000倍,而所需时间缩短了几倍。迄今为止,RT-PCR的方法已经广泛应用于RNA的构造解析、cDNA的克隆及RNA水平上的表达解析等多种领域。
2 RT-PCR原理
RT-PCR是一种从细胞RNA (mRNA)中高效灵敏地扩增cDNA序列的方法,它由两大步骤组成:一步是反转录(RT),另一步是PCR。获得总RNA或mRNA后,即可进行RT-PCR。首先,在反转录酶作用下将RNA(mRNA)反转录成cDNA,以该cDNA第一链为模板进行PCR扩增,根据靶基因设计用于PCR扩增的基因特异的上下游引物,基因特异的上游引物与cDNA第一链退火,在Taq DNA聚合酶作用下合成cDNA第二链。再以cDNA第一链和第二链为模板,用基因特异的上下游引物PCR扩增获得大量的cDNA。反应原理图如下。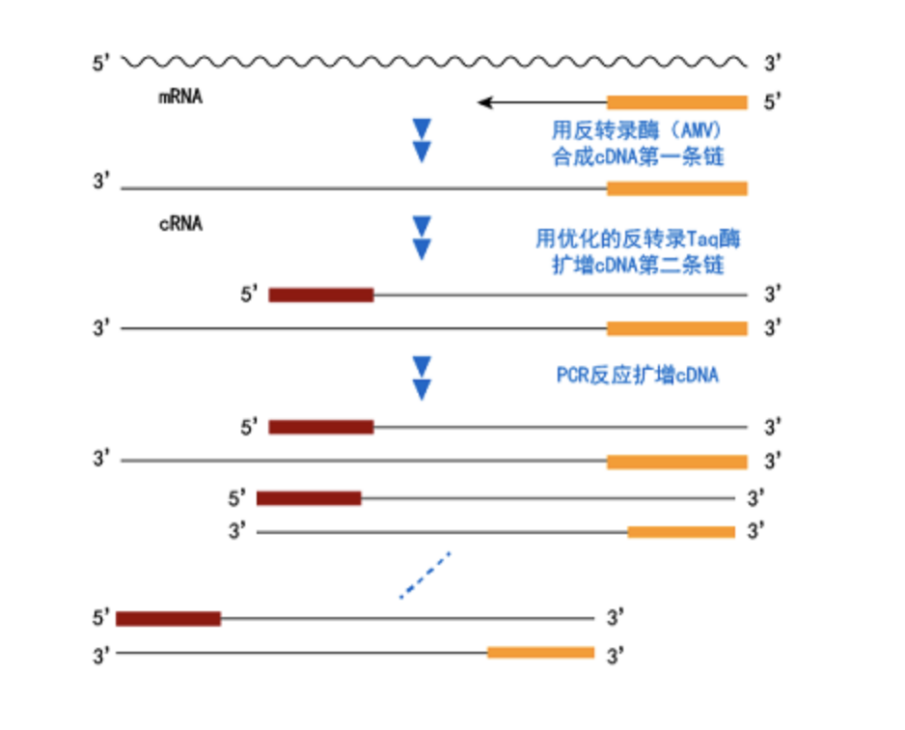

4 RT-PCR实验步骤
4.1 RNA的提取
(1) 50-100mg组织或(5~10)×106个细胞,加入1mL Trizol试剂。对组织来说,需要在匀浆器中匀浆几分钟,至组织完全破碎。对培养细胞来说,可用移液器上下吹打或匀浆机破碎细胞。
(2) 4 ℃、12 000g离心10 min,转移上清。
(3) 上清室温放置5min,加0.2mL氯-仿,用手或Votex剧振15 s,室温放置2~3min。
(4) 4℃、11 000 g离心15 min,转移水相。
(5) 水相中加入0.25 mL异丙醇及0.25 mL高盐沉淀液(0.8mol/L的柠檬酸钠,1.2mol/L的 NaCl)混匀,室温放置10min。
(6) 4℃、11000 g离心10 min去上清。
(7) 加1 mL75%乙醇,Votex混匀,4℃、7000g离心5min,去上清。
(8) 沉淀在空气中干燥5~10 min,用100 μL DEPC水溶解,枪头吸打几次,放于 55℃水浴中10min促溶。
(9) 电泳及检测OD值,检定RNA的量及完整性。
(10) RNA放入-70℃保存。
4.2 mRNA的分离
(1) 检测起始RNA的量(起始RNA的量应小于或等于0.25mg)。将总RNA加入一个无RNase的1.5 mL Eppendorf管中,加入不含RNase的水至总体积为250 μL。
(2) 加入250μL的Buffer OBB和15μL的Oligotex悬浮液,完全混合溶液。
(3) 样品溶液放入70℃水浴中保温3 min。
(4) 从水浴中取出样品溶液,室温下放置10min。(这一步允许Oligotex粒子中的Oligo-dT30 和mRNA的poly-A尾巴杂交)
(5) 将样品溶液以最大速度(14000~18000 g)离心2min以沉淀Oligotex-mRNA 复合物,用移液器小心除去上清液。
(6) 用涡旋振荡器(Votex)或移液器将Oligotex-mRNA复合物沉淀重悬于400 μL或600 μL Buffer OW2中,然后将这些悬液加入到一个置于1. 5 mL微量离心管中的小离心柱(用于400 μL悬液)或大离心柱(用于600 μL悬液)中,以最大速度离心1 min。
(7) 转移离心柱到一个新的不含RNA酶的1.5 mL微量离心管中,然后加入400 μL或600 μL Buffer OW2到离心柱中,以最大速度离心1 min,并且弃掉离心液。
(8) 转移离心柱到一个新的不含RNA酶的1.5mL微量离心管中,加入 20-100 μL Buffer OEB (70℃预热)到柱子中,用移液器洗打溶液3~4次以重悬柱子上的Oligotex-mRNA复合物,以最大速度离心1 min。
(9) 为了获得最大的产量,再加入20-100 μL Bulfer OEB (70℃预热)到柱子中,然后用同样的方法重悬柱子中的Oligotex-mRNA复合物,以最大速度离心1min。为了减少洗脱体积,可以将第一次洗脱液重新加热到70℃后再用来进行另一次洗脱。但是如果要获得最大量的mRNA,则建议还是用新的Buffer OEB来洗脱。
4.3 RT-PCR
(1) 按下列组成配制RT-PCR反应液。

(2)以下条件进行RT-PCR反应。

反转录-聚合酶链式反应(Reverse Transcription-Polymerase Chain Reaction, RT-PCR),也称逆转录PCR,是聚合酶链式反应(PCR)的一种广泛应用的变形。其灵敏度比传统的RNA印迹法高1000〜10000倍,而所需时间缩短了几倍。迄今为止,RT-PCR的方法已经广泛应用于RNA的构造解析、cDNA的克隆及RNA水平上的表达解析等多种领域。
2 RT-PCR原理
RT-PCR是一种从细胞RNA (mRNA)中高效灵敏地扩增cDNA序列的方法,它由两大步骤组成:一步是反转录(RT),另一步是PCR。获得总RNA或mRNA后,即可进行RT-PCR。首先,在反转录酶作用下将RNA(mRNA)反转录成cDNA,以该cDNA第一链为模板进行PCR扩增,根据靶基因设计用于PCR扩增的基因特异的上下游引物,基因特异的上游引物与cDNA第一链退火,在Taq DNA聚合酶作用下合成cDNA第二链。再以cDNA第一链和第二链为模板,用基因特异的上下游引物PCR扩增获得大量的cDNA。反应原理图如下。

3 一步法与两步法RT-PCR
常用的反转录PCR方法有两步法(Two-step RT-PCR)和一步法(One-step RT-PCR)两种。两者的区别与特点如下表所示。
常用的反转录PCR方法有两步法(Two-step RT-PCR)和一步法(One-step RT-PCR)两种。两者的区别与特点如下表所示。

4 RT-PCR实验步骤
4.1 RNA的提取
(1) 50-100mg组织或(5~10)×106个细胞,加入1mL Trizol试剂。对组织来说,需要在匀浆器中匀浆几分钟,至组织完全破碎。对培养细胞来说,可用移液器上下吹打或匀浆机破碎细胞。
(2) 4 ℃、12 000g离心10 min,转移上清。
(3) 上清室温放置5min,加0.2mL氯-仿,用手或Votex剧振15 s,室温放置2~3min。
(4) 4℃、11 000 g离心15 min,转移水相。
(5) 水相中加入0.25 mL异丙醇及0.25 mL高盐沉淀液(0.8mol/L的柠檬酸钠,1.2mol/L的 NaCl)混匀,室温放置10min。
(6) 4℃、11000 g离心10 min去上清。
(7) 加1 mL75%乙醇,Votex混匀,4℃、7000g离心5min,去上清。
(8) 沉淀在空气中干燥5~10 min,用100 μL DEPC水溶解,枪头吸打几次,放于 55℃水浴中10min促溶。
(9) 电泳及检测OD值,检定RNA的量及完整性。
(10) RNA放入-70℃保存。
4.2 mRNA的分离
(1) 检测起始RNA的量(起始RNA的量应小于或等于0.25mg)。将总RNA加入一个无RNase的1.5 mL Eppendorf管中,加入不含RNase的水至总体积为250 μL。
(2) 加入250μL的Buffer OBB和15μL的Oligotex悬浮液,完全混合溶液。
(3) 样品溶液放入70℃水浴中保温3 min。
(4) 从水浴中取出样品溶液,室温下放置10min。(这一步允许Oligotex粒子中的Oligo-dT30 和mRNA的poly-A尾巴杂交)
(5) 将样品溶液以最大速度(14000~18000 g)离心2min以沉淀Oligotex-mRNA 复合物,用移液器小心除去上清液。
(6) 用涡旋振荡器(Votex)或移液器将Oligotex-mRNA复合物沉淀重悬于400 μL或600 μL Buffer OW2中,然后将这些悬液加入到一个置于1. 5 mL微量离心管中的小离心柱(用于400 μL悬液)或大离心柱(用于600 μL悬液)中,以最大速度离心1 min。
(7) 转移离心柱到一个新的不含RNA酶的1.5 mL微量离心管中,然后加入400 μL或600 μL Buffer OW2到离心柱中,以最大速度离心1 min,并且弃掉离心液。
(8) 转移离心柱到一个新的不含RNA酶的1.5mL微量离心管中,加入 20-100 μL Buffer OEB (70℃预热)到柱子中,用移液器洗打溶液3~4次以重悬柱子上的Oligotex-mRNA复合物,以最大速度离心1 min。
(9) 为了获得最大的产量,再加入20-100 μL Bulfer OEB (70℃预热)到柱子中,然后用同样的方法重悬柱子中的Oligotex-mRNA复合物,以最大速度离心1min。为了减少洗脱体积,可以将第一次洗脱液重新加热到70℃后再用来进行另一次洗脱。但是如果要获得最大量的mRNA,则建议还是用新的Buffer OEB来洗脱。
4.3 RT-PCR
(1) 按下列组成配制RT-PCR反应液。

(2)以下条件进行RT-PCR反应。

(3)反应结束后,取PCR反应液(5-10μL)进行琼脂糖凝胶电泳,确认RT-PCR反应产物。如果此PCR产物需要用于以后实验,必将PCR产物放于-20℃冷冻保存。
5 RT-PCR常见问题解析
一步RT-PCR和两步RT-PCR方法哪个更好?应该怎么选择?
一步RT-PCR的最大优点是操作简单,因此可避免样品间的交叉污染。但我们的实践经验表明,在大多数情况下,应首先考虑两步RT-PCR法,而不是一步RT-PCR法,因为两步RT-PCR法产物的产量一般高于一步RT-PCR法;此外两步法具有更大的灵活性,可以分别优化RT和PCR两步反应,而无需考虑它们之间的干扰。
RT-PCR以总RNA作为模板还是以mRNA作为模板好?
提取总RNA还是mRNA取决于实验目的。一般情况下(如克隆基因或比较不同样品间基因表达水平时),提取总RNA即可作为RT-PCR的模板。这样可以减少获得cDNA的实验步骤,从而减少实验误差。另外,分离总RNA要比分离mRNA少用一些试剂,因此更经济。但是若要构建cDNA文库,则需要分离mRNA作为模板,以便提高cDNA文库的质量。
如何保证作为RT-PCR实验模板的总RNA的数量和质量?
RT-PCR能否成功的关键之一是提取的总RNA的数量和质量。要想保证获得高质量的总RNA,有两点需要特别注意:
(1) Trizol试剂的选择。尽管有很多国内公司都提供廉价的Trizol试剂出售,但还是强烈推荐购买质量更可靠的Invitrogen等公司的Trizol试剂。
(2) 提取RNA过程,必须特别小心,严格按照要求操作,以防止RNA的降解。
如何防止提取RNA过程中RNA的降解?
主要注意以下几点:
(1) 实验过程中使用的玻璃器皿使用前可于180 ℃干烤8h以上,塑料制品要用氯-仿冲洗。焦磷酸二乙酯(DEPC)是RNase酶的强烈抑制剂,RNA提取过程和反转录过程中所用的水要用DEPC处理。
(2) 操作人员的手是RNase的重要污染源,进行RNA实验时应始终戴手套,并应勤换手套。
(3) 提取的样品材料应尽可能新鲜,如果不能及时提取RNA,取样后应保存于液氮中。
如何选择反转录引物?
两步法中反转录引物有Oligo(dT)(12-18个核苷酸组成)、随机六聚寡核苷酸和基因特异引物,可根据不同的目的选择不同的引物。Oligo(dT)引物能与哺乳动物mRNA的3'端poly(A)尾巴互补,作为一种通用引物用于cDNA第一链的合成。随机六聚寡核苷酸引物能与RNA模板的许多位点互补,因此,当RNA序列很长(>3kb)或其中包含很多二级结构使Oligo (dT)或基因特异引物很难与mRNA互补时,选择随机六聚寡核苷酸引物不失为一种良策。
基因特异引物能与靶mRNA的某一区域互补,该引物可用作 PCR反应中的下游引物。基因特异引物在细胞内靶mRNA含量较低时较为有用。
当用基因特异引物进行反转录时,需注意引物的浓度和退火温度。一般而言,用Oligo (dT)获得的RT-PCR产物特异性比随机六寡核苷酸获得的RT-PCR产物的特异性高。一步法中所用引物为基因特异引物,因此选择余地比两步法少。一步RT-PCR中两条引物的其中一条既应在RT中发挥作用,又应在PCR中发挥作用。为兼顾RT和PCR,引物的退火温度一般在45~65℃之间。为增加一步RT-PCR产物的量,引物浓度可增加到0.6 μmol/L。引物最好设计在离mRNA 3'末端4 kb区域以内,扩增长度小于1.5 kb。
RT-PCR的产物产率很低是什么原因?
可能是因为反转录cDNA合成效率低,但更多情况下是因为cDNA扩增效率低。为了验证后者的可能性,可建立一系列PCR反应,这些PCR反应中加入了不同数量的模板。 假如染色后的凝胶上呈现不清晰的成片状的非特异性条带,这种实验结果往往是在PCR中加入过量的cDNA模板所致。因此,在许多PCR实验中用反转录反应产生的cDNA的10%作为模板。在这种情况下,PCR扩增阶段需要另加模板。具体最适合的模板量,要靠预实验确定。一旦建立了模板的最佳浓度,其他的PCR参数可用系统的方式如改变 Mg2+浓度和复性条件来进一步优化。
上述调整后RT-PCR的产物产率依然很低,怎么办?
可依次采取以下步骤:
(1) 通过含有甲醛的琼脂糖凝胶电泳来检査RNA的完整性。
(2) 建立含有对照mRNA、Oligo (dT)引物和放射性元素标记示踪物的检测反应来检测cDNA的合成效率。
(3) 将不同比例的RNA样品和对照样品混合,通过比较cDNA的产量来检测RNA样品中是否存在抑制剂。
(4) 在继续进行PCR之前,纯化cDNA第一链的样品。
RT-PCR反应后,无PCR产物,怎么办?
首先应严格按照说明书要求,进行Control反应。如果对照正常,说明实验操作方面没有问题。应从RNA样品的纯度和添加量、引物的设计情况、参考文献的可信度以及RT-PCR条件的设定等方面加以考虑;如对照反应不正常,应从实验操作的准确性、实验器具的处理、PCR仪的条件设定等方面加以考虑。
有些RT反应体系中,不加dNTP混合物,为什么?
由于在这些RT反应体系中已经加了足够量的dNTP Mixture,因此在PCR反应中,不须再添加dNTP。如果在PCR反应时继续添加,虽然PCR反应仍可进行,但可能会降低DNA的扩增效率。
5 RT-PCR常见问题解析
一步RT-PCR和两步RT-PCR方法哪个更好?应该怎么选择?
RT-PCR以总RNA作为模板还是以mRNA作为模板好?
如何保证作为RT-PCR实验模板的总RNA的数量和质量?
(1) Trizol试剂的选择。尽管有很多国内公司都提供廉价的Trizol试剂出售,但还是强烈推荐购买质量更可靠的Invitrogen等公司的Trizol试剂。
(2) 提取RNA过程,必须特别小心,严格按照要求操作,以防止RNA的降解。
如何防止提取RNA过程中RNA的降解?
(1) 实验过程中使用的玻璃器皿使用前可于180 ℃干烤8h以上,塑料制品要用氯-仿冲洗。焦磷酸二乙酯(DEPC)是RNase酶的强烈抑制剂,RNA提取过程和反转录过程中所用的水要用DEPC处理。
(2) 操作人员的手是RNase的重要污染源,进行RNA实验时应始终戴手套,并应勤换手套。
(3) 提取的样品材料应尽可能新鲜,如果不能及时提取RNA,取样后应保存于液氮中。
如何选择反转录引物?
基因特异引物能与靶mRNA的某一区域互补,该引物可用作 PCR反应中的下游引物。基因特异引物在细胞内靶mRNA含量较低时较为有用。
当用基因特异引物进行反转录时,需注意引物的浓度和退火温度。一般而言,用Oligo (dT)获得的RT-PCR产物特异性比随机六寡核苷酸获得的RT-PCR产物的特异性高。一步法中所用引物为基因特异引物,因此选择余地比两步法少。一步RT-PCR中两条引物的其中一条既应在RT中发挥作用,又应在PCR中发挥作用。为兼顾RT和PCR,引物的退火温度一般在45~65℃之间。为增加一步RT-PCR产物的量,引物浓度可增加到0.6 μmol/L。引物最好设计在离mRNA 3'末端4 kb区域以内,扩增长度小于1.5 kb。
RT-PCR的产物产率很低是什么原因?
上述调整后RT-PCR的产物产率依然很低,怎么办?
(1) 通过含有甲醛的琼脂糖凝胶电泳来检査RNA的完整性。
(2) 建立含有对照mRNA、Oligo (dT)引物和放射性元素标记示踪物的检测反应来检测cDNA的合成效率。
(3) 将不同比例的RNA样品和对照样品混合,通过比较cDNA的产量来检测RNA样品中是否存在抑制剂。
(4) 在继续进行PCR之前,纯化cDNA第一链的样品。
RT-PCR反应后,无PCR产物,怎么办?
有些RT反应体系中,不加dNTP混合物,为什么?





