国自然热点课题 | 外泌体与血管生成研究攻略
自2013年“细胞囊泡运输调节机制”获得诺贝尔生理或医学奖后,外泌体作为细胞外囊泡之一,逐步成为国内外科研人员的研究热点!已有文献报道,不同来源的外泌体在不同缺血疾病模型中可修复血管损伤、促进血管新生,从而延缓血管生成障碍疾病的病理进程,同时在疾病病发及预后方面也发挥重要作用,具有很好的临床应用前景。
一、什么是外泌体?
外泌体(Exosomes)是纳米级的细胞外微小囊泡,可由包括肿瘤细胞、巨噬细胞、神经元细胞、内皮祖细胞、树突状细胞、骨髓间充质干细胞等几乎所有细胞分泌。同时,外泌体几乎存在于所有的体液中,如全血、血浆、尿液、脑脊液、唾液、乳汁、眼泪等。外泌体具有供体细胞的典型特征,内容物包括蛋白质、脂质、遗传物质和小分子代谢物等。
其中,成熟miRNA占外泌体总RNA的近41.7%,在外泌体发挥功能中具有重要作用。这些特征使外泌体具备良好的生物学特性,包括生物相容性、稳定性、低毒性、低免疫原性和分子货物的高效交换等,使其成为再生医学和组织工程的主要候选者。特别是在血管生成中的作用已在多种细胞类型中得到验证,因而在缺血性疾病中具有良好应用前景。

图1 外泌体非编码RNA在骨相关疾病中的可能作用机制[1]
外泌体的分离和纯化是研究者关注的问题和难点,因此获得高纯度的外泌体对科研人员的研究工作至关重要。
2、保存方法:提取后一般置于磷酸盐缓冲液中。目前应用的保护技术主要有冷冻、冷冻干燥和喷雾干燥。建议提取后最好新鲜使用,或低温短期保存,短时间内可以存放于4℃或-20℃环境中,长时间储存应置于-80℃保存,但要避免反复冻融[2]。
3、鉴定方法:透射电子显微镜、纳米粒子追踪分析和Western blot是常用的3种表征组合[3]。
4、机制探究:外泌体示踪技术,亲脂性荧光染料(表1)示踪外泌体操作简单,被广泛应用[4]。
血管生成(Angiogenesis)是指一个新的微血管发展成一个血流供应系统的生理过程,包含多步骤且高度调节,对于生长、发育和修复受损组织至关重要。血管生成可能通过两种机制发生,包括芽生和非芽生。血管生成由多种生长因子和信号通路控制,其发生与否取决于生物环境中促血管生成因子和抗血管生成因子之间的平衡。
二、什么是血管生成?
图2 血管生成示意图(图片来源于网络)
已有大量研究表明,恶性肿瘤的发生伴随着高水平的血管生成。VEGF、Ang-2、FGF、TGF-β、HGF和ET等血管生成因子通过与相应的受体结合,激活相关的信号通路,ECs的糖酵解途径促使TCs迁移和SCs增殖,DLL4和PDGF等信号通路的激活刺激血管分支和成熟。
因此,针对血管生成相关信号通路,可选取适当靶点,进行肿瘤靶向治疗。大分子单抗药物贝伐单抗能与VEGF结合,阻止其与VEGFR受体的信号转导,起到抗血管生成的作用。小分子多靶点酪氨酸激酶抑制剂通过抑制受体信号通路来阻断血管生成。重组人血管内皮抑制素抑制ECs迁移,阻止血管生成(图3)。
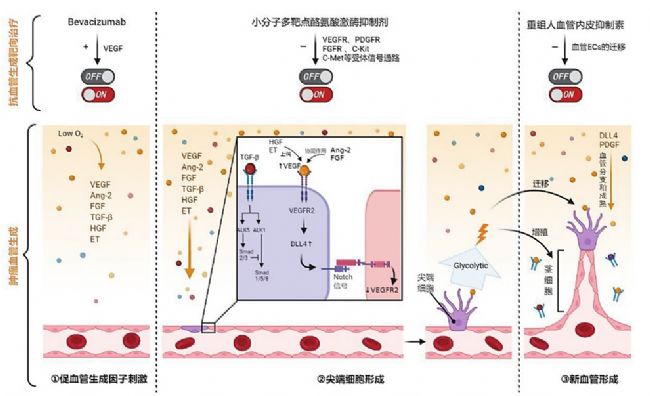
图3 血管生成在恶性肿瘤中的作用及靶向治疗的策略[5]
三、外泌体促进血管生成
最近,中国中医科学院望京医院魏戌研究团队在《中国病理生理杂志》上发表综述型论文《不同干细胞来源的外泌体促进血管形成的研究进展》,该团队获国家自然科学基金项目支柱,基金编号为82174416。该论文综述了骨髓间充质干细胞、脂肪干细胞、人脐带间充质干细胞、胎盘间充质干细胞、诱导性多能干细胞和内皮祖细胞等不同干细胞来源的外泌体在血管生成中的作用和调控机制,并强调了miRNA介导的机制。
他们表明,各种干细胞来源的外泌体在血管生成中的潜力是非常有前景的,进一步明确外泌体在血管生成中的功能与机制,并推进相关临床研究,将有助于开发针对血管生成障碍有关疾病的有效治疗策略,从而使外泌体的治疗具备理论价值与实践意义。
2023年3月27日,哈尔滨医科大学杨宝峰和杜伟杰团队在Signal Transduction and Targeted Therapy(IF=38)在线发表题为“Exosomes secreted from cardiomyocytes suppress the sensitivity of tumor ferroptosis in ischemic heart failure”的研究论文,该研究结果首次揭示了心肌梗死(MI)通过释放源自心肌细胞的miR-22-3p富集外泌体来抑制Erastin诱导的铁死亡(图4)。
因此,靶向外泌体介导的心肌细胞/肿瘤病理通讯可能为基于铁死亡的抗肿瘤治疗提供一种新的途径。
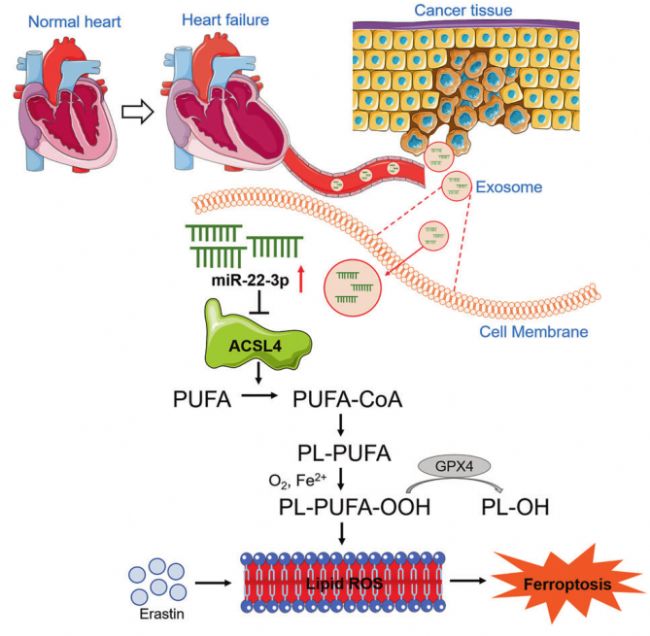
图4 MI后心力衰竭导致肿瘤细胞对脱铁性死亡脱敏的信号通路示意图[6]
参考文献
[1] Li H, Zheng Q, Xie X, et al. Role of exosomal noncoding RNAs in bone-related diseases[J]. Front Cell Dev Biol, 2021, 9:811666.
[2] Wu JY, Li YJ, Hu XB, et al. Preservation of small extracellular vesicles for functional analysis and therapeutic applications:a comparative evaluation of storage conditions[J]. Drug Deliv, 2021,28(1):162-170.
[3] Zeng W, Guo L. Research advances in the application of adipose-derived stem cells derived exosomes in cutaneous wound healing[J]. Ann Dermatol, 2021, 33(4):309-317.
[4] Dehghani M, Gaborski TR. Fluorescent labeling of extracellular vesicles[J]. Methods Enzymol, 2020, 645:15-42.
[5] 宗如月,罗新鹏,路小超等.血管生成在恶性肿瘤中作用及靶向治疗策略的研究进展[J].生命科学, 2022(006):034.
[6] Yuan, Y., Mei, Z., Qu, Z. et al. Exosomes secreted from cardiomyocytes suppress the sensitivity of tumor ferroptosis in ischemic heart failure. Sig Transduct Target Ther 8, 121 (2023). https://doi.org/10.1038/s41392-023-01336-4.





