DRIP-seq揭示AMPK通过R-loop形成以维持基因组稳定和生殖细胞完整
在饥饿等能量胁迫条件下,生物体会通过调整基因表达和代谢来适应。AMPK(AMP激活蛋白激酶)是一种高度保守的代谢主调控因子,能够感知能量水平的降低,并在饥饿等应激条件下合理分配能量。秀丽隐杆线虫(Caenorhabditis elegans,C. elegans)在胚胎发育结束后,如果营养充足则继续发育;如果缺乏食物,则进入一种静止的非发育状态(L1滞育期),细胞分裂暂停,转录和翻译维持在最低水平。研究者之前发现,缺乏AMPK的线虫在从急性饥饿中恢复后,会出现生殖缺陷,且这些缺陷会传递到未经历饥饿的后代中。那么秀丽隐杆线虫在饥饿条件下,AMPK缺失是如何导致表观遗传修饰异常、基因组不稳定性以及生殖缺陷的呢?
近日,加拿大麦吉尔大学生物系Bing Sun、McLean Sherrin、Richard Roy揭示了AMPK缺失导致的异常表观遗传修饰(特别是组蛋白H3K4me3的异常沉积)如何通过形成异常的R-loop结构(RNA-DNA杂合体)影响基因组稳定性,并导致生殖缺陷。还探讨了这些表观遗传修饰和R-loop的跨代遗传性,以及它们对生殖细胞完整性和DNA损伤响应的影响。相关研究成果以“Unscheduled epigenetic modifications cause genome instability and sterility through aberrant R-loops following starvation”为题发表于《Nucleic Acids Research》(NAR)期刊。

标题:Unscheduled epigenetic modifications cause genome instability and sterility through aberrant R-loops following starvation(饥饿后,异常的的表观遗传修饰通过异常的R-loop结构导致基因组不稳定性和不育)
发表时间:2023-1-11
发表期刊:Nucleic Acids Research
影响因子:IF 16.6 / 1区
技术平台:ChIP-seq、DRIP-seq
在饥饿期间,生物体会调整基因表达和代谢以适应能量胁迫。作者先前研究表明,AMP激活蛋白激酶(AMPK)缺乏的秀丽隐杆线虫在从急性饥饿中恢复后,其生殖细胞中组蛋白H3在第4位赖氨酸上三甲基化(H3K4me3)水平异常升高,并表现出跨代生殖缺陷。本研究进一步发现,这些H3K4me3修饰在启动子区域显著增加,驱动异常的转录延伸,导致饥饿的AMPK突变体中R-loop结构积累。
作者通过DNA-RNA免疫沉淀高通量测序(DRIP-seq)分析发现基因组中有相当一部分区域受R-loop形成影响,尤其在染色质被H3K4me3修饰的基因启动子-转录起始位点区域影响最为显著。与H3K4me3类似,R-loop也具有可遗传性,可能促进了这些突变体在饥饿后典型的跨代生殖缺陷。此外,AMPK突变体的生殖细胞在R-loop形成位点显示出显著更多的RAD-51(一种RecA类重组酶)焦点,这可能会限制它们在减数分裂断裂或诱导性DNA损伤位点的正常功能。
本研究揭示了AMPK在饥饿后维持基因组稳定性中的重要作用。R-loop对DNA损伤敏感性和生殖干细胞完整性的下游影响,可能解释了在许多人类疾病(包括各种癌症)中发生的异常表观遗传修饰。
研究方法
实验模型:使用秀丽隐杆线虫(C. elegans),特别是缺乏AMPK的突变体(aak-1/2)。
实验设计:将线虫置于饥饿条件下(M9缓冲液中3天),然后恢复营养供应,观察其生殖和基因组变化。
技术手段:
ChIP-seq(染色质免疫沉淀测序):用于分析H3K4me3在基因组中的分布。
DRIP-seq(DNA-RNA免疫沉淀测序):用于检测R-loop的形成和分布。
免疫荧光:检测R-loop和RAD-51(一种DNA修复蛋白)的定位。
药物处理和基因过表达:通过抑制转录延伸或过表达RNH-1(RNA酶H同源物)来研究R-loop的形成机制。
基因表达分析:通过4sU标记和qPCR验证R-loop的形成与转录活性的关系。
关键发现
(1)H3K4me3的异常沉积
在饥饿条件下,AMPK缺失的线虫中,H3K4me3在基因启动子和转录起始位点(TSS)区域显著增加,这种异常沉积可跨代遗传。此外,这些异常的H3K4me3位点与RNA聚合酶II(Pol II)的转录延伸活性相关,表明它们可能激活了本应沉默的基因。

图1. 饥饿的AMPK突变体后代中,异常的H3K4me3沉积主要发生在TSS区域。
A. H3K4me3 ChIP-seq分析的样本收集方案。 P0代L1滞育期动物在M9缓冲液中饥饿3天,随后让幼虫进食直至收集F2代成虫。
B. H3K4me3 ChIP-seq信号在rps-20、orc-5、tlf-1、mdt-18和rpb-10基因的启动子-TSS区域的基因组浏览器快照。绿条表示启动子-TSS区域的H3K4me3信号peaks。轨迹高度代表测序reads数。
C. 野生型(WT)与AMPK突变体在TSS处的H3K4me3信号的线性轨迹。
D. WT和aak-1/2动物在TSS处的H3K4me3信号的k均值聚类热图。
E. H3K4me3 peaks的注释和定位分析。 分析了比对到启动子-TSS、转录终止位点(TTS)、外显子和其他区域的H3K4me3 peaks。在aak-1/2突变体中,peaks主要累积在启动子-TSS区域。
F. 饥饿的AMPK突变体中异常的H3K4me3位点参与转录。 在L1滞育后的野生型(N2)和AMPK突变体F2成虫中进行抗H3K4me3的ChIP实验。
G. 饥饿的AMPK突变体中活跃转录水平更高。 使用4sU标记法评估饥饿的AMPK突变体L1幼虫的F2代后代中的活跃转录,同时处理的野生型对照组也进行了类似分析(左图)。在10分钟脉冲标记后评估并定量了4sU的掺入率(右图)。
(2)R-loop的形成与积累:
在饥饿条件下,AMPK缺失的线虫生殖细胞中R-loop显著增加,尤其是在启动子-TSS区域。R-loop的形成与H3K4me3的异常沉积相关,且这种R-loop增加可以传递到后代中。通过RNH-1过表达或抑制转录延伸,可以减少R-loop的形成,并部分恢复线虫的生育能力。
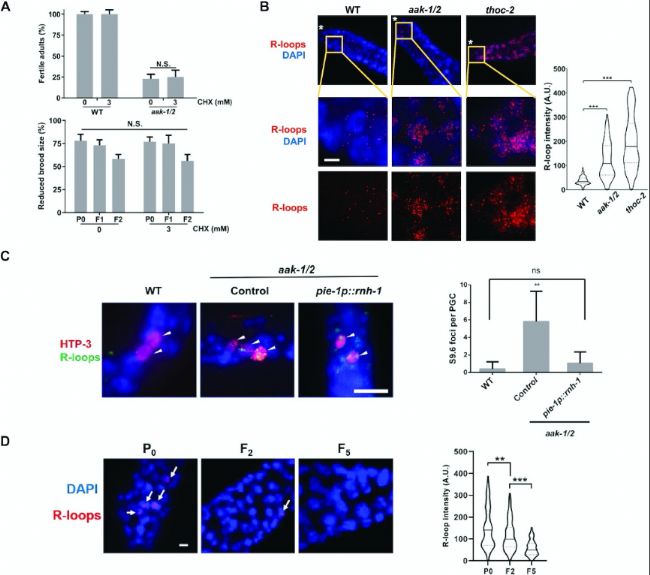
图2:R-loop在饥饿的AMPK突变体生殖细胞中积累。
A. 饥饿后的AMPK突变体(P0代)的生殖表型并非由蛋白质合成时机不当引起。上图:野生型(WT)和aak-1/2幼虫在含有CHX(浓度如图所示)的M9缓冲液中维持3天后,转移至营养充足的培养基中。图中显示的是成虫的可育比例,样本量n≥150。下图:在饥饿期间用CHX处理的AMPK突变体后代(F1和F2代)中,繁殖力缺陷并未得到恢复。图中显示的是aak-1/2突变体及其后代(F1和F2代)中繁殖力降低的频率,样本量n≥50。
B. R-loop在AMPK突变体的生殖细胞中积累。代表性显微照片显示了饥饿的AMPK突变体和WT年轻成虫生殖细胞中的R-loop。thoc-2突变体的生殖细胞作为R-loop检测的阳性对照。WT和aak-1/2的L1幼虫饥饿3天后转移至营养充足的条件下。生殖细胞经固定后,用S9.6抗体(红色,标记R-loop)进行免疫染色,并用DAPI(蓝色)进行复染。图中框出的部分在下方以更高倍率显示(N=3,n=100)。星号(*)表示远端尖细胞;比例尺:5μm。右侧图:通过免疫荧光定量分析显示,饥饿的AMPK突变体生殖细胞中R-loop的总体丰度显著增加;n=100。
C. R-loop在AMPK突变体的原始生殖细胞(PGC)中形成,并在表达RNH-1后得以缓解。WT和aak-1/2的L1幼虫饥饿3天后,用S9.6抗体(绿色,标记R-loop)进行免疫染色,并用生殖细胞特异性标记物HIM-3同源物(HTP)-3(红色)进行复染。类似地,表达生殖细胞特异性RNH-1转基因(pie-1p::rnh-1)的饥饿突变体动物的R-loop水平与对照组相似。每种基因型的PGC中R-loop水平被定量并以图形显示。白色箭头表示PGC(注意饥饿的AMPK突变体有额外的PGC)。
D. R-loop在AMPK突变体中随着后代延续逐渐减少。通过免疫荧光使用S9.6抗体(红色,标记R-loop)和DAPI(蓝色)复染,检测P0(n=83)、F2(n=100)和F5(n=81)成虫生殖细胞核中的DNA-RNA杂合体。白色箭头表示R-loop(S9.6)焦点。P0(n=83)、F2(n=100)和F5(n=81)通过S9.6抗体进行免疫荧光分析。
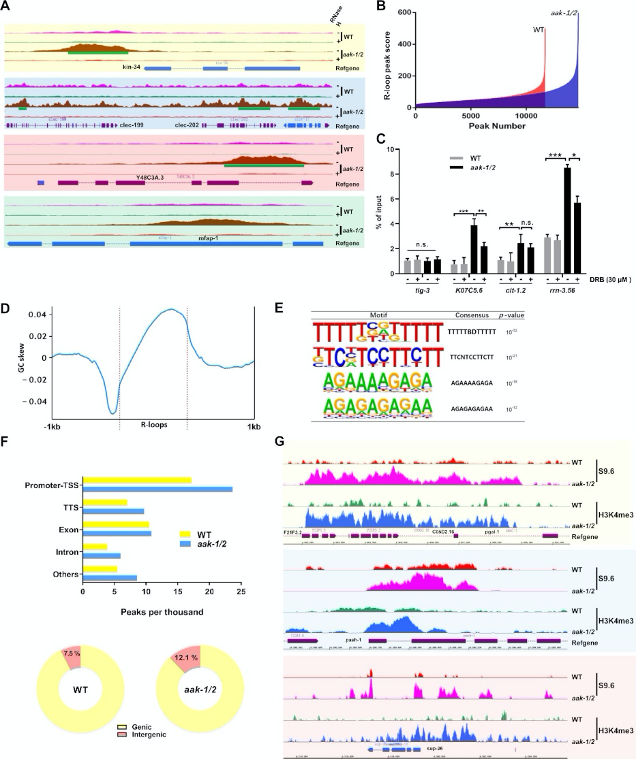
B. 野生型(WT)与aak-1/2基因组的DRIP-seq output(peak分数和数量)的整体比较。
C. DRIP-qPCR验证。 收集了经过或未经DRB处理的饥饿的aak-1/2突变体的F2后代(饥饿3天)进行DRIP分析。选择tig-3作为阴性对照;n=3,均值±标准误(S.E.M.)。以input基因组DNA为基准进行信号值归一化并绘制。
D. 以所有R-loop peaks为中心的GC偏好Meta图。
E. 通过HOMER分析AMPK突变体与WT DRIP-seq鉴定的四个富集的de novo motif。
F. 上:注释和R-loop peaks定位分析,显示peaks比对到启动子-TSS、转录终止位点(TTS)、外显子、内含子和其他区域。在aak-1/2突变体中,peaks主要累积在启动子-TSS区域。
G. 下:WT或饥饿aak-1/2突变体F2后代DRIP-seq信号分布饼图,显示基因内与基因间区域分布。
H. 基因组浏览器快照显示饥饿的AMPK突变体F2后代中R-loop信号与H3K4me3水平正相关的代表性样本。
(3)RAD-51异常积累与DNA损伤:
AMPK缺失的线虫生殖细胞中,RAD-51焦点显著增加,且与R-loop共定位。这些异常的RAD-51焦点可能与R-loop引起的DNA损伤相关,导致生殖细胞的凋亡增加。在缺乏p53信号通路的线虫中,生殖细胞凋亡减少,但胚胎致死率增加,表明DNA损伤未被修复。
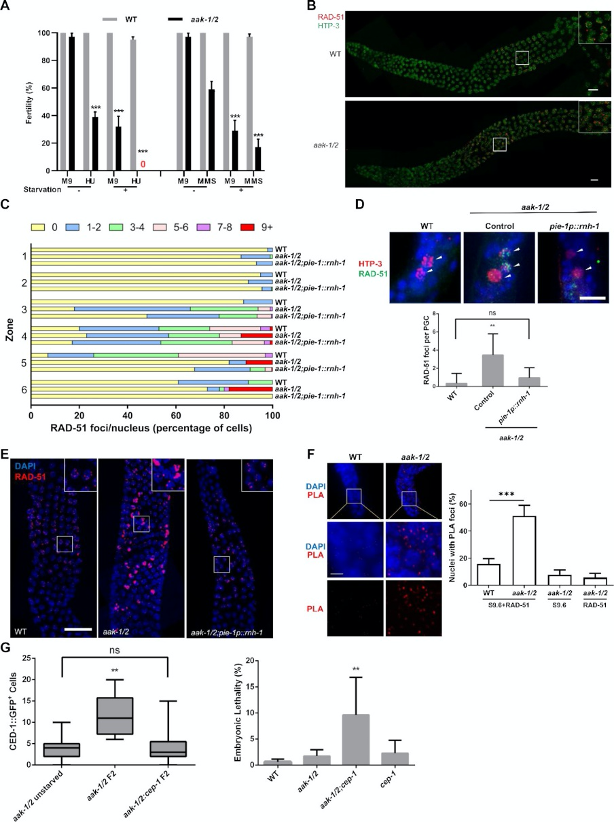
图4. 饥饿导致AMPK突变体中RAD-51异常聚集到与R-loop相关的位点。
A. AMPK突变体L1幼虫对基因毒性应激敏感,并在饥饿后变得超敏感。饥饿或进食4小时的L1幼虫被暴露于25 mM HU和0.01% MMS中,这些浓度低于之前确定的导致野生型(WT)动物不育的阈值(48)。
B. 饥饿的AMPK突变体生殖细胞中RAD-51焦点异常增加。
C. RAD-51焦点的数量和出现时间在生殖细胞的六个区域中的定量分析:有丝分裂区、过渡区、早中期偶线期、中期偶线期、晚中期偶线期和双线期,n>5。
D. 代表性显微照片显示3天饥饿的L1幼虫原始生殖细胞(PGC)中的RAD-51焦点。
E. 免疫荧光显微照片显示饥饿的WT、aak-1/2突变体以及aak-1/2;pie-1p::rnh-1转基因线虫的年轻成虫生殖细胞晚中期偶线期区域中的RAD-51焦点。
F. 饥饿的AMPK突变体F2后代生殖细胞中异常丰富的RAD-51信号与R-loop重叠。上图:PLA信号以红色斑点表示。星号(*)表示远端尖细胞。下图:每条生殖腺中带有PLA焦点的细胞核的百分比定量分析。显示AMPK突变体生殖腺的单抗体对照;n=5。
G. 左图:饥饿的WT与AMPK突变体生殖腺中增加的细胞死亡依赖于DNA损伤。通过计数生殖腺臂中异常细胞死亡(CED)-1::GFP阳性细胞来定量凋亡小体。箱线图显示组内平均值、50%范围和最小到最大值,n=25。右图:去除cep-1信号通路会增加饥饿的WT与AMPK突变体生殖腺中的胚胎致死率。定量分析之前饥饿的指定基因型动物F2后代中的胚胎致死率。样本数量:WT,n=10;aak-1(tm1844) I,aak-2(ok524) X,n=10;aak-1(tm1844) I,aak-2(ok524)X;cep-1(gk138) I,n=20;cep-1(gk138) I,n=20。
(4)跨代遗传的生殖缺陷:
AMPK缺失导致的异常H3K4me3和R-loop的形成不仅影响当前代,还会传递到未经历饥饿的后代中,导致生殖缺陷逐渐加剧。这些表观遗传修饰和R-loop跨代传递可能通过生殖细胞中的“分子记忆”实现。
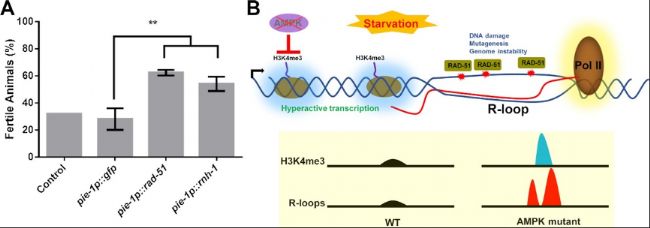 图5. R-loop位点上的RAD-51隔离限制了其在减数分裂中的可用性,导致饥饿依赖性生殖缺陷。
图5. R-loop位点上的RAD-51隔离限制了其在减数分裂中的可用性,导致饥饿依赖性生殖缺陷。
A. pie-1p::rad-51的多拷贝阵列可以部分恢复AMPK突变体在饥饿后的生殖能力。转基因L1幼虫在20°C下于M9缓冲液中维持72小时,随后恢复到营养充足条件下。在恢复后96小时评估生育百分比。
B. 模型展示了在急性饥饿期间发生的AMPK依赖性事件。AMPK限制了异常的H3K4me3沉积及其随后导致的转录,这种转录增加了R-loop的形成和基因组不稳定性。
易小结:
本研究揭示了AMPK在饥饿条件下通过调控H3K4me3沉积和R-loop形成来维持基因组稳定性和生殖细胞完整性的机制。AMPK缺失导致的异常表观遗传修饰和R-loop积累不仅影响当前代,还会跨代传递,导致生殖缺陷和基因组不稳定性。这些发现为理解环境应激与表观遗传修饰之间的关系提供了新的见解,并可能对人类生殖健康和癌症研究产生重要影响。
本研究的重要意义
ChIP-seq和DRIP-seq在本研究中的作用
DRIP-seq(DNA-RNA免疫沉淀测序)和ChIP-seq(染色质免疫沉淀测序)是两种关键的高通通量测序技术,分别用于研究R-loop的形成和组蛋白修饰的分布, DRIP-seq和ChIP-seq在本研究中共同揭示了AMPK缺失如何通过H3K4me3的异常沉积导致R-loop的形成,进而引发基因组不稳定性。
DRIP-seq专注于R-loop的全基因组分布及其与转录活性的关系,而ChIP-seq则专注于H3K4me3修饰的分布及其对转录调控的影响。
两种技术的结合为理解AMPK在维持基因组稳定性中的作用提供了全面的视角,并揭示了表观遗传修饰异常如何导致跨代生殖缺陷和基因组不稳定性。
参考文献:
Sun B, Sherrin M, Roy R. Unscheduled epigenetic modifications cause genome instability and sterility through aberrant R-loops following starvation. Nucleic Acids Res. 2023 Jan 11;51(1):84-98. pii: 6887602. doi: 10.1093/nar/gkac1155.
近日,加拿大麦吉尔大学生物系Bing Sun、McLean Sherrin、Richard Roy揭示了AMPK缺失导致的异常表观遗传修饰(特别是组蛋白H3K4me3的异常沉积)如何通过形成异常的R-loop结构(RNA-DNA杂合体)影响基因组稳定性,并导致生殖缺陷。还探讨了这些表观遗传修饰和R-loop的跨代遗传性,以及它们对生殖细胞完整性和DNA损伤响应的影响。相关研究成果以“Unscheduled epigenetic modifications cause genome instability and sterility through aberrant R-loops following starvation”为题发表于《Nucleic Acids Research》(NAR)期刊。

标题:Unscheduled epigenetic modifications cause genome instability and sterility through aberrant R-loops following starvation(饥饿后,异常的的表观遗传修饰通过异常的R-loop结构导致基因组不稳定性和不育)
发表时间:2023-1-11
发表期刊:Nucleic Acids Research
影响因子:IF 16.6 / 1区
技术平台:ChIP-seq、DRIP-seq
在饥饿期间,生物体会调整基因表达和代谢以适应能量胁迫。作者先前研究表明,AMP激活蛋白激酶(AMPK)缺乏的秀丽隐杆线虫在从急性饥饿中恢复后,其生殖细胞中组蛋白H3在第4位赖氨酸上三甲基化(H3K4me3)水平异常升高,并表现出跨代生殖缺陷。本研究进一步发现,这些H3K4me3修饰在启动子区域显著增加,驱动异常的转录延伸,导致饥饿的AMPK突变体中R-loop结构积累。
作者通过DNA-RNA免疫沉淀高通量测序(DRIP-seq)分析发现基因组中有相当一部分区域受R-loop形成影响,尤其在染色质被H3K4me3修饰的基因启动子-转录起始位点区域影响最为显著。与H3K4me3类似,R-loop也具有可遗传性,可能促进了这些突变体在饥饿后典型的跨代生殖缺陷。此外,AMPK突变体的生殖细胞在R-loop形成位点显示出显著更多的RAD-51(一种RecA类重组酶)焦点,这可能会限制它们在减数分裂断裂或诱导性DNA损伤位点的正常功能。
本研究揭示了AMPK在饥饿后维持基因组稳定性中的重要作用。R-loop对DNA损伤敏感性和生殖干细胞完整性的下游影响,可能解释了在许多人类疾病(包括各种癌症)中发生的异常表观遗传修饰。
研究方法
实验模型:使用秀丽隐杆线虫(C. elegans),特别是缺乏AMPK的突变体(aak-1/2)。
实验设计:将线虫置于饥饿条件下(M9缓冲液中3天),然后恢复营养供应,观察其生殖和基因组变化。
技术手段:
ChIP-seq(染色质免疫沉淀测序):用于分析H3K4me3在基因组中的分布。
DRIP-seq(DNA-RNA免疫沉淀测序):用于检测R-loop的形成和分布。
免疫荧光:检测R-loop和RAD-51(一种DNA修复蛋白)的定位。
药物处理和基因过表达:通过抑制转录延伸或过表达RNH-1(RNA酶H同源物)来研究R-loop的形成机制。
基因表达分析:通过4sU标记和qPCR验证R-loop的形成与转录活性的关系。
关键发现
(1)H3K4me3的异常沉积
在饥饿条件下,AMPK缺失的线虫中,H3K4me3在基因启动子和转录起始位点(TSS)区域显著增加,这种异常沉积可跨代遗传。此外,这些异常的H3K4me3位点与RNA聚合酶II(Pol II)的转录延伸活性相关,表明它们可能激活了本应沉默的基因。

图1. 饥饿的AMPK突变体后代中,异常的H3K4me3沉积主要发生在TSS区域。
B. H3K4me3 ChIP-seq信号在rps-20、orc-5、tlf-1、mdt-18和rpb-10基因的启动子-TSS区域的基因组浏览器快照。绿条表示启动子-TSS区域的H3K4me3信号peaks。轨迹高度代表测序reads数。
C. 野生型(WT)与AMPK突变体在TSS处的H3K4me3信号的线性轨迹。
D. WT和aak-1/2动物在TSS处的H3K4me3信号的k均值聚类热图。
E. H3K4me3 peaks的注释和定位分析。 分析了比对到启动子-TSS、转录终止位点(TTS)、外显子和其他区域的H3K4me3 peaks。在aak-1/2突变体中,peaks主要累积在启动子-TSS区域。
F. 饥饿的AMPK突变体中异常的H3K4me3位点参与转录。 在L1滞育后的野生型(N2)和AMPK突变体F2成虫中进行抗H3K4me3的ChIP实验。
G. 饥饿的AMPK突变体中活跃转录水平更高。 使用4sU标记法评估饥饿的AMPK突变体L1幼虫的F2代后代中的活跃转录,同时处理的野生型对照组也进行了类似分析(左图)。在10分钟脉冲标记后评估并定量了4sU的掺入率(右图)。
(2)R-loop的形成与积累:
在饥饿条件下,AMPK缺失的线虫生殖细胞中R-loop显著增加,尤其是在启动子-TSS区域。R-loop的形成与H3K4me3的异常沉积相关,且这种R-loop增加可以传递到后代中。通过RNH-1过表达或抑制转录延伸,可以减少R-loop的形成,并部分恢复线虫的生育能力。

图2:R-loop在饥饿的AMPK突变体生殖细胞中积累。
B. R-loop在AMPK突变体的生殖细胞中积累。代表性显微照片显示了饥饿的AMPK突变体和WT年轻成虫生殖细胞中的R-loop。thoc-2突变体的生殖细胞作为R-loop检测的阳性对照。WT和aak-1/2的L1幼虫饥饿3天后转移至营养充足的条件下。生殖细胞经固定后,用S9.6抗体(红色,标记R-loop)进行免疫染色,并用DAPI(蓝色)进行复染。图中框出的部分在下方以更高倍率显示(N=3,n=100)。星号(*)表示远端尖细胞;比例尺:5μm。右侧图:通过免疫荧光定量分析显示,饥饿的AMPK突变体生殖细胞中R-loop的总体丰度显著增加;n=100。
C. R-loop在AMPK突变体的原始生殖细胞(PGC)中形成,并在表达RNH-1后得以缓解。WT和aak-1/2的L1幼虫饥饿3天后,用S9.6抗体(绿色,标记R-loop)进行免疫染色,并用生殖细胞特异性标记物HIM-3同源物(HTP)-3(红色)进行复染。类似地,表达生殖细胞特异性RNH-1转基因(pie-1p::rnh-1)的饥饿突变体动物的R-loop水平与对照组相似。每种基因型的PGC中R-loop水平被定量并以图形显示。白色箭头表示PGC(注意饥饿的AMPK突变体有额外的PGC)。
D. R-loop在AMPK突变体中随着后代延续逐渐减少。通过免疫荧光使用S9.6抗体(红色,标记R-loop)和DAPI(蓝色)复染,检测P0(n=83)、F2(n=100)和F5(n=81)成虫生殖细胞核中的DNA-RNA杂合体。白色箭头表示R-loop(S9.6)焦点。P0(n=83)、F2(n=100)和F5(n=81)通过S9.6抗体进行免疫荧光分析。

图3. R-loop形成与H3K4me3异位沉积相关。
A. 基因组浏览器快照显示基因邻近区域和RNH轨迹的DRIP-seq信号。 绿色条表示R-loop peaks calling。轨迹高度代表reads数。B. 野生型(WT)与aak-1/2基因组的DRIP-seq output(peak分数和数量)的整体比较。
C. DRIP-qPCR验证。 收集了经过或未经DRB处理的饥饿的aak-1/2突变体的F2后代(饥饿3天)进行DRIP分析。选择tig-3作为阴性对照;n=3,均值±标准误(S.E.M.)。以input基因组DNA为基准进行信号值归一化并绘制。
D. 以所有R-loop peaks为中心的GC偏好Meta图。
E. 通过HOMER分析AMPK突变体与WT DRIP-seq鉴定的四个富集的de novo motif。
F. 上:注释和R-loop peaks定位分析,显示peaks比对到启动子-TSS、转录终止位点(TTS)、外显子、内含子和其他区域。在aak-1/2突变体中,peaks主要累积在启动子-TSS区域。
G. 下:WT或饥饿aak-1/2突变体F2后代DRIP-seq信号分布饼图,显示基因内与基因间区域分布。
H. 基因组浏览器快照显示饥饿的AMPK突变体F2后代中R-loop信号与H3K4me3水平正相关的代表性样本。
(3)RAD-51异常积累与DNA损伤:
AMPK缺失的线虫生殖细胞中,RAD-51焦点显著增加,且与R-loop共定位。这些异常的RAD-51焦点可能与R-loop引起的DNA损伤相关,导致生殖细胞的凋亡增加。在缺乏p53信号通路的线虫中,生殖细胞凋亡减少,但胚胎致死率增加,表明DNA损伤未被修复。

图4. 饥饿导致AMPK突变体中RAD-51异常聚集到与R-loop相关的位点。
B. 饥饿的AMPK突变体生殖细胞中RAD-51焦点异常增加。
C. RAD-51焦点的数量和出现时间在生殖细胞的六个区域中的定量分析:有丝分裂区、过渡区、早中期偶线期、中期偶线期、晚中期偶线期和双线期,n>5。
D. 代表性显微照片显示3天饥饿的L1幼虫原始生殖细胞(PGC)中的RAD-51焦点。
E. 免疫荧光显微照片显示饥饿的WT、aak-1/2突变体以及aak-1/2;pie-1p::rnh-1转基因线虫的年轻成虫生殖细胞晚中期偶线期区域中的RAD-51焦点。
F. 饥饿的AMPK突变体F2后代生殖细胞中异常丰富的RAD-51信号与R-loop重叠。上图:PLA信号以红色斑点表示。星号(*)表示远端尖细胞。下图:每条生殖腺中带有PLA焦点的细胞核的百分比定量分析。显示AMPK突变体生殖腺的单抗体对照;n=5。
G. 左图:饥饿的WT与AMPK突变体生殖腺中增加的细胞死亡依赖于DNA损伤。通过计数生殖腺臂中异常细胞死亡(CED)-1::GFP阳性细胞来定量凋亡小体。箱线图显示组内平均值、50%范围和最小到最大值,n=25。右图:去除cep-1信号通路会增加饥饿的WT与AMPK突变体生殖腺中的胚胎致死率。定量分析之前饥饿的指定基因型动物F2后代中的胚胎致死率。样本数量:WT,n=10;aak-1(tm1844) I,aak-2(ok524) X,n=10;aak-1(tm1844) I,aak-2(ok524)X;cep-1(gk138) I,n=20;cep-1(gk138) I,n=20。
(4)跨代遗传的生殖缺陷:
AMPK缺失导致的异常H3K4me3和R-loop的形成不仅影响当前代,还会传递到未经历饥饿的后代中,导致生殖缺陷逐渐加剧。这些表观遗传修饰和R-loop跨代传递可能通过生殖细胞中的“分子记忆”实现。

A. pie-1p::rad-51的多拷贝阵列可以部分恢复AMPK突变体在饥饿后的生殖能力。转基因L1幼虫在20°C下于M9缓冲液中维持72小时,随后恢复到营养充足条件下。在恢复后96小时评估生育百分比。
B. 模型展示了在急性饥饿期间发生的AMPK依赖性事件。AMPK限制了异常的H3K4me3沉积及其随后导致的转录,这种转录增加了R-loop的形成和基因组不稳定性。
易小结:
本研究揭示了AMPK在饥饿条件下通过调控H3K4me3沉积和R-loop形成来维持基因组稳定性和生殖细胞完整性的机制。AMPK缺失导致的异常表观遗传修饰和R-loop积累不仅影响当前代,还会跨代传递,导致生殖缺陷和基因组不稳定性。这些发现为理解环境应激与表观遗传修饰之间的关系提供了新的见解,并可能对人类生殖健康和癌症研究产生重要影响。
本研究的重要意义
- 表观遗传修饰与基因组稳定性:研究揭示了AMPK在维持基因组稳定性中的重要作用,特别是在饥饿等应激条件下。异常的H3K4me3沉积和R-loop的形成可能导致基因组不稳定性,这在人类疾病(如癌症)中也有类似机制。
- 跨代遗传的表观遗传效应:研究表明,饥饿引起的表观遗传修饰可以跨代传递,并导致生殖缺陷。这为理解环境因素对后代健康的影响提供了新的视角。
- DNA修复与生殖细胞完整性:RAD-51的异常积累和DNA损伤响应的失调可能影响生殖细胞的正常发育和功能,从而导致生殖缺陷。
ChIP-seq和DRIP-seq在本研究中的作用
DRIP-seq(DNA-RNA免疫沉淀测序)和ChIP-seq(染色质免疫沉淀测序)是两种关键的高通通量测序技术,分别用于研究R-loop的形成和组蛋白修饰的分布, DRIP-seq和ChIP-seq在本研究中共同揭示了AMPK缺失如何通过H3K4me3的异常沉积导致R-loop的形成,进而引发基因组不稳定性。
DRIP-seq专注于R-loop的全基因组分布及其与转录活性的关系,而ChIP-seq则专注于H3K4me3修饰的分布及其对转录调控的影响。
两种技术的结合为理解AMPK在维持基因组稳定性中的作用提供了全面的视角,并揭示了表观遗传修饰异常如何导致跨代生殖缺陷和基因组不稳定性。
参考文献:
Sun B, Sherrin M, Roy R. Unscheduled epigenetic modifications cause genome instability and sterility through aberrant R-loops following starvation. Nucleic Acids Res. 2023 Jan 11;51(1):84-98. pii: 6887602. doi: 10.1093/nar/gkac1155.
标签:
DNA甲基化





