微量WGBS应用:揭示卵巢早衰的人卵丘细胞DNA甲基化与表观基因组图谱
大家好,这里是专注表观组学十余年,领跑多组学科研服务的易基因。
早发性卵巢功能不全(Premature ovarian insufficiency,POI)(亦称卵巢早衰),是指女性在40岁之前卵巢功能下降,表现为促性腺激素水平升高和雌激素水平降低,甚至出现闭经。POI病因复杂,约76.5%的病例无法通过遗传变异解释,越来越多的研究表明,生理、心理和环境因素可能通过诱导表观遗传变化(如DNA甲基化和羟甲基化)来影响基因表达,进而导致POI。尽管已有研究关注单个基因的表观遗传变化对卵巢功能的调控,但目前缺乏对POI患者整体表观遗传特征的全面了解。
近日,西安交通大学基础医学院/西北妇女儿童医院生殖中心副主任医师施文浩博士为第一作者,西安交通大学基础医学院黄辰教授为通讯作者,以《Epigenomic Landscape of Human Cumulus Cells in Premature Ovarian Insufficiency Using Single-Base Resolution Methylome and Hydroxymethylome》为题在《Journal of Cellular and Molecular Medicine》期刊发表研究论文。研究通过单碱基分辨率的DNA甲基化组和DNA羟甲基化组分析,探讨了POI患者人卵丘细胞(cumulus cells)的表观基因组特征,并进一步揭示这些表观遗传修饰变化与POI相关基因、卵巢功能基因以及表观遗传时钟基因的相关性。

标题:Epigenomic Landscape of Human Cumulus Cells in Premature Ovarian Insufficiency Using Single-Base Resolution Methylome and Hydroxymethylome(使用单碱基分辨率甲基化组和羟甲基化组观察早发性卵巢功能不全中人卵丘细胞的表观基因组图谱)
发表时间:2024-12-20
发表期刊:Journal of Cellular and Molecular Medicine
影响因子: IF 5.3
技术平台:微量WGBS、ACE-seq、Target-BS、Smart-seq2
本研究通过整合甲基化、羟甲基化和转录组测序分析,揭示POI患者卵丘细胞的表观基因组特征,并探索其与卵巢功能的关系。研究结果显示,POI患者的甲基化和羟甲基化水平显著升高,全基因组范围内表现出显著高甲基化和高羟甲基化区域,其中Genebody(基因体)区域的甲基化水平与基因表达呈负相关,尤其是在启动子区域。随后作者通过实验验证了候选基因(EGR1、EGR2和DLX5)在卵巢类固醇激素合成中的作用。并进一步发现这些表观遗传修饰与POI相关基因、卵巢功能基因以及表观遗传时钟基因存在相关性。这一全面的表观遗传分析通过揭示DNA表观遗传修饰与卵巢功能之间复杂相互作用,为识别POI新型生物标志物和治疗靶点提供新方向。
研究方法
样本收集:
研究纳入在西北妇女儿童医院生殖中心接受体外受精(IVF)治疗的POI患者和对照组女性。POI患者年龄小于40岁,促卵泡生成素(FSH)水平高于20 mIU/mL,窦卵泡数少于5个,且既往有IVF失败史。对照组为首次接受IVF治疗、无POI的女性,因男性或输卵管因素不孕,且预后良好(≥10个卵母细胞和≥5个高质量第3天胚胎),年龄与POI组匹配。在IVF过程中,通过机械方法和透明质酸酶处理分离卵母细胞周围的卵丘细胞。
样本测序:
微量全基因组亚硫酸盐测序(WGBS):通过亚硫酸盐将未甲基化的胞嘧啶(C)转化为胸腺嘧啶(T),从而检测DNA甲基化。
APOBEC偶联表观遗传测序(ACE-Seq):一种无需亚硫酸盐的单碱基分辨率5-羟甲基胞嘧啶(5hmC)检测方法。
微量转录组测序(Smart-seq2):用于分析基因表达水平。
靶基因甲基化验证(Target-BS/AmpBS):验证靶基因的甲基化水平。
DNA甲基化年龄检测:
分析POI 致病基因、卵巢功能基因和表观遗传年龄时钟中的甲基化水平。
结果图形
(1)全基因组DNA甲基化(5mC)和DNA羟甲基化(5hmC)水平变化和分布
甲基化(5mC):POI组的CG、CHG和CHH位点的甲基化水平显著高于对照组,尤其是在基因启动子区域和genebody区域。
羟甲基化(5hmC):POI组的CpG位点的羟甲基化水平略高于对照组,而CHG和CHH位点的羟甲基化水平略低于对照组。整体上,POI组的羟甲基化水平在基因组重复元件、CpG岛、基因启动子和genebody区域显著增加。
研究共鉴定出23234个DMRs(其中15389个为高甲基化区域,7845个为低甲基化区域)和3058个DhMRs(1892个为高羟甲基化区域,1166个为低羟甲基化区域)。这些区域在基因组中广泛分布,且高甲基化/高羟甲基化区域显著多于低甲基化/低羟甲基化区域。

(B)CG/CHG/CHH的整体甲基化平均率。
(C)小提琴图展示了两组间全基因组甲基化水平的分布密度。
(D–F)在基因组重复元件(短散在核元件SINEs、长散在核元件LINEs、长末端重复序列LTRs、低复杂性序列、反转录转座子、Satellite和简单重复序列)中,人类基因组区域(CpG islands、CpG shelf 、CpG shore)以及转录起始位点上游2kb(up2k)、基因体(genebody)和转录终止位点下游2kb(down2k)的甲基化分布。
(G)差异甲基化区域(DMR)的数量,分为高甲基化(Hyper)和低甲基化(Hypo)类型。
(H)小提琴图用于展示每组中不同基因组区间内高甲基化和低甲基化DMR的分布密度。
(I-J)DMR在染色体和基因元件(3utr、5utr、外显子、基因间区、内含子、启动子)上的分布。
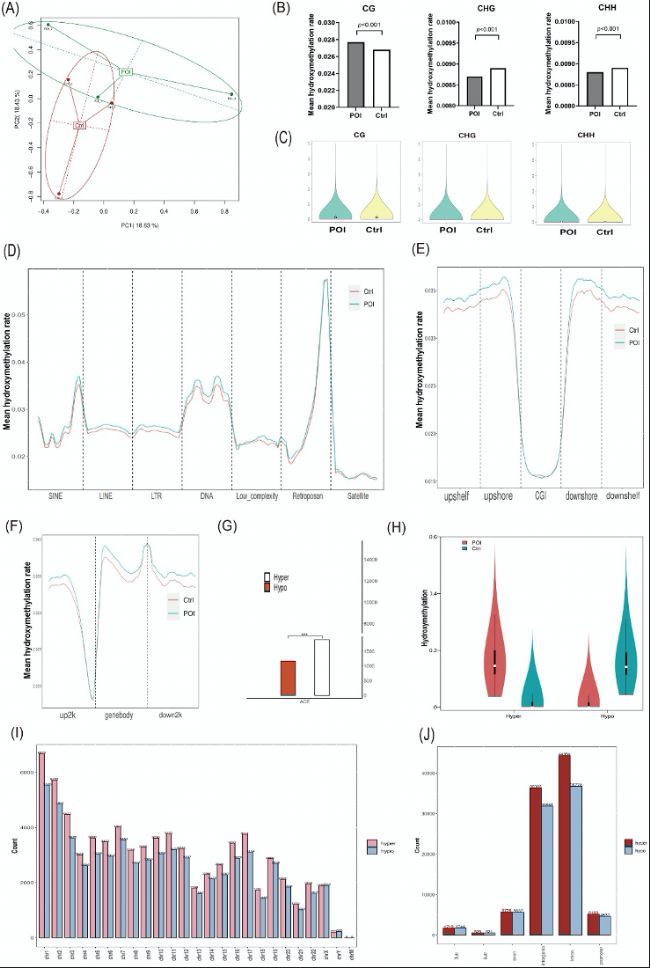
(A)主成分分析(PCA)反映了羟甲基化特征的主要特点。
(B)CG/CHG/CHH的整体羟甲基化平均率。
(C)小提琴图展示全基因组羟甲基化水平的分布密度。
(D–F)在基因组重复元件中,人类基因组区域以及转录起始位点上游2kb、genebody和转录终止位点下游20kb的羟甲基化分布。
(G)差异羟甲基化区域(DhMRs)的数量,分为高羟甲基化(Hyper)和低羟甲基化(Hypo)类型。
(H)小提琴图展示每组中不同基因组区间内高羟甲基化和低羟甲基化DhMR的分布密度。
(I-J)DhMR在染色体和基因元件上的分布。
(2)转录组RNA测序(Smart-seq2)数据分析
通过转录组RNA-Seq(Smart-seq2)分析,研究发现POI组与对照组之间有1257个差异表达基因(DEGs),其中628个上调,629个下调。GO和KEGG通路分析结果表明,POI组中与卵巢功能相关的基因表达显著下调,包括细胞周期、染色体分离和类固醇合成等关键过程。
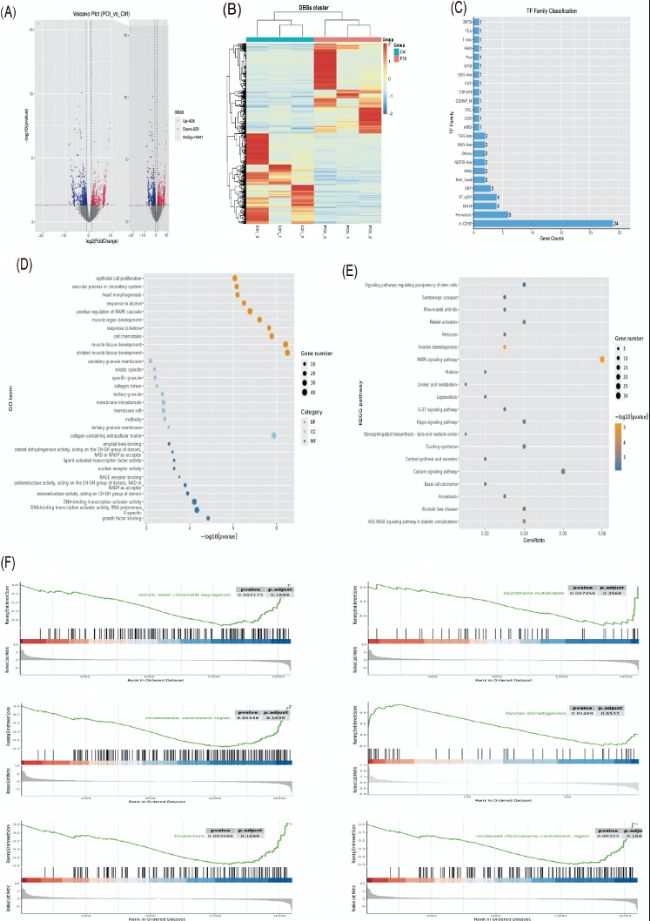
(B)所有组间差异表达基因的聚类热图分析。
(C)转录因子(TFs)家族分类。
(D-E)差异表达基因的GO和KEGG通路分析。
(F)基因集富集分析(GSEA)揭示前10通路中与卵巢相关的通路。
(3)候选基因的实验验证
研究进一步验证了几个关键基因(如EGR1、EGR2和DLX5)的甲基化水平、mRNA表达以及在卵巢类固醇激素合成中的作用。实验结果表明,这些基因的甲基化水平与基因表达呈负相关,并且它们可能参与调节卵巢类固醇激素合成。
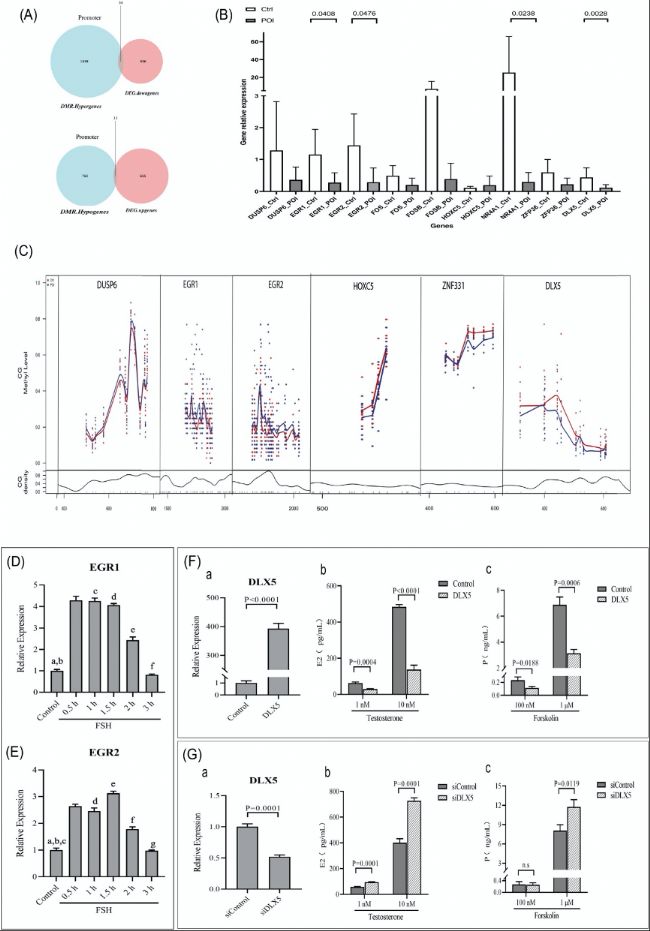
(B) 与 mRNA 转录组测序结果相比,9个 DEGs 表达的 RT-qPCR 验证。
(C) CG位点甲基化矩阵绘制甲基化水平变化曲线。X轴表示序列中的核苷酸位置;Y轴包含两个部分:上部显示每个CG位点的甲基化水平,用点标记并拟合曲线以显示趋势;下部显示CG位点的密度变化曲线。
(D) FSH处理对KGN细胞中EGR1表达的影响:(a) 对照组与FSH(0.5、1、1.5、2小时)组之间,p<0.0001;(b) 对照组与FSH(3小时)组之间,p=0.0093;(c) FSH(0.5小时)组与FSH(1小时)组之间,无显著差异;(d) FSH(1小时)组与FSH(1.5小时)组之间,无显著差异;(e) FSH(1.5小时)组与FSH(2小时)组之间,p<0.0001;(f) FSH(2小时)组与FSH(3小时)组之间,p<0.0001。
(E) FSH处理对KGN细胞中EGR2表达的影响:(a) 对照组与FSH(0.5、1、1.5小时)组之间,p<0.0001;
(b) 对照组与FSH(2小时)组之间,p=0.0002;(c) 对照组与FSH(3小时)组之间,无显著差异;(d) FSH(0.5小时)组与FSH(1小时)组之间,无显著差异;(e) FSH(1小时)组与FSH(1.5小时)组之间,p=0.0011;(f) FSH(1.5小时)组与FSH(2小时)组之间,p<0.0001;(g) FSH(2小时)组与FSH(3小时)组之间,p<0.0001。
(F) DLX5过表达对KGN细胞中雌二醇(Estradiol,E2)和孕酮(Progesterone,P)合成的影响:(a) 通过RT-PCR验证KGN细胞中DLX5的过表达;(b) 在睾酮处理后,DLX5过表达的KGN细胞培养基中的雌二醇(E2)水平;(c) 在佛手柑处理后,DLX5过表达的KGN细胞培养基中的孕酮水平。
(G) DLX5敲低对KGN细胞中雌二醇和孕酮合成的影响:(a) 通过RT-PCR验证KGN细胞中DLX5的敲低;(b) 在睾酮处理后,DLX5敲低的KGN细胞培养基中的雌二醇水平;(c) 在forskolin处理后,DLX5敲低的KGN细胞培养基中的孕酮水平。
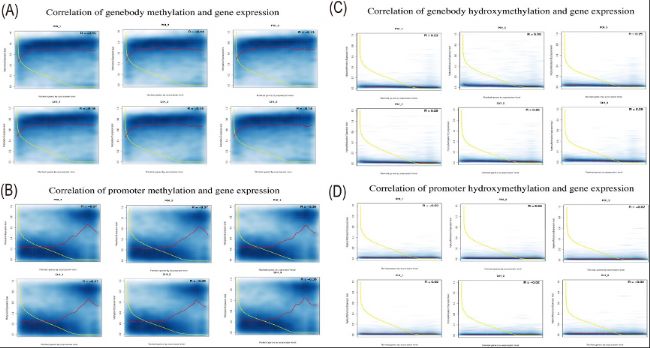
(4)DNA甲基化/羟甲基化水平与基因表达的关系
研究发现,genebody甲基化水平与基因表达呈负相关,而启动子区域的甲基化则表现出双峰分布,低甲基化水平对应高表达,高甲基化水平对应低表达。然而,羟甲基化水平与基因表达之间未发现明显相关性。
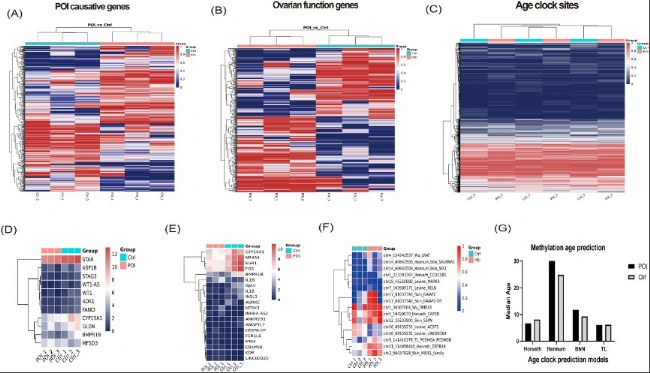
(5)甲基化与POI相关基因、卵巢功能基因和表观遗传时钟
研究还分析了POI相关基因、卵巢功能基因以及表观遗传时钟CpG位点的甲基化差异。结果显示,POI组在多个关键基因的甲基化水平上与对照组存在显著差异,且这些基因的转录组表达水平也发生了显著变化。此外,通过四种表观遗传年龄预测模型分析,POI组的表观遗传年龄可能高于对照组。
易小结
本研究首次在单碱基水平上分析了POI患者卵泡膜细胞的DNA甲基化和羟甲基化特征,揭示了POI患者基因组中广泛的高甲基化和高羟甲基化现象。这些表观遗传修饰可能通过影响基因表达,进而影响卵巢功能。研究结果为识别POI的潜在生物标志物和治疗靶点提供了新的线索,并强调了表观遗传修饰在POI发病机制中的潜在作用。
在本研究中,全基因组亚硫酸盐测序(WGBS)和APOBEC偶联表观遗传测序(ACE-seq)是两种关键的测序技术,分别用于分析DNA甲基化和羟甲基化,它们在揭示POI的表观遗传机制中发挥了重要作用。
WGBS(全基因组亚硫酸盐测序)
在本研究中,WGBS用于比较POI患者和对照组卵丘细胞细胞的全基因组甲基化水平。研究发现,POI患者的基因组整体甲基化水平显著升高,尤其是在基因启动子区域和genebody区域。这种高甲基化状态可能抑制基因表达,进而影响卵巢功能。
此外,研究者通过WGBS鉴定出大量DMRs,这些区域在POI患者中表现出高甲基化或低甲基化。这些DMRs的鉴定为理解POI的表观遗传机制提供了重要线索。
ACE-seq(APOBEC偶联表观遗传测序)
与甲基化类似,羟甲基化也在基因调控中发挥重要作用。在本研究中,ACE-seq在单碱基分辨率下揭示了POI患者基因组中羟甲基化的整体变化,尤其是在基因组重复元件、CpG岛和基因启动子区域。研究发现,POI患者的羟甲基化水平在某些区域显著升高,可能与基因表达的调控有关。
此外,研究者通过ACE-seq鉴定出DhMRs,这些区域在POI患者中表现出高羟甲基化或低羟甲基化。进一步丰富了对POI表观遗传机制的理解。
WGBS和ACE-seq的协同作用
WGBS和ACE-seq的结合使用允许研究者同时分析DNA甲基化和羟甲基化,揭示这两种表观遗传修饰在基因调控中的协同作用。如研究发现基因体的高甲基化与基因表达的抑制呈负相关,而羟甲基化的变化则可能与基因表达的激活或抑制有关。
通过整合这两种技术的数据,研究者构建出POI患者卵丘细胞的全面表观遗传图谱。不仅揭示了POI的潜在致病机制,还为开发新的生物标志物和治疗靶点提供了重要的基础。
此外,结合WGBS和ACE-seq和RNA-seq的数据,研究者能够进一步分析甲基化和羟甲基化与基因表达之间的关系。如研究发现某些基因的启动子区域高甲基化与基因表达的下调密切相关,而genebody高甲基化也与基因表达抑制有关。
参考文献:
Shi W, Wang D, Xue X, Qiao S, Zhang W, Shi J, Huang C. Epigenomic Landscape of Human Cumulus Cells in Premature Ovarian Insufficiency Using Single-Base Resolution Methylome and Hydroxymethylome. J Cell Mol Med. 2024 Dec;28(24):e70284. doi: 10.1111/jcmm.70284.





