mRNA m5C修饰的鉴定、效应分子、分子机制及其生理病理功能深度综述
5-甲基胞嘧啶(m5C)是一种在转运RNA(tRNA)和核糖体RNA(rRNA)中广泛存在的核酸修饰,同时也在转录组中广泛分布,是真核生物信使RNA(mRNA)的内部修饰之一。越来越多的证据证实了m5C在mRNA中的存在。随着检测技术的进步,尤其是亚硫酸盐测序(bisulfite sequencing)的应用,m5C修饰在转录组中的分布和功能逐渐被揭示,人们对其在mRNA中的分子机制和生物学意义有了一定的初步认识。本文旨在全面总结m5C在mRNA中的鉴定与筛选、分布、分子功能和生物学功能的最新研究进展,并概述当前研究现状,展望其未来潜在应用前景。
m5C修饰的鉴定和分布
m5C修饰已在多种RNA种类中被鉴定,包括核糖体RNA(rRNA)、转运RNA(tRNA)、信使RNA(mRNA)、增强子RNA(eRNA),并且最近还在长非编码RNA(lncRNA)、环状RNA(circRNA)和微小RNA(miRNA)中检测到m5C修饰。m5C修饰的研究最初集中在tRNA和rRNA上,而对mRNA的研究则相对滞后。然而近年来,用于检测m5C修饰的高通量技术发展迅速,例如亚硫酸盐测序(BS-seq)、5-氮杂胞苷交联测序(Aza-IP)或单核苷酸分辨率交联免疫沉淀测序(miCLIP-seq)。特别是超快速亚硫酸氢盐测序(UBS-seq)和m5C-TAC-seq等新技术的出现,进一步提高了检测的效率和准确性。由于上述高通量测序技术的进步,现在可以确定细胞RNA中m5C的整体分布情况。与DNA不同,mRNA m5C修饰相对较少,且由于其低丰度和高背景噪声,对转录组范围内的m5C图谱进行绘制在技术上具有挑战性。
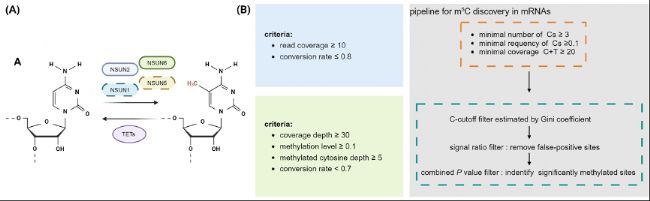
B. 不同的RNA亚硫酸盐测序分析流程用于鉴定mRNA中的m5C位点。Cs:未甲基化的胞嘧啶。
通过利用RNA亚硫酸盐转化与基于SOLiD技术的全转录组RNA测序相结合,首次以单碱基分辨率获得了转录组中胞嘧啶修饰的高分辨率视图。采用预定义的选择标准,在mRNA序列中鉴定出8495个新的候选m5C位点,显示出m5C在mRNA非翻译区(UTR)和近Argonaute蛋白结合区域富集。
随后,BS-seq转向利用Illumina技术,并已在多种生物和条件下应用,不同研究采用不同的选择标准来筛选潜在的m5C候选位点。其中一项研究利用BS-seq在人类HeLa细胞和多种小鼠组织中绘制了转录组范围内的m5C图谱,鉴定出1955个mRNA上的5065个m5C位点,揭示了mRNA m5C位点的中位甲基化水平约为20.5%,与mRNA假尿苷化程度相似。在这些位点的分布特征方面,m5C修饰主要位于编码序列(CDS)中,主要在CG环境中,以及mRNA翻译起始位点的下游区域。在小鼠组织样本的m5C测序中,观察到它们显示出与小鼠和人类HeLa细胞中发现的中位甲基化水平和m5C分布模式相似的结果。这些发现表明,在哺乳动物细胞mRNA中,m5C的分布模式具有高度的保守性。进一步的研究揭示了不同小鼠组织和睾丸发育过程中m5C修饰的分布,表明了哺乳动物转录组中m5C修饰的保守性、组织特异性和动态特征。
另一项研究关注了小鼠胚胎干细胞(ESCs)和大脑中总和核poly(A) RNA的表观转录组中胞嘧啶甲基化的全面图谱,观察到m5C位点在翻译起始密码子附近(如5'UTR末端和CDS起始处)有显著积累,在编码序列中耗竭,并在3'UTR中有混合的富集模式。通过比较ESCs和大脑组织中的甲基化位点,发现ESCs中有57%的甲基化位点在大脑组织中未甲基化。此外,这些差异甲基化通常不由差异表达引起,表明mRNA中的胞嘧啶甲基化可能以高度细胞和组织特异性的方式发生,与转录表达水平无关。
然而,不同研究中估计的mRNA m5C位点数量差异很大,观察结果不一致,难以定义一组通用的mRNA底物或常见的甲基化目标序列。随后,mRNA中m5C的研究转向了更严格的位点鉴定。Rui Zhang等人开发了一种计算流程,以准确识别mRNA m5C位点,涵盖了与转化效率、覆盖率和截止标准相关的标准。随后,多个研究采用了这一工作流程。
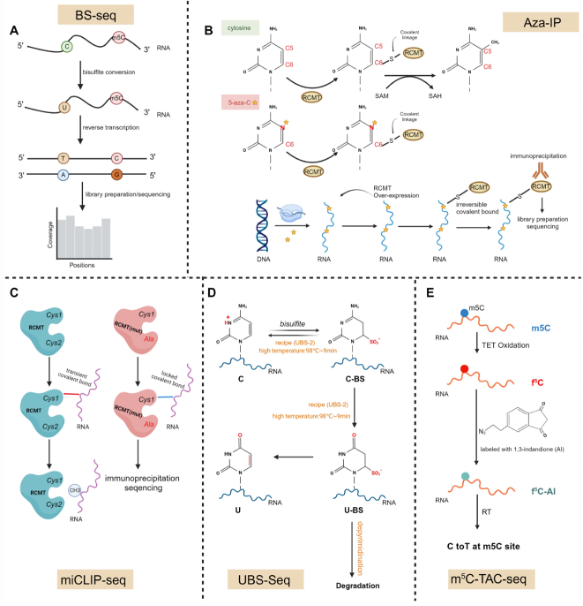
图2:m5C的全转录组测序方法示意图。
A. 在RNA BS-seq中,亚硫酸盐处理将未修饰的胞嘧啶脱氨基为尿嘧啶,而甲基化的胞嘧啶则保持不变。
B. 5-氮杂胞苷(5-aza-C)是一种胞嘧啶类似物,在转录过程中,RNA聚合酶会随机将其掺入到初生(nascent )RNA转录本的胞嘧啶位点。在m5C-RCMT催化结构域中,半胱氨酸残基的硫原子与目标RNA碱基的C6位置形成共价键。随后,通过甲基供体S-腺苷甲硫氨酸(SAM)的作用,目标胞嘧啶的C5位置发生甲基化。在C5甲基化后,通过后续的β-消除反应断裂共价键,从而恢复自由酶。由于5-氮杂胞苷中C5位置的碳原子被氮原子(N)取代,共价键得以稳定,最终导致细胞内内源性酶的耗竭,从而使RNA和DNA的甲基化水平降低。
C. 在甲基化过程中,保守的半胱氨酸残基Cys1暂时与甲基化胞嘧啶形成共价键,而第二个半胱氨酸Cys2对于这种催化中间体的分解至关重要。在miCLIP中,Cys2突变为丙氨酸(Ala),便于捕获催化中间体,并允许甲基转移酶与内源性RNA靶标发生交联,而无需光交联。最终,这些交联的表位标记的酶-底物复合体得以形成。
D. 从机制上讲,BS-seq中存在两条竞争性途径:一条实现从C到U的期望转化,另一条则导致不期望的DNA/RNA降解。超快速BS测序方法(UBS-seq)使用高浓度亚硫酸盐(约10M)和98°C的高反应温度,通过缩短反应时间来减少RNA降解,并提高反应温度以实现完全的C到U转化。
E. 在m5C-TAC-seq中,m5C被氧化为f5C,随后用1,3-茚二酮(AI)的叠氮衍生物进行标记。这一过程通过生物素拉下来富集含有m5C的RNA,并在m5C位点诱导C到T的转化。
总之研究表明,m5C修饰在mRNA中的分布具有一定的规律性。它主要集中在编码序列(CDS)区域,尤其是在mRNA翻译起始位点附近的区域。此外,m5C修饰在不同组织和细胞类型中表现出保守性、组织特异性和动态性。例如,在小鼠和人类细胞中,m5C修饰的分布模式高度保守。
m5C修饰的效应分子
m5C修饰是一个动态的过程,涉及三种主要的调控效应分子:甲基转移酶(“writers”)、去甲基化酶(“erasers”)和结合蛋白(“readers”)。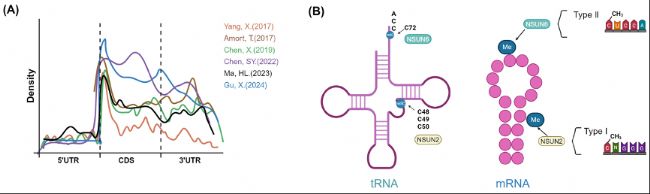
B. NSUN2和NSUN6在tRNA和mRNA上偏好的修饰位点示意图。NSUN2靶向甲基化人类中绝大多数tRNA的特定位点(C48、C49和C50)。NSUN6特异性地靶向带有UCCA尾的tRNAThr和tRNACys的3'端C72位点。NSUN2依赖的位点倾向于包含m5CNGG motif,并且位于5'端。NSUN6主要催化II型m5C位点(m5CTCCA motif),其甲基化位点优先富集在hairpin loops结构中心。
m5C修饰在mRNA中的分子功能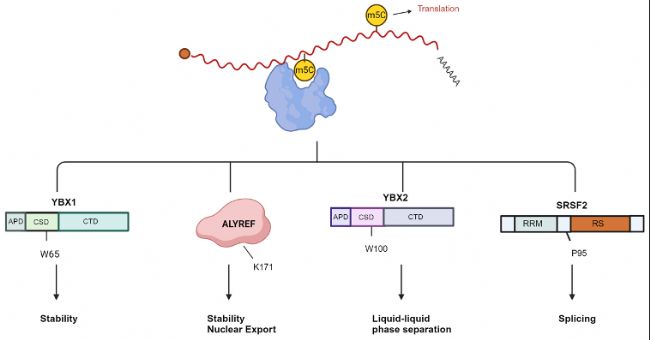 图4:mRNA中m5C相关识别蛋白。mRNA上的m5C对翻译调控有显著贡献。YBX1增强mRNA的稳定性,其中YBX1冷休克结构域(CSD)中的W65是识别m5C核苷酸的关键残基。ALYREF识别m5C修饰以促进mRNA出核;K171残基与含有m5C的寡核苷酸结合。RNA上的m5C增强YBX2的液-液相分离,其中W100是识别m5C的关键残基。SRSF2结合m5C标记并通过其“reader”功能调节NSUN2介导m5C的可变剪切效应。P95H突变降低SRSF2对RNA m5C的结合亲和力。
图4:mRNA中m5C相关识别蛋白。mRNA上的m5C对翻译调控有显著贡献。YBX1增强mRNA的稳定性,其中YBX1冷休克结构域(CSD)中的W65是识别m5C核苷酸的关键残基。ALYREF识别m5C修饰以促进mRNA出核;K171残基与含有m5C的寡核苷酸结合。RNA上的m5C增强YBX2的液-液相分离,其中W100是识别m5C的关键残基。SRSF2结合m5C标记并通过其“reader”功能调节NSUN2介导m5C的可变剪切效应。P95H突变降低SRSF2对RNA m5C的结合亲和力。
m5C修饰的生物学功能和病理功能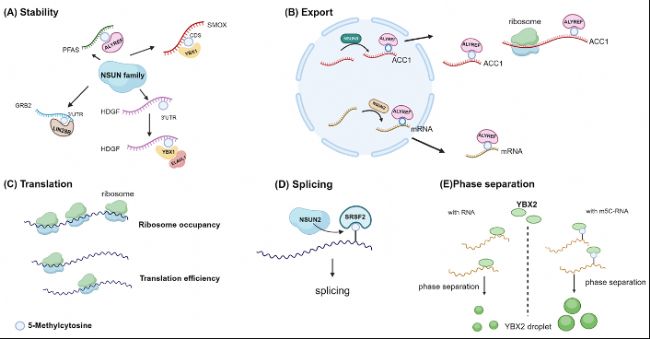
B. ALYREF介导出核。
C. m5C可能通过某种未知的中间介质调控翻译效率和核糖体占有率。
D. SRSF2优先结合m5C-mRNA。NSUN2缺失会降低mRNA的m5C水平,并改变SRSF2的RNA结合和剪切。
E. RNA上的m5C调节依赖于YBX2的液-液相分离。
研究挑战和未来展望
技术挑战:
m5C修饰的检测技术仍面临一些挑战,如亚硫酸盐测序的不完全转化和RNA降解问题。需要开发更精确、更灵敏的检测技术,以实现对m5C修饰的全面和准确检测。
临床应用:
目前关于m5C修饰在疾病诊断、预后分析和治疗效果评估中的研究还处于初级阶段。需要进一步探索m5C修饰在疾病中的应用价值,开发相关的诊断和治疗方法。
未来展望:
随着新技术的不断涌现,如超快速亚硫酸盐测序、m5C-TAC-seq等,m5C修饰的研究将不断深入。此外,对m5C修饰的分子功能、发育动态、进化意义等方面的研究也将进一步揭示其在生物体中的重要作用。
易小结:
本文全面总结了mRNA上m5C修饰的最新研究进展,包括其鉴定方法、分布特征、分子功能以及在生理和病理过程中的作用。文章强调了m5C修饰在多种生物学过程中的重要性,并指出了当前研究中存在的挑战和未来的研究方向。随着技术的不断进步和研究的深入,m5C修饰有望成为疾病诊断和治疗的新靶点。
RNA-BS-seq(RNA亚硫酸盐测序)在m5C修饰检测中发挥着重要作用
A. 确认m5C修饰的存在
在RNA-BS-seq技术出现之前,由于检测方法的限制,研究人员无法精确验证mRNA中是否存在m5C修饰。早期的研究主要集中在tRNA和rRNA中的m5C修饰,而对mRNA中的m5C修饰知之甚少。而RNA-BS-seq通过亚硫酸盐处理将未修饰的胞嘧啶(C)转化为尿嘧啶(U),而甲基化的胞嘧啶(m5C)则保持不变。这种技术首次在转录组水平上确认了m5C修饰的存在,并且能够以单碱基分辨率进行检测。
B. 绘制m5C修饰的全转录组图谱
RNA-BS-seq结合高通量测序技术,能够对细胞中的RNA进行整体分析,从而绘制出m5C修饰的全转录组图谱。这使得研究人员能够系统地了解m5C修饰在不同RNA种类(如mRNA、tRNA、rRNA等)中的分布情况。且该技术被应用于多种生物和组织条件,例如人类HeLa细胞和多种小鼠组织,通过这些研究,发现了m5C修饰在不同物种和组织中的保守性、组织特异性和动态性特征。
C. 揭示m5C修饰的分布特征
RNA-BS-seq技术揭示了m5C修饰在mRNA中的分布特征。例如,m5C修饰主要集中在编码序列(CDS)区域,尤其是在mRNA翻译起始位点附近的区域。此外,m5C修饰在非翻译区(UTR)中也有分布,尤其是在5'UTR和3'UTR区域。尽管RNA-BS-seq技术提供了高分辨率的m5C修饰图谱,但不同研究之间仍存在差异。例如,不同研究中鉴定出的m5C位点数量和分布模式可能不同,这表明m5C修饰的分布可能受到多种因素的影响,如物种、细胞类型、发育阶段和RNA结构等。
D. 推动m5C修饰功能研究
RNA-BS-seq技术为研究m5C修饰的分子功能提供了基础。通过鉴定m5C修饰位点,研究人员能够进一步研究这些位点对mRNA稳定性、出核、翻译效率等生物学过程的影响。同时,RNA-BS-seq技术还为研究m5C修饰在疾病中的作用提供了重要工具。例如,在癌症、神经发育障碍和病毒感染等疾病中,m5C修饰的异常可能与疾病的发病机制密切相关。通过RNA-BS-seq技术,研究人员能够鉴定与疾病相关的m5C修饰位点,从而为疾病的诊断和治疗提供潜在的靶点。
E. 技术改进和优化
为了克服传统BS-seq技术的局限性,如反应时间长、RNA降解等,研究人员开发了超快速BS-seq技术。UBS-seq通过使用高浓度亚硫酸盐和高温反应条件,缩短了反应时间,减少了RNA降解,并提高了C到U的转化效率。
总之,RNA-BS-seq技术在本文中发挥了重要作用,不仅确认了m5C修饰的存在,还绘制了m5C修饰的全转录组图谱,揭示了其分布特征,并推动了m5C修饰在分子功能和疾病相关研究中的应用。随着技术的不断改进和优化,RNA-BS-seq技术将继续为m5C修饰的研究提供强有力的支持。
参考文献:
Wang R, Ding L, Lin Y, Luo W, Xu Z, Li W, Lu Y, Zhu Z, Lu Z, Li F, Mao X, Xia L, Li G. The Quiet Giant: Identification, Effectors, Molecular Mechanism, Physiological and Pathological Function in mRNA 5-methylcytosine Modification. Int J Biol Sci 2024; 20(15):6241-6254. doi:10.7150/ijbs.101337. https://www.ijbs.com/v20p6241.htm
m5C修饰的鉴定和分布
m5C修饰已在多种RNA种类中被鉴定,包括核糖体RNA(rRNA)、转运RNA(tRNA)、信使RNA(mRNA)、增强子RNA(eRNA),并且最近还在长非编码RNA(lncRNA)、环状RNA(circRNA)和微小RNA(miRNA)中检测到m5C修饰。m5C修饰的研究最初集中在tRNA和rRNA上,而对mRNA的研究则相对滞后。然而近年来,用于检测m5C修饰的高通量技术发展迅速,例如亚硫酸盐测序(BS-seq)、5-氮杂胞苷交联测序(Aza-IP)或单核苷酸分辨率交联免疫沉淀测序(miCLIP-seq)。特别是超快速亚硫酸氢盐测序(UBS-seq)和m5C-TAC-seq等新技术的出现,进一步提高了检测的效率和准确性。由于上述高通量测序技术的进步,现在可以确定细胞RNA中m5C的整体分布情况。与DNA不同,mRNA m5C修饰相对较少,且由于其低丰度和高背景噪声,对转录组范围内的m5C图谱进行绘制在技术上具有挑战性。

图1:mRNA中m5C的动态调控过程及RNA亚硫酸盐测序分析流程。
A. m5C及其相关调控因子的动态过程。NSUN1、NSUN2、NSUN5和NSUN6作为mRNA上m5C甲基化的催化酶,而TET家族中的去甲基化酶则负责m5C去甲基化。B. 不同的RNA亚硫酸盐测序分析流程用于鉴定mRNA中的m5C位点。Cs:未甲基化的胞嘧啶。
通过利用RNA亚硫酸盐转化与基于SOLiD技术的全转录组RNA测序相结合,首次以单碱基分辨率获得了转录组中胞嘧啶修饰的高分辨率视图。采用预定义的选择标准,在mRNA序列中鉴定出8495个新的候选m5C位点,显示出m5C在mRNA非翻译区(UTR)和近Argonaute蛋白结合区域富集。
随后,BS-seq转向利用Illumina技术,并已在多种生物和条件下应用,不同研究采用不同的选择标准来筛选潜在的m5C候选位点。其中一项研究利用BS-seq在人类HeLa细胞和多种小鼠组织中绘制了转录组范围内的m5C图谱,鉴定出1955个mRNA上的5065个m5C位点,揭示了mRNA m5C位点的中位甲基化水平约为20.5%,与mRNA假尿苷化程度相似。在这些位点的分布特征方面,m5C修饰主要位于编码序列(CDS)中,主要在CG环境中,以及mRNA翻译起始位点的下游区域。在小鼠组织样本的m5C测序中,观察到它们显示出与小鼠和人类HeLa细胞中发现的中位甲基化水平和m5C分布模式相似的结果。这些发现表明,在哺乳动物细胞mRNA中,m5C的分布模式具有高度的保守性。进一步的研究揭示了不同小鼠组织和睾丸发育过程中m5C修饰的分布,表明了哺乳动物转录组中m5C修饰的保守性、组织特异性和动态特征。
另一项研究关注了小鼠胚胎干细胞(ESCs)和大脑中总和核poly(A) RNA的表观转录组中胞嘧啶甲基化的全面图谱,观察到m5C位点在翻译起始密码子附近(如5'UTR末端和CDS起始处)有显著积累,在编码序列中耗竭,并在3'UTR中有混合的富集模式。通过比较ESCs和大脑组织中的甲基化位点,发现ESCs中有57%的甲基化位点在大脑组织中未甲基化。此外,这些差异甲基化通常不由差异表达引起,表明mRNA中的胞嘧啶甲基化可能以高度细胞和组织特异性的方式发生,与转录表达水平无关。
然而,不同研究中估计的mRNA m5C位点数量差异很大,观察结果不一致,难以定义一组通用的mRNA底物或常见的甲基化目标序列。随后,mRNA中m5C的研究转向了更严格的位点鉴定。Rui Zhang等人开发了一种计算流程,以准确识别mRNA m5C位点,涵盖了与转化效率、覆盖率和截止标准相关的标准。随后,多个研究采用了这一工作流程。

图2:m5C的全转录组测序方法示意图。
B. 5-氮杂胞苷(5-aza-C)是一种胞嘧啶类似物,在转录过程中,RNA聚合酶会随机将其掺入到初生(nascent )RNA转录本的胞嘧啶位点。在m5C-RCMT催化结构域中,半胱氨酸残基的硫原子与目标RNA碱基的C6位置形成共价键。随后,通过甲基供体S-腺苷甲硫氨酸(SAM)的作用,目标胞嘧啶的C5位置发生甲基化。在C5甲基化后,通过后续的β-消除反应断裂共价键,从而恢复自由酶。由于5-氮杂胞苷中C5位置的碳原子被氮原子(N)取代,共价键得以稳定,最终导致细胞内内源性酶的耗竭,从而使RNA和DNA的甲基化水平降低。
C. 在甲基化过程中,保守的半胱氨酸残基Cys1暂时与甲基化胞嘧啶形成共价键,而第二个半胱氨酸Cys2对于这种催化中间体的分解至关重要。在miCLIP中,Cys2突变为丙氨酸(Ala),便于捕获催化中间体,并允许甲基转移酶与内源性RNA靶标发生交联,而无需光交联。最终,这些交联的表位标记的酶-底物复合体得以形成。
D. 从机制上讲,BS-seq中存在两条竞争性途径:一条实现从C到U的期望转化,另一条则导致不期望的DNA/RNA降解。超快速BS测序方法(UBS-seq)使用高浓度亚硫酸盐(约10M)和98°C的高反应温度,通过缩短反应时间来减少RNA降解,并提高反应温度以实现完全的C到U转化。
E. 在m5C-TAC-seq中,m5C被氧化为f5C,随后用1,3-茚二酮(AI)的叠氮衍生物进行标记。这一过程通过生物素拉下来富集含有m5C的RNA,并在m5C位点诱导C到T的转化。
总之研究表明,m5C修饰在mRNA中的分布具有一定的规律性。它主要集中在编码序列(CDS)区域,尤其是在mRNA翻译起始位点附近的区域。此外,m5C修饰在不同组织和细胞类型中表现出保守性、组织特异性和动态性。例如,在小鼠和人类细胞中,m5C修饰的分布模式高度保守。
m5C修饰的效应分子
m5C修饰是一个动态的过程,涉及三种主要的调控效应分子:甲基转移酶(“writers”)、去甲基化酶(“erasers”)和结合蛋白(“readers”)。
- 甲基转移酶:m5C修饰主要由NOL1/NOP2/SUN结构域(NSUN)家族蛋白(NSUN1-7)和DNA甲基转移酶(DNMT)家族成员催化。其中,NSUN2和NSUN6是mRNA m5C修饰的主要甲基转移酶。
- 去甲基化酶:关于mRNA上m5C修饰的去甲基化酶研究较少,但有研究表明TET家族蛋白可能参与m5C的擦除。
- 结合蛋白:目前已知的mRNA m5C修饰的结合蛋白包括Aly/REF出口因子(ALYREF)和Y盒结合蛋白1(YBX1)。这些蛋白能够识别并结合m5C修饰的mRNA,从而影响mRNA的稳定性和核质运输。

图3:mRNA中m5C修饰的分布格局及NSUN2和NSUN6对m5C位点的偏好。
A. 来自不同研究的Metagene图显示了m5C位点的分布情况。B. NSUN2和NSUN6在tRNA和mRNA上偏好的修饰位点示意图。NSUN2靶向甲基化人类中绝大多数tRNA的特定位点(C48、C49和C50)。NSUN6特异性地靶向带有UCCA尾的tRNAThr和tRNACys的3'端C72位点。NSUN2依赖的位点倾向于包含m5CNGG motif,并且位于5'端。NSUN6主要催化II型m5C位点(m5CTCCA motif),其甲基化位点优先富集在hairpin loops结构中心。
m5C修饰在mRNA中的分子功能
- 稳定性:m5C修饰能够影响mRNA的稳定性。例如,NSUN2通过m5C修饰增强SLC7A11 mRNA的稳定性,从而赋予子宫内膜癌细胞对铁死亡的抗性。此外,YBX1和ALYREF等蛋白通过识别m5C修饰的mRNA,进一步增强了mRNA的稳定性。
- 出核:ALYREF能够识别m5C修饰的mRNA,并促进其从细胞核到细胞质的转运。例如,ALYREF通过识别NSUN5介导的ACC1 mRNA上的m5C修饰,促进其出核。
- 翻译:m5C修饰对翻译的影响较为复杂。一方面,m5C修饰可能通过影响mRNA的核质分布来间接影响翻译效率;另一方面,m5C修饰可能直接调节翻译过程。例如,NSUN6介导的m5C修饰可能参与翻译终止的质控。
- 其他:除了上述两种经典的m5C识别蛋白外,通过多项研究还发现了新的m5C结合蛋白。如SRSF2、YBX1、YBX2。

m5C修饰的生物学功能和病理功能
- 胚胎发育:m5C修饰在胚胎发育过程中起着重要作用。例如,在斑马鱼中,m5C修饰能够保护母源mRNA的稳定性,从而促进母源-合子转换(MZT)。
- 代谢和炎症:m5C修饰与代谢和炎症过程密切相关。例如,NSUN2能够通过m5C修饰激活抗氧化应激反应,抑制心肌损伤。
- 免疫:m5C修饰与免疫响应密切相关。例如,NSUN2与RoRγt耦合,通过m5C修饰调节特定细胞因子mRNA的转录,从而影响Th17细胞的命运。
- 病毒感染:m5C修饰在病毒感染中也发挥重要作用。例如,在SARS-CoV-2感染过程中,NSUN2的表达水平下降,从而增强抗病毒反应。
- 遗传病:m5C修饰与多种遗传病发生发展有关。例如,NSUN2和NSUN6的突变与智力障碍等遗传病有关。
- 癌症:许多调控m5C修饰的mRNA m5C效应分子已被确定参与癌症发生发展。具体来说,m5C修饰通过调节mRNA的稳定性、剪切、表达和翻译,参与肿瘤的发生、发展和转移。m5C在多种癌症(如膀胱癌、食管癌、结直肠癌、胶质瘤等)中调控细胞增殖、转移、肿瘤形成、分化、耐药性、铁死亡和微环境。

图5:不同研究中mRNA上m5C甲基化的多样化生物学功能。
A. m5C促进mRNA稳定性。B. ALYREF介导出核。
C. m5C可能通过某种未知的中间介质调控翻译效率和核糖体占有率。
D. SRSF2优先结合m5C-mRNA。NSUN2缺失会降低mRNA的m5C水平,并改变SRSF2的RNA结合和剪切。
E. RNA上的m5C调节依赖于YBX2的液-液相分离。
研究挑战和未来展望
技术挑战:
m5C修饰的检测技术仍面临一些挑战,如亚硫酸盐测序的不完全转化和RNA降解问题。需要开发更精确、更灵敏的检测技术,以实现对m5C修饰的全面和准确检测。
临床应用:
目前关于m5C修饰在疾病诊断、预后分析和治疗效果评估中的研究还处于初级阶段。需要进一步探索m5C修饰在疾病中的应用价值,开发相关的诊断和治疗方法。
未来展望:
随着新技术的不断涌现,如超快速亚硫酸盐测序、m5C-TAC-seq等,m5C修饰的研究将不断深入。此外,对m5C修饰的分子功能、发育动态、进化意义等方面的研究也将进一步揭示其在生物体中的重要作用。
易小结:
本文全面总结了mRNA上m5C修饰的最新研究进展,包括其鉴定方法、分布特征、分子功能以及在生理和病理过程中的作用。文章强调了m5C修饰在多种生物学过程中的重要性,并指出了当前研究中存在的挑战和未来的研究方向。随着技术的不断进步和研究的深入,m5C修饰有望成为疾病诊断和治疗的新靶点。
RNA-BS-seq(RNA亚硫酸盐测序)在m5C修饰检测中发挥着重要作用
A. 确认m5C修饰的存在
在RNA-BS-seq技术出现之前,由于检测方法的限制,研究人员无法精确验证mRNA中是否存在m5C修饰。早期的研究主要集中在tRNA和rRNA中的m5C修饰,而对mRNA中的m5C修饰知之甚少。而RNA-BS-seq通过亚硫酸盐处理将未修饰的胞嘧啶(C)转化为尿嘧啶(U),而甲基化的胞嘧啶(m5C)则保持不变。这种技术首次在转录组水平上确认了m5C修饰的存在,并且能够以单碱基分辨率进行检测。
B. 绘制m5C修饰的全转录组图谱
RNA-BS-seq结合高通量测序技术,能够对细胞中的RNA进行整体分析,从而绘制出m5C修饰的全转录组图谱。这使得研究人员能够系统地了解m5C修饰在不同RNA种类(如mRNA、tRNA、rRNA等)中的分布情况。且该技术被应用于多种生物和组织条件,例如人类HeLa细胞和多种小鼠组织,通过这些研究,发现了m5C修饰在不同物种和组织中的保守性、组织特异性和动态性特征。
C. 揭示m5C修饰的分布特征
RNA-BS-seq技术揭示了m5C修饰在mRNA中的分布特征。例如,m5C修饰主要集中在编码序列(CDS)区域,尤其是在mRNA翻译起始位点附近的区域。此外,m5C修饰在非翻译区(UTR)中也有分布,尤其是在5'UTR和3'UTR区域。尽管RNA-BS-seq技术提供了高分辨率的m5C修饰图谱,但不同研究之间仍存在差异。例如,不同研究中鉴定出的m5C位点数量和分布模式可能不同,这表明m5C修饰的分布可能受到多种因素的影响,如物种、细胞类型、发育阶段和RNA结构等。
D. 推动m5C修饰功能研究
RNA-BS-seq技术为研究m5C修饰的分子功能提供了基础。通过鉴定m5C修饰位点,研究人员能够进一步研究这些位点对mRNA稳定性、出核、翻译效率等生物学过程的影响。同时,RNA-BS-seq技术还为研究m5C修饰在疾病中的作用提供了重要工具。例如,在癌症、神经发育障碍和病毒感染等疾病中,m5C修饰的异常可能与疾病的发病机制密切相关。通过RNA-BS-seq技术,研究人员能够鉴定与疾病相关的m5C修饰位点,从而为疾病的诊断和治疗提供潜在的靶点。
E. 技术改进和优化
为了克服传统BS-seq技术的局限性,如反应时间长、RNA降解等,研究人员开发了超快速BS-seq技术。UBS-seq通过使用高浓度亚硫酸盐和高温反应条件,缩短了反应时间,减少了RNA降解,并提高了C到U的转化效率。
总之,RNA-BS-seq技术在本文中发挥了重要作用,不仅确认了m5C修饰的存在,还绘制了m5C修饰的全转录组图谱,揭示了其分布特征,并推动了m5C修饰在分子功能和疾病相关研究中的应用。随着技术的不断改进和优化,RNA-BS-seq技术将继续为m5C修饰的研究提供强有力的支持。
参考文献:
Wang R, Ding L, Lin Y, Luo W, Xu Z, Li W, Lu Y, Zhu Z, Lu Z, Li F, Mao X, Xia L, Li G. The Quiet Giant: Identification, Effectors, Molecular Mechanism, Physiological and Pathological Function in mRNA 5-methylcytosine Modification. Int J Biol Sci 2024; 20(15):6241-6254. doi:10.7150/ijbs.101337. https://www.ijbs.com/v20p6241.htm
标签:
DNA甲基化





