利用染色质免疫共沉淀测序技术ChIP-seq等揭示头颈鳞癌免疫逃逸机制
免疫逃逸是癌症进展的关键里程碑,是肿瘤免疫治疗的理论基础。头颈部鳞状细胞癌((head and neck squamous cell carcinoma, HNSCC))是全球最常见的恶性肿瘤之一,传统治疗选择包括手术切除、放疗和化疗。最近,利用免疫检查点抑制剂如PD-1/PD-L1单克隆抗体的免疫疗法,已成为治疗难治性复发/转移HNSCC的有希望方法。但超过80%患者仍然表现出固有的药物抗性,不能单独从PD-1/PD-L1免疫疗法中受益。其他免疫检查点分子在HNSCC免疫逃逸中的潜力,影响抗PD-1/PD-L1免疫疗法的效果。因此,进一步探索HNSCC免疫逃逸机制具有至关重要的意义。
人类乳头瘤病毒(Human papillomavirus,HPV)感染与多种HNSCC发生发展相关,HPV16、18、31、33和35等高风险类型,易于诱发各种人类恶性肿瘤,其中HPV16是最普遍的高风险亚型。最近发现HPV可以编码环状RNA(circRNA),而circE7是唯一被鉴定出由高风险HPV16特异性编码的环状RNA。circE7通过影响宿主细胞的表观遗传调控,可能参与肿瘤免疫逃逸和免疫治疗抗性形成。但circE7的生物学功能仍然大部分未知,它在肿瘤免疫逃逸和免疫疗法抗性中的参与尚未被报道。
2024年10月4日,中南大学博士后葛军尚、博士生孟依、硕士生郭佳玥为并列第一作者,中南大学基础医学院曾朝阳、熊炜和中南大学湘雅二医院口腔医学中心龚朝建为共同通讯作者,利用染色质免疫共沉淀测序技术(ChIP-seq)等实验揭示了HPV编码的环状RNA circE7促进头颈部鳞状细胞癌的免疫逃逸机制。相关研究成果以“Human papillomavirus-encoded circular RNA circE7 promotes immune evasion in head and neck squamous cell carcinoma”为题发表在Nature子刊《nature communications》上。
 标题:Human papillomavirus-encoded circular RNA circE7 promotes immune evasion in head and neck squamous cell carcinoma(HPV编码的环状RNA circE7促进头颈部鳞状细胞癌的免疫逃逸)
标题:Human papillomavirus-encoded circular RNA circE7 promotes immune evasion in head and neck squamous cell carcinoma(HPV编码的环状RNA circE7促进头颈部鳞状细胞癌的免疫逃逸)
期刊:Nature Communications
影响因子: IF 14.7 / 1区
技术平台:RT-qPCR、RNA pulldown、western blot、ChIP-seq、RIP实验、动物实验等
本研究通过整合23对HNSCC肿瘤样本及其邻近正常组织,以及105个HNSCC患者的石蜡包埋样本,结合细胞和动物实验,首先观察到circE7表达与HPV HNSCC临床组织中浸润的T细胞呈负相关。体外和体内实验进一步证实,circE7通过表观遗传机制下调LGALS9基因(编码Galectin-9蛋白),从而抑制T细胞功能和活性,进而促进HNSCC免疫逃逸。而LGALS9基因编码的galectin-9蛋白能够与T细胞表面的TIM-3和PD-1等免疫检查点分子结合,进而激活T细胞释放细胞毒性细胞因子并抑制T细胞凋亡。circE7下调Galectin-9,导致CD8+T功能和活性受到抑制;而circE7下调LGALS9表达的具体分子机制是circE7结合并抑制乙酰辅酶A羧化酶1 (acetyl-CoA carboxylase 1, ACC1)的磷酸化和激活,降低细胞内乙酰辅酶A水平,导致LGALS9启动子区域H3K27乙酰化水平降低,通过表观遗传调控抑制LGALS9的表达;最后通过体内外模型证实联合使用TIM-3 (Galectin-9在T细胞上的受体)与PD-1单克隆抗体能显著提高HNSCC的免疫治疗效果。②
总之,本研究展示了HPV通过circE7驱动的表观遗传修饰促进HNSCC免疫逃逸机制,并提出了联合使用抗PD-1和抗TIM-3抑制剂的HNSCC潜在免疫治疗策略,这种联合治疗选择可以增强HNSCC免疫疗法的效果,为头颈鳞癌免疫治疗提供了新靶点和潜在治疗策略。
结果图形
(1)circE7在HPV+(阳性)的HNSCC中表达,并与T细胞浸润和galectin-9表达呈负相关。
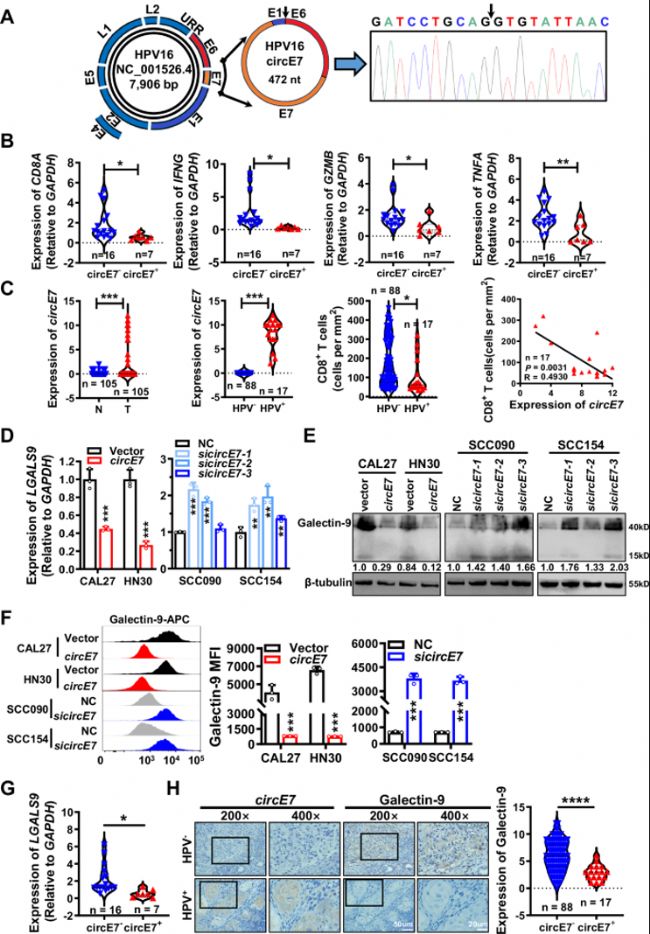
图1:circE7在HPV+ HNSCC中高表达,且与CD8+ T细胞功能和免疫检查点galectin-9表达呈负相关。A. 通过设计跨剪接位点引物并使用Sanger测序,鉴定circE7为通过HPV16 E6尾部、E7和部分E1序列的反向剪接形成的472nt环状RNA。
B. 使用23个HNSCC组织进行RT-qPCR检测CD8A、IFNG、GZMB和TNFA的表达,并分析了它们与circE7表达的相关性。与circE7阴性样本相比,circE7阳性HNSCC样本中CD8A、IFNG、GZMB和TNFA的表达显著降低。(circE7阴性,n=16;circE7阳性,n=7)。
C. 在105个HNSCC组织中,通过原位杂交检测circE7表达。通过免疫组化检测浸润CD8+ T细胞中p16、HPV16 E7蛋白和CD8A的表达。在这105个HNSCC病例中,有17个是HPV阳性,所有这些病例都是HPV16阳性且circE7表达。circE7表达水平与CD8+ T细胞浸润呈负相关。(HPV阴性,n=88;HPV阳性,n=17)。
D-F. 在HPV阴性HNSCC细胞系CAL27和HN30中过表达circE7,或在HPV16阳性HNSCC细胞系SCC090和SCC154中转染靶向circE7的siRNA。RT-qPCR(D)检测LGALS9 mRNA,western blotting(E)和流式细胞术(F)检测galectin-9蛋白表达。
G. 在(B)中使用的23个新鲜HNSCC组织样本上进行RT-qPCR检测LGALS9 mRNA。与circE7阴性组织相比,circE7阳性HNSCC组织中LGALS9 mRNA水平显著降低。(circE7阴性,n=16;circE7阳性,n=7)。
H. 通过免疫组化在(C)中使用的105个HNSCC组织上检测galectin-9表达,并分析其与circE7表达的相关性。(circE7阴性,n=88;circE7阳性,n=17)。
(2)circE7通过下调LGALS9表达促进HNSCC免疫逃逸
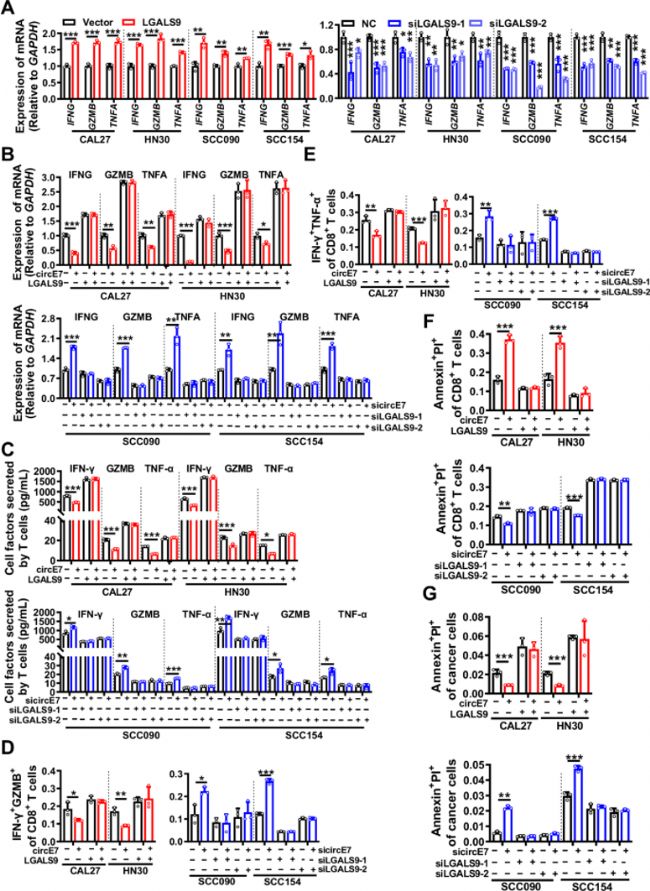
图2:circE7下调HNSCC细胞中galectin-9表达,以体外抑制CD8+ T细胞功能。
在CAL27、HN30、SCC090和SCC154细胞中,过表达或敲低LGALS9,随后与人原代T细胞以1:10的比例共培养6小时。
A. 通过RT-qPCR检测原代T细胞中IFNG、GZMB和TNFA的表达水平。在CAL27和HN30细胞系中,同时过表达circE7和LGALS9。在SCC090和SCC154细胞系中,同时敲低circE7和LGALS9。然后将这些细胞与人原代T细胞共培养6小时。
B. T-qPCR用于检测IFNG、GZMB和TNFA mRNA表达。
C. 通过ELISA检测共培养基中IFN-γ、GZMB和TNF-α的水平。
D-E. 流式细胞术以鉴定总CD8+ T细胞中IFN-γ+ GZMB+和IFN-γ+ TNF-α+ T细胞的比例。
F. 通过Annexin V/PI染色后进行流式细胞术以评估凋亡CD8+ T细胞比例。
G. 使用Annexin V/PI染色后进行流式细胞术以凋亡肿瘤细胞比例。
(3)Galectin-9通过与TIM-3和PD-1结合增强CD8+ T细胞的抗肿瘤活性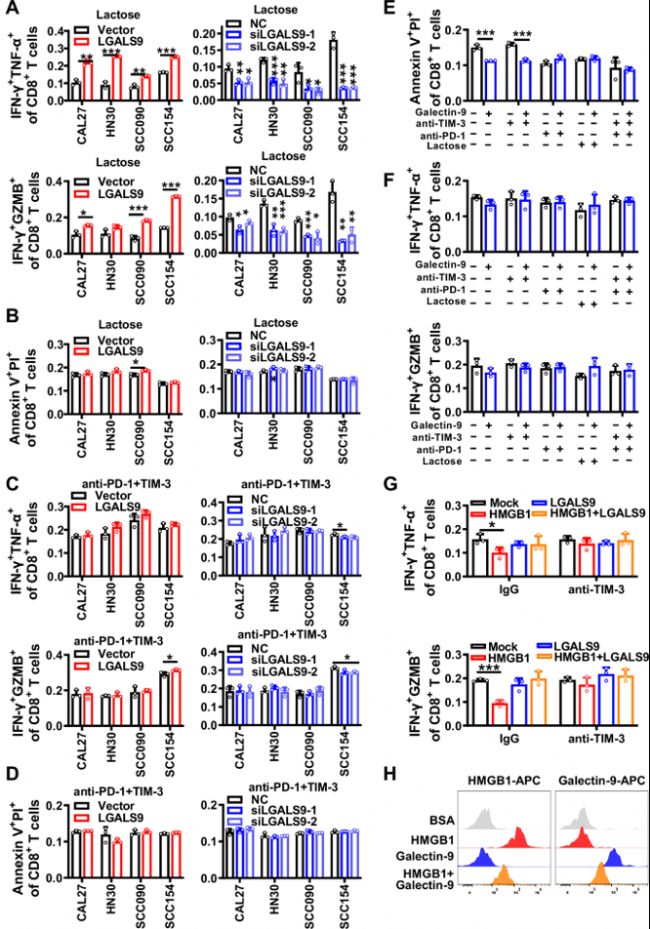
图3:Galectin-9通过与TIM-3和PD-1结合增强T细胞的功能和活性。在CAL27、HN30、SCC090和SCC154细胞中,进行Galectin-9过表达或敲低,然后加入10mg/mL乳糖,并与人原代T细胞以1:10比例共培养6小时。
A. 流式细胞术检测总CD8+ T细胞群中IFN-γ+ GZMB+和IFN-γ+ TNF-α+细胞的百分比。
B. 使用Annexin V/PI检测评估CD8+ T细胞的凋亡水平。在CAL27、HN30、SCC090和SCC154细胞中,进行Galectin-9过表达或敲低,然后加入5μg/mL抗PD-1和抗TIM-3,并与人原代T细胞以1:10的比例共培养6小时。
C. 流式细胞术检测总CD8+ T细胞群中IFN-γ+ GZMB+和IFN-γ+ TNF-α+细胞的百分比。
D. 使用Annexin V/PI检测评估CD8+ T细胞的凋亡水平。此外,人原代T细胞与1μg/mL重组Galectin-9蛋白共培养,同时加入抗TIM-3、抗PD-1和乳糖。
E. 使用Annexin V/PI检测评估CD8+ T细胞的凋亡水平。
F. 流式细胞术检测总CD8+ T细胞群中IFN-γ+ GZMB+和IFN-γ+ TNF-α+细胞的百分比。人原代CD8+ T细胞与1μg/mL重组Galectin-9、HMGB1蛋白和抗TIM-3共培养。
G. 流式细胞术检测总CD8+ T细胞群中IFN-γ+ GZMB+和IFN-γ+ TNF-α+细胞的百分比。BSA为阴性对照。
H. 流式细胞术检测附着在CD8+ T细胞表面的Galectin-9和HMGB1蛋白水平。
(4)circE7结合并激活ACC1以抑制乙酰辅酶A(acetyl-CoA)并抑制Galectin-9表达
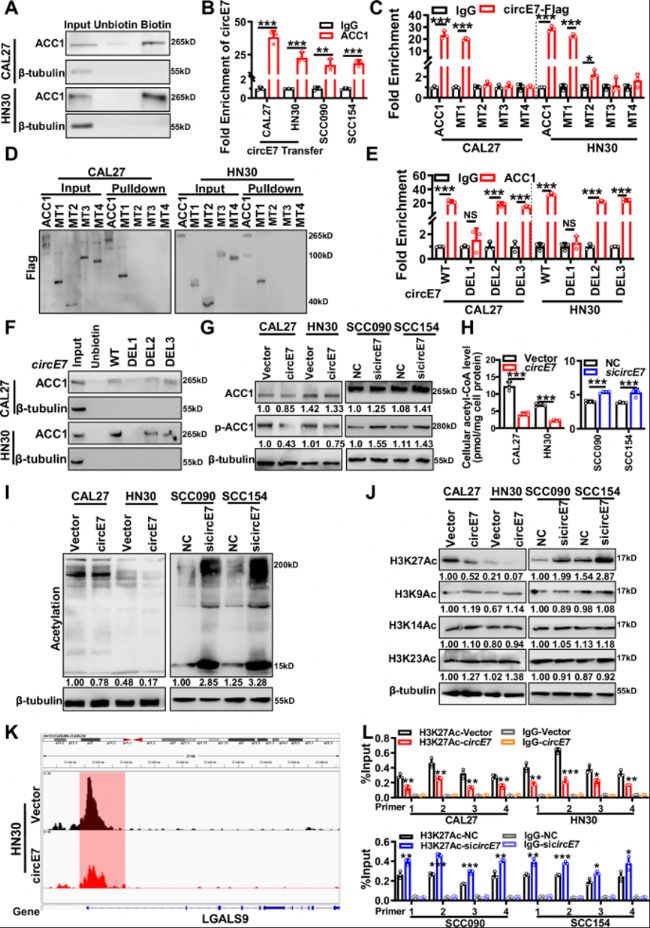
图4:circE7表观遗传下调ACC1介导的Galectin-9表达。
A. 使用生物素标记的circE7探针进行RNA pulldown分析,以检测CAL27和HN30细胞中circE7与ACC1蛋白之间的结合。非生物素标记的circE7探针用作对照。
B. 在circE7过表达的CAL27和HN30细胞、或HPV阳性SCC090和SCC154细胞中,使用抗ACC1抗体进行RIP检测ACC1蛋白与circE7的结合,然后RT-qPCR定量分析。
C. 使用抗Flag抗体进行RNA免疫沉淀,以评估ACC1蛋白与其截断突变体与circE7的结合,然后对circE7进行RT-qPCR分析。
D. 使用生物素标记的circE7探针进行RNA pulldown,并使用抗Flag抗体进行western blot,以检测circE7与ACC1及其截断突变体之间的结合。
E. 使用抗ACC1抗体进行RNA免疫沉淀,以评估ACC1蛋白与circE7及其截断突变体之间的直接结合,然后对circE7及其截断突变体进行RT-qPCR分析。
F. 使用生物素标记的circE7探针进行RNA pulldown,以研究circE7及其截断突变体与ACC1蛋白之间的结合。在CAL27和HN30细胞中过表达circE7,或在SCC090和SCC154细胞中转染si-circE7。
G. western blot检测总ACC1蛋白和p-ACC1蛋白的表达水平。
H. 使用乙酰辅酶A检测试剂盒检测细胞裂解物中的乙酰辅酶A含量。
I. western blot检测整体乙酰化的表达水平。
J. western blot 检测H3K27 Ac、H3K9 Ac、H3K14 Ac和H3K23 Ac的表达水平。
K. 在HN30细胞中过表达circE7,ChIP-seq peaks显示LGALS9启动子区域的H3K27ac水平。横轴代表基因组坐标,纵轴代表ChIP-seq信号强度。
L. ChIP-qPCR用于研究在CAL27和HN30细胞中过表达circE7或在SCC090和SCC154细胞中敲低circE7后LGALS9启动子区域H3K27乙酰化水平变化。
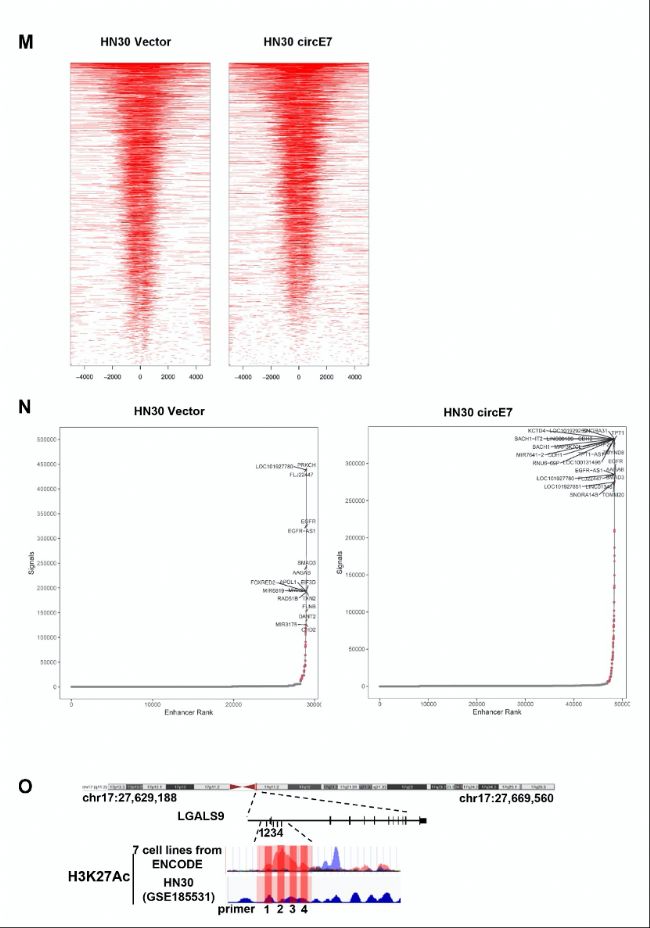
图4-1:HN30细胞中过表达circE7的ChIP-seq和ChIP-qPCR分析。
M. 在HN30细胞中过表达circE7,CHIP-seq peaks显示H3K27ac的整体水平。
N. hockey stick plot显示在HN30细胞中,与Vector和OE-circE7相比,突出显示SE相关基因的input归一化、等级排序的H3K27ac信号。
O. 在GSE1855312和ENCODE数据库中分析LGALS9启动子区域的H3K27Ac水平。
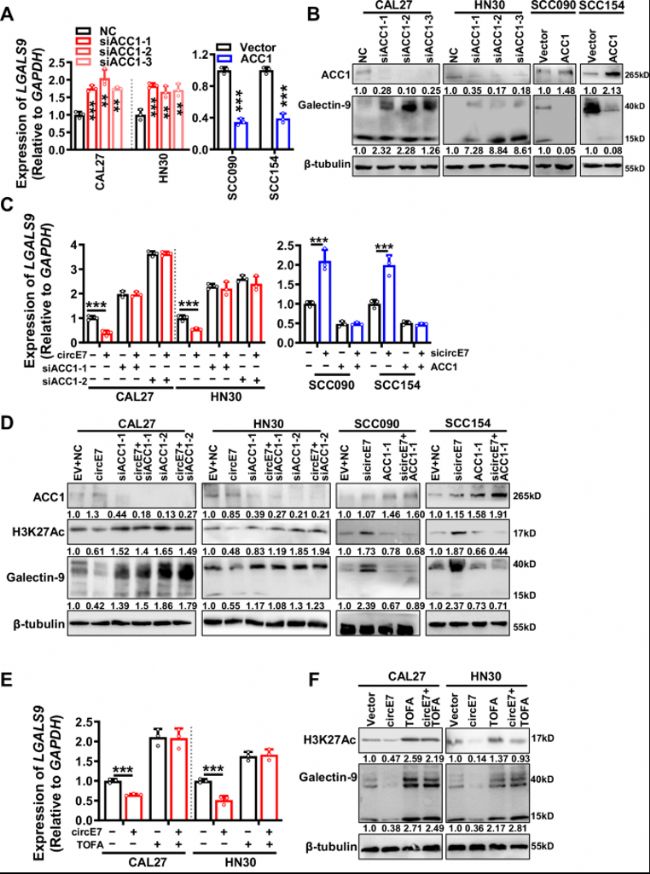
图5:ACC1是circE7在LGALS9转录表观遗传调控中的关键下游调控靶点。
A. 三个ACC1 siRNA被转染到CAL27和HN30细胞中,或在SCC090和SCC154细胞中过表达ACC1,使用RT-qPCR检测LGALS9 mRNA表达水平。
B. 使用Western blot检测ACC1和galectin-9蛋白的表达水平。在CAL27和HN30细胞中过表达circE7的同时敲低ACC1,或者在SCC090和SCC154细胞中敲低circE7的同时过表达ACC1。
C. 使用RT-qPCR检测LGALS9 mRNA的表达水平。
D. 使用Western blot检测ACC1、H3K27 Ac和galectin-9蛋白的水平。在CAL27和HN30细胞中过表达circE7的同时加入ACC1的小分子抑制剂TOFA。
E. 使用RT-qPCR检测LGALS9 mRNA的表达水平。
F. 使用Western blot检测H3K27Ac和galectin-9蛋白水平。
(5)TIM-3和PD-1单克隆抗体的联合应用大大提高了HNSCC免疫治疗效果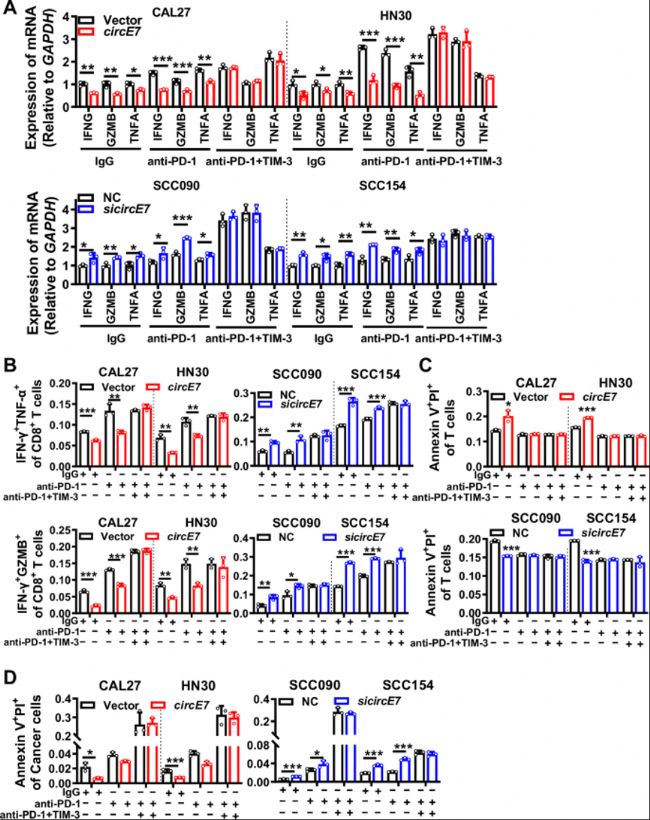
图6:外源性TIM-3和PD-1单克隆抗体的联合治疗增强了CD8+ T细胞的细胞毒性功能。
CAL27和HN30细胞进行circE7过表达,或SCC090和SCC154细胞circE7敲低,然后与人原代T细胞共培养6小时,加入5μg/mL抗PD-1或抗PD-1/TIM-3。
A. 使用RT-qPCR检测CD8+ T细胞中IFNG、GZMB和TNFA mRNA的表达水平。
B. 使用流式细胞术检测所有CD8+ T细胞中IFN-γ+ GZMB+和IFN-γ+ TNF-α+ T细胞的比例。
C-D. 使用Annexin V/PI染色评估CD8+ T细胞(C)和肿瘤细胞(D)的凋亡水平。
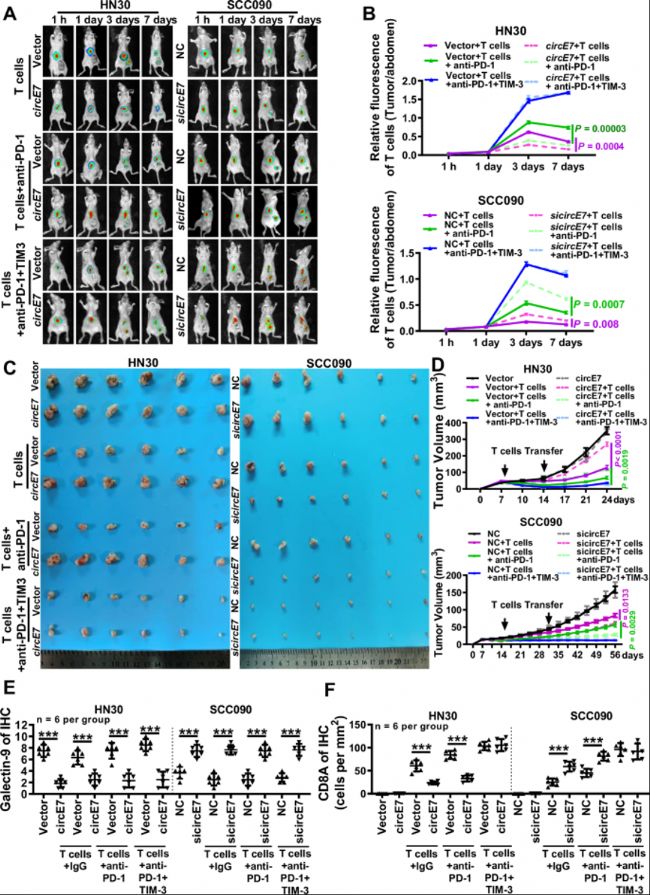
图7:TIM-3和PD-1单克隆抗体的联合治疗显著提高了HNSCC免疫治疗效果。
裸鼠通过右后肢注射1×10^6过表达circE7的HN30细胞或载体对照,或注射敲低circE7或NC对照的SCC090细胞来形成异种移植肿瘤。7天和14天后,注射人原代T细胞和20μg/每个的抗PD-1或抗PD-1/TIM-3进行免疫治疗。
A-B. T细胞被标记为DeepRed,进行体内成像以检测携带肿瘤小鼠中人原代T细胞的生存和分布(每组n=3)。A 代表性图像;B 注射后1、3、5和7天收集的肿瘤部位(右大腿底部)的DiR荧光信号与T细胞荧光强度比率的统计结果。颜色标尺代表小鼠T细胞的DiR荧光强度。
C. 代表性肿瘤图像。左图,HN30细胞注射后24天(每组n=6);右图,SCC090细胞注射后56天(每组n=6)。
D. 每周实时测量注射HN30或SCC090细胞的小鼠的肿瘤体积(每组n=6)。
E. 通过免疫组化检测石蜡包埋的HN30和SCC090异种移植肿瘤中Galectin-9表达,并对结果进行统计分析(每组n=6)。
F. 通过免疫组化检测HN30和SCC090异种移植肿瘤中CD8A的表达,并对结果进行统计分析(每组n=6)。
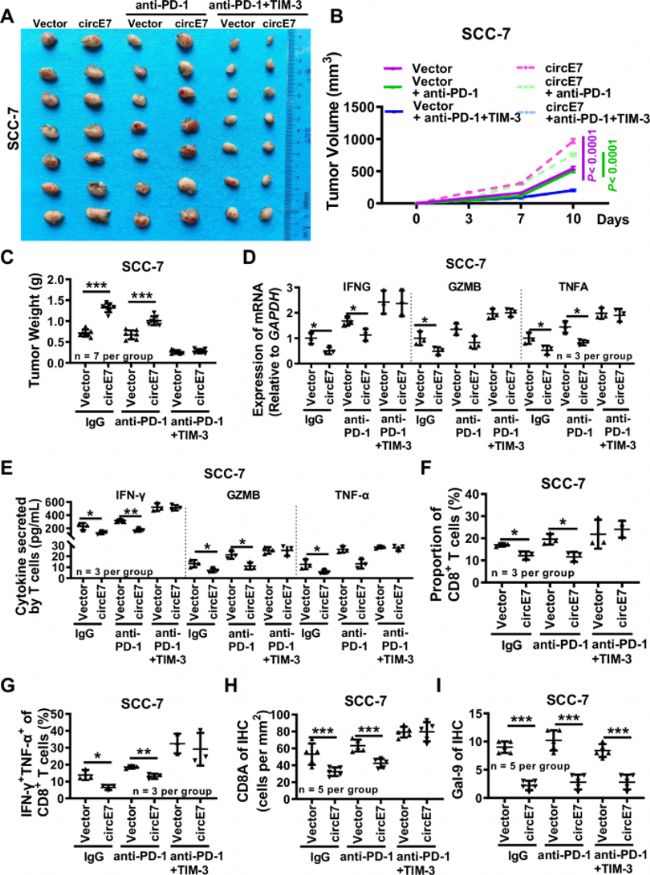
图8:小鼠原位移植模型显示PD-1和TIM-3单克隆抗体的联合使用增强了HNSCC免疫治疗的疗效。C3H小鼠在右侧脸颊注射2×10^5过表达circE7的SCC-7细胞或载体对照,形成异种移植肿瘤。3天后,注射20μg/次的抗PD-1或抗PD-1/TIM-3进行免疫治疗。
A. 代表性肿瘤图像(每组n=7)。
B. 肿瘤体积在SCC-7细胞注射后3天、7天和10天的测量结果(每组n=7)。
C. 注射SCC-7细胞后10天测量的肿瘤重量(每组n=7)。
D. 从小鼠肿瘤组织中制备单细胞悬浮液,通过RT-qPCR检测IFNG、GZMB和TNFA mRNA表达(每组n=3)。
E. 使用ELISA检测IFN-γ、GZMB和TNF-α的含量(每组n=3)。
F-G. 流式细胞术检测CD8+ T细胞的比例(F)以及总CD8+ T细胞群中IFN-γ+ TNF-α+细胞的百分比(G)(每组n=3)。
H. 通过免疫组化检测SCC-7异种移植肿瘤中Cd8A表达,并对结果进行统计分析(每组n=5)。
I. 通过免疫组化检测石蜡包埋的SCC-7异种移植肿瘤中galectin-9表达,并对结果进行统计分析(每组n=5)。
参考文献:
人类乳头瘤病毒(Human papillomavirus,HPV)感染与多种HNSCC发生发展相关,HPV16、18、31、33和35等高风险类型,易于诱发各种人类恶性肿瘤,其中HPV16是最普遍的高风险亚型。最近发现HPV可以编码环状RNA(circRNA),而circE7是唯一被鉴定出由高风险HPV16特异性编码的环状RNA。circE7通过影响宿主细胞的表观遗传调控,可能参与肿瘤免疫逃逸和免疫治疗抗性形成。但circE7的生物学功能仍然大部分未知,它在肿瘤免疫逃逸和免疫疗法抗性中的参与尚未被报道。
2024年10月4日,中南大学博士后葛军尚、博士生孟依、硕士生郭佳玥为并列第一作者,中南大学基础医学院曾朝阳、熊炜和中南大学湘雅二医院口腔医学中心龚朝建为共同通讯作者,利用染色质免疫共沉淀测序技术(ChIP-seq)等实验揭示了HPV编码的环状RNA circE7促进头颈部鳞状细胞癌的免疫逃逸机制。相关研究成果以“Human papillomavirus-encoded circular RNA circE7 promotes immune evasion in head and neck squamous cell carcinoma”为题发表在Nature子刊《nature communications》上。

期刊:Nature Communications
影响因子: IF 14.7 / 1区
技术平台:RT-qPCR、RNA pulldown、western blot、ChIP-seq、RIP实验、动物实验等
本研究通过整合23对HNSCC肿瘤样本及其邻近正常组织,以及105个HNSCC患者的石蜡包埋样本,结合细胞和动物实验,首先观察到circE7表达与HPV HNSCC临床组织中浸润的T细胞呈负相关。体外和体内实验进一步证实,circE7通过表观遗传机制下调LGALS9基因(编码Galectin-9蛋白),从而抑制T细胞功能和活性,进而促进HNSCC免疫逃逸。而LGALS9基因编码的galectin-9蛋白能够与T细胞表面的TIM-3和PD-1等免疫检查点分子结合,进而激活T细胞释放细胞毒性细胞因子并抑制T细胞凋亡。circE7下调Galectin-9,导致CD8+T功能和活性受到抑制;而circE7下调LGALS9表达的具体分子机制是circE7结合并抑制乙酰辅酶A羧化酶1 (acetyl-CoA carboxylase 1, ACC1)的磷酸化和激活,降低细胞内乙酰辅酶A水平,导致LGALS9启动子区域H3K27乙酰化水平降低,通过表观遗传调控抑制LGALS9的表达;最后通过体内外模型证实联合使用TIM-3 (Galectin-9在T细胞上的受体)与PD-1单克隆抗体能显著提高HNSCC的免疫治疗效果。②
总之,本研究展示了HPV通过circE7驱动的表观遗传修饰促进HNSCC免疫逃逸机制,并提出了联合使用抗PD-1和抗TIM-3抑制剂的HNSCC潜在免疫治疗策略,这种联合治疗选择可以增强HNSCC免疫疗法的效果,为头颈鳞癌免疫治疗提供了新靶点和潜在治疗策略。
结果图形
(1)circE7在HPV+(阳性)的HNSCC中表达,并与T细胞浸润和galectin-9表达呈负相关。

B. 使用23个HNSCC组织进行RT-qPCR检测CD8A、IFNG、GZMB和TNFA的表达,并分析了它们与circE7表达的相关性。与circE7阴性样本相比,circE7阳性HNSCC样本中CD8A、IFNG、GZMB和TNFA的表达显著降低。(circE7阴性,n=16;circE7阳性,n=7)。
C. 在105个HNSCC组织中,通过原位杂交检测circE7表达。通过免疫组化检测浸润CD8+ T细胞中p16、HPV16 E7蛋白和CD8A的表达。在这105个HNSCC病例中,有17个是HPV阳性,所有这些病例都是HPV16阳性且circE7表达。circE7表达水平与CD8+ T细胞浸润呈负相关。(HPV阴性,n=88;HPV阳性,n=17)。
D-F. 在HPV阴性HNSCC细胞系CAL27和HN30中过表达circE7,或在HPV16阳性HNSCC细胞系SCC090和SCC154中转染靶向circE7的siRNA。RT-qPCR(D)检测LGALS9 mRNA,western blotting(E)和流式细胞术(F)检测galectin-9蛋白表达。
G. 在(B)中使用的23个新鲜HNSCC组织样本上进行RT-qPCR检测LGALS9 mRNA。与circE7阴性组织相比,circE7阳性HNSCC组织中LGALS9 mRNA水平显著降低。(circE7阴性,n=16;circE7阳性,n=7)。
H. 通过免疫组化在(C)中使用的105个HNSCC组织上检测galectin-9表达,并分析其与circE7表达的相关性。(circE7阴性,n=88;circE7阳性,n=17)。
(2)circE7通过下调LGALS9表达促进HNSCC免疫逃逸

图2:circE7下调HNSCC细胞中galectin-9表达,以体外抑制CD8+ T细胞功能。
A. 通过RT-qPCR检测原代T细胞中IFNG、GZMB和TNFA的表达水平。在CAL27和HN30细胞系中,同时过表达circE7和LGALS9。在SCC090和SCC154细胞系中,同时敲低circE7和LGALS9。然后将这些细胞与人原代T细胞共培养6小时。
B. T-qPCR用于检测IFNG、GZMB和TNFA mRNA表达。
C. 通过ELISA检测共培养基中IFN-γ、GZMB和TNF-α的水平。
D-E. 流式细胞术以鉴定总CD8+ T细胞中IFN-γ+ GZMB+和IFN-γ+ TNF-α+ T细胞的比例。
F. 通过Annexin V/PI染色后进行流式细胞术以评估凋亡CD8+ T细胞比例。
G. 使用Annexin V/PI染色后进行流式细胞术以凋亡肿瘤细胞比例。
(3)Galectin-9通过与TIM-3和PD-1结合增强CD8+ T细胞的抗肿瘤活性

图3:Galectin-9通过与TIM-3和PD-1结合增强T细胞的功能和活性。在CAL27、HN30、SCC090和SCC154细胞中,进行Galectin-9过表达或敲低,然后加入10mg/mL乳糖,并与人原代T细胞以1:10比例共培养6小时。
B. 使用Annexin V/PI检测评估CD8+ T细胞的凋亡水平。在CAL27、HN30、SCC090和SCC154细胞中,进行Galectin-9过表达或敲低,然后加入5μg/mL抗PD-1和抗TIM-3,并与人原代T细胞以1:10的比例共培养6小时。
C. 流式细胞术检测总CD8+ T细胞群中IFN-γ+ GZMB+和IFN-γ+ TNF-α+细胞的百分比。
D. 使用Annexin V/PI检测评估CD8+ T细胞的凋亡水平。此外,人原代T细胞与1μg/mL重组Galectin-9蛋白共培养,同时加入抗TIM-3、抗PD-1和乳糖。
E. 使用Annexin V/PI检测评估CD8+ T细胞的凋亡水平。
F. 流式细胞术检测总CD8+ T细胞群中IFN-γ+ GZMB+和IFN-γ+ TNF-α+细胞的百分比。人原代CD8+ T细胞与1μg/mL重组Galectin-9、HMGB1蛋白和抗TIM-3共培养。
G. 流式细胞术检测总CD8+ T细胞群中IFN-γ+ GZMB+和IFN-γ+ TNF-α+细胞的百分比。BSA为阴性对照。
H. 流式细胞术检测附着在CD8+ T细胞表面的Galectin-9和HMGB1蛋白水平。
(4)circE7结合并激活ACC1以抑制乙酰辅酶A(acetyl-CoA)并抑制Galectin-9表达

图4:circE7表观遗传下调ACC1介导的Galectin-9表达。
B. 在circE7过表达的CAL27和HN30细胞、或HPV阳性SCC090和SCC154细胞中,使用抗ACC1抗体进行RIP检测ACC1蛋白与circE7的结合,然后RT-qPCR定量分析。
C. 使用抗Flag抗体进行RNA免疫沉淀,以评估ACC1蛋白与其截断突变体与circE7的结合,然后对circE7进行RT-qPCR分析。
D. 使用生物素标记的circE7探针进行RNA pulldown,并使用抗Flag抗体进行western blot,以检测circE7与ACC1及其截断突变体之间的结合。
E. 使用抗ACC1抗体进行RNA免疫沉淀,以评估ACC1蛋白与circE7及其截断突变体之间的直接结合,然后对circE7及其截断突变体进行RT-qPCR分析。
F. 使用生物素标记的circE7探针进行RNA pulldown,以研究circE7及其截断突变体与ACC1蛋白之间的结合。在CAL27和HN30细胞中过表达circE7,或在SCC090和SCC154细胞中转染si-circE7。
G. western blot检测总ACC1蛋白和p-ACC1蛋白的表达水平。
H. 使用乙酰辅酶A检测试剂盒检测细胞裂解物中的乙酰辅酶A含量。
I. western blot检测整体乙酰化的表达水平。
J. western blot 检测H3K27 Ac、H3K9 Ac、H3K14 Ac和H3K23 Ac的表达水平。
K. 在HN30细胞中过表达circE7,ChIP-seq peaks显示LGALS9启动子区域的H3K27ac水平。横轴代表基因组坐标,纵轴代表ChIP-seq信号强度。
L. ChIP-qPCR用于研究在CAL27和HN30细胞中过表达circE7或在SCC090和SCC154细胞中敲低circE7后LGALS9启动子区域H3K27乙酰化水平变化。

图4-1:HN30细胞中过表达circE7的ChIP-seq和ChIP-qPCR分析。
N. hockey stick plot显示在HN30细胞中,与Vector和OE-circE7相比,突出显示SE相关基因的input归一化、等级排序的H3K27ac信号。
O. 在GSE1855312和ENCODE数据库中分析LGALS9启动子区域的H3K27Ac水平。

图5:ACC1是circE7在LGALS9转录表观遗传调控中的关键下游调控靶点。
B. 使用Western blot检测ACC1和galectin-9蛋白的表达水平。在CAL27和HN30细胞中过表达circE7的同时敲低ACC1,或者在SCC090和SCC154细胞中敲低circE7的同时过表达ACC1。
C. 使用RT-qPCR检测LGALS9 mRNA的表达水平。
D. 使用Western blot检测ACC1、H3K27 Ac和galectin-9蛋白的水平。在CAL27和HN30细胞中过表达circE7的同时加入ACC1的小分子抑制剂TOFA。
E. 使用RT-qPCR检测LGALS9 mRNA的表达水平。
F. 使用Western blot检测H3K27Ac和galectin-9蛋白水平。
(5)TIM-3和PD-1单克隆抗体的联合应用大大提高了HNSCC免疫治疗效果

图6:外源性TIM-3和PD-1单克隆抗体的联合治疗增强了CD8+ T细胞的细胞毒性功能。
A. 使用RT-qPCR检测CD8+ T细胞中IFNG、GZMB和TNFA mRNA的表达水平。
B. 使用流式细胞术检测所有CD8+ T细胞中IFN-γ+ GZMB+和IFN-γ+ TNF-α+ T细胞的比例。
C-D. 使用Annexin V/PI染色评估CD8+ T细胞(C)和肿瘤细胞(D)的凋亡水平。

图7:TIM-3和PD-1单克隆抗体的联合治疗显著提高了HNSCC免疫治疗效果。
A-B. T细胞被标记为DeepRed,进行体内成像以检测携带肿瘤小鼠中人原代T细胞的生存和分布(每组n=3)。A 代表性图像;B 注射后1、3、5和7天收集的肿瘤部位(右大腿底部)的DiR荧光信号与T细胞荧光强度比率的统计结果。颜色标尺代表小鼠T细胞的DiR荧光强度。
C. 代表性肿瘤图像。左图,HN30细胞注射后24天(每组n=6);右图,SCC090细胞注射后56天(每组n=6)。
D. 每周实时测量注射HN30或SCC090细胞的小鼠的肿瘤体积(每组n=6)。
E. 通过免疫组化检测石蜡包埋的HN30和SCC090异种移植肿瘤中Galectin-9表达,并对结果进行统计分析(每组n=6)。
F. 通过免疫组化检测HN30和SCC090异种移植肿瘤中CD8A的表达,并对结果进行统计分析(每组n=6)。

A. 代表性肿瘤图像(每组n=7)。
B. 肿瘤体积在SCC-7细胞注射后3天、7天和10天的测量结果(每组n=7)。
C. 注射SCC-7细胞后10天测量的肿瘤重量(每组n=7)。
D. 从小鼠肿瘤组织中制备单细胞悬浮液,通过RT-qPCR检测IFNG、GZMB和TNFA mRNA表达(每组n=3)。
E. 使用ELISA检测IFN-γ、GZMB和TNF-α的含量(每组n=3)。
F-G. 流式细胞术检测CD8+ T细胞的比例(F)以及总CD8+ T细胞群中IFN-γ+ TNF-α+细胞的百分比(G)(每组n=3)。
H. 通过免疫组化检测SCC-7异种移植肿瘤中Cd8A表达,并对结果进行统计分析(每组n=5)。
I. 通过免疫组化检测石蜡包埋的SCC-7异种移植肿瘤中galectin-9表达,并对结果进行统计分析(每组n=5)。
参考文献:
- Ge, J., Meng, Y., Guo, J. et al. Human papillomavirus-encoded circular RNA circE7 promotes immune evasion in head and neck squamous cell carcinoma. Nat Commun 15, 8609 (2024). https://doi.org/10.1038/s41467-024-52981-4
- 中南大学湘雅二医院官网:湘雅二医院口腔医学中心龚朝建团队揭示头颈鳞癌发病新机制 https://www.xyeyy.com/2/17/content_80964.html
标签:
ChIP-seq





