单细胞RNA测序及全外显子组测序在甲状腺癌去分化的综合分析中的应用

期刊:Science advances
影响因子:13.6
主要技术:单细胞RNA测序(scRNA-seq),全外显子组测序(WES)
导语
去分化是甲状腺癌患者较差预后的重要指标,其异质性及去分化机制尚不明确。本文使用scRNA-seq,构建了甲状腺癌的单细胞图谱,描绘了其去分化过程和抑制性免疫微环境。发育轨迹表明,间变性甲状腺癌(ATC)细胞来源于乳头状甲状腺癌(PTC)细胞的一个小子集。拷贝数改变和转录调控网络的综合分析,揭示了CREB3L1在ATC发育中的潜在功能作用。分化相关途径中的多个基因作为CREB3L1的下游靶点参与,CREB3L1的高表达预测了PTC的较高复发风险。本研究为了解甲状腺癌的异质性和分子机制提供了重要信息,并强调了CREB3L1在其去分化过程中的潜在驱动作用。
关键技术
单细胞RNA测序(scRNA-seq)
全外显子组测序(WES)
研究结果
1. 甲状腺癌的单细胞图谱
为了探索甲状腺癌的细胞组成,作者通过scRNA-seq和WES分析了一名PTC患者的PTC/ATC肿瘤和正常甲状腺组织(图1A)。质量控制后,共鉴定16个细胞群,3个甲状腺癌细胞亚群(PTC和ATC),2个成纤维细胞亚群,8个免疫细胞群(B细胞、T细胞和巨噬细胞)(图1 B)。其中PTC细胞被分为亚群簇(PTC 1和PTC 2)(图1B),具有明显的异质性。而PTC和ATC细胞可通过PI3K和增殖标志物的高表达进行区分。
ATC衍生的NK和T细胞高度表达淋巴功能障碍标志物,且在ATC中观察到M1/M2比值显著降低表明肿瘤进展和免疫抑制。由于FAP + 成纤维细胞促进免疫抑制性肿瘤微环境,ATC中较低的成纤维细胞1(FAP − )/成纤维细胞2(FAP + )比率表明ATC抗肿瘤免疫受到抑制(图1C)。CellphoneDB分析,成纤维细胞与癌细胞中的ATC细胞具有特异性强相互作用,并且旨在与M2和TAMC相互作用。所有的证据都表明ATC中存在免疫抑制微环境。
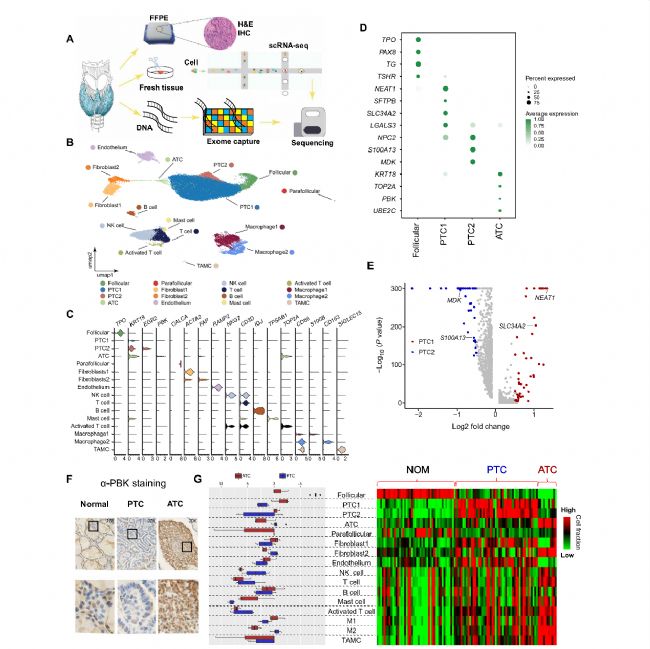
图1 甲状腺癌的单细胞特征
2. 甲状腺癌去分化过程中转录水平的动态变化
为了深入了解PTC到ATC的细胞进展,作者将PTC细胞分为PTC衍生的PTC细胞(pPTC)和ATC衍生的PTC细胞(aPTC)(图2A)。细胞轨迹分析揭示了ATC和PTC具有不同的进展途径(图2C)。aPTC细胞定位于ATC进展轨迹上,并且它们中的一个子集在分叉后接近ATC细胞,表明ATC可能来源于PTC细胞的亚群(即aPTC)。沿着PTC到ATC细胞的轨迹,作者鉴定了许多参与癌症发展的基因表达变化和多种癌症相关途径的不同激活。这些发现表明滤泡细胞进展为PTC或ATC遵循不同的进化途径,涉及特定的细胞亚群和多个途径的激活。
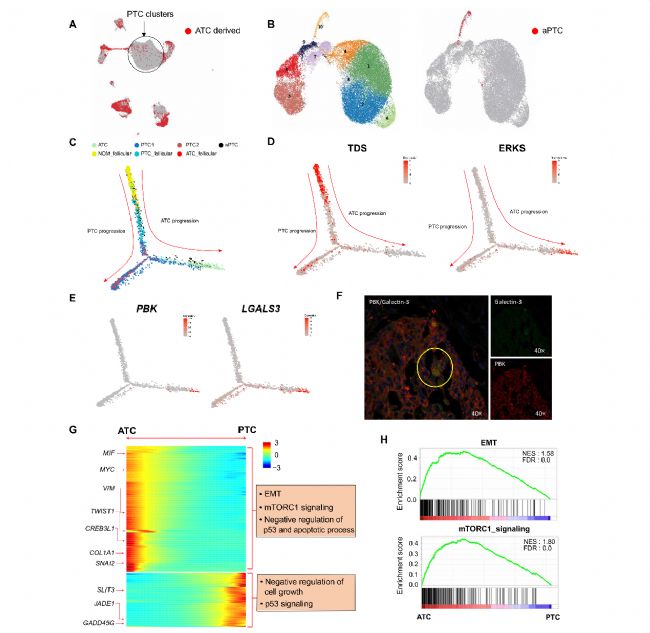
图2甲状腺癌去分化过程中的进化轨迹和转录水平的变化
3. CNAs在甲状腺癌去分化中的作用
为了鉴定ATC和PTC细胞之间基因组的差异,作者基于单细胞数据推断拷贝数改变(CNA),在ATC细胞中鉴定出比PTC细胞中更高的CNA,表明ATC细胞中染色体不稳定性增加(图3A)。结合WES分析结果,作者锁定了在三种ATC肿瘤中观察到的Chr 11-CNA(41.1至47.9 M)(图3B和图3C)。气泡图显示,与正常细胞和PTC细胞相比,位于该CNA区域的大多数基因在ATC细胞中高度表达(图3C)。此外,该Chr 11-CNA在从正常细胞到ATC细胞的细胞轨迹的中途开始增加,并且在ATC细胞中高度富集,但在PTC细胞中不富集(图3D),表明该区域中的特定基因可能参与aPTC的ATC进展。
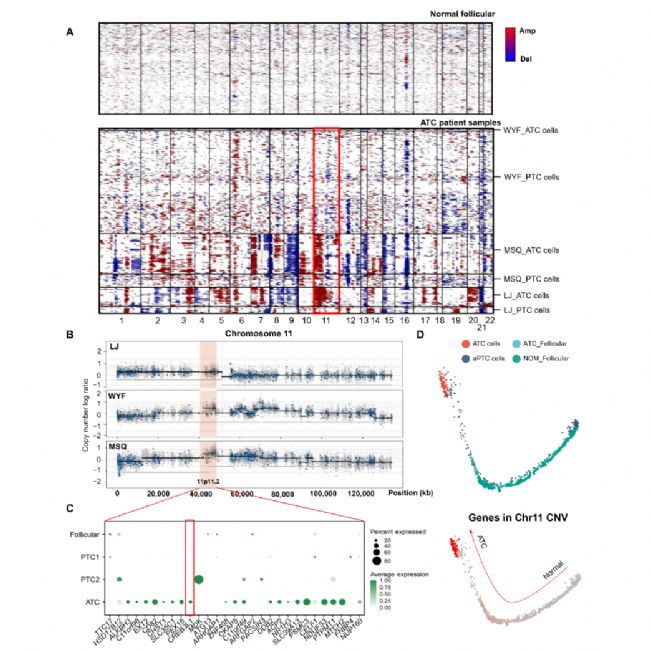
图3 甲状腺癌去分化过程中的CNAs
4. CREB3L1作为ATC中的主转录调节因子
由于上述多种途径与ATC进展相关,作者推测上游转录因子(TF)可能是ATC进展的关键调节因子。因此,作者用scRNA-seq数据进行SCENIC分析以重建共表达模块并鉴定ATC进展期间的关键TF调节剂。分析发现CREB3L1在ATC衍生的甲状腺癌细胞中富集,特别是在ATC细胞中高表达,表明CREB3L1表达与ATC进展相关。在ATC细胞中观察到大量CREB3L1阳性细胞(图4 B),并沿滤泡-aPTC-ATC轨迹逐渐富集(图4C)。CREB3L1恰好位于上述ATC相关的Chr11-CNA中,为它在ATC进展中的潜在作用提供了重要支持。为探究CREB3L1在ATC发展中的作用,作者进一步研究了CREB3L1的靶基因及其在ATC中的相关通路。ChIP-seq分析结果显示,CREB3L1的结合区在基因启动子中高度富集(图4 E),2222个基因被鉴定为CREB3L1的潜在靶标,其表达倾向于沿着ATC进展而增加(图4F)。CREB3L1靶基因在ATC细胞中富集EMT和mTOR信号传导(图4G),与scRNA-seq中ATC转录组的通路富集分析一致。这些发现为CREB3L1通过EMT和mTOR途径在ATC发展中的主转录调节作用提供了强有力的支持。
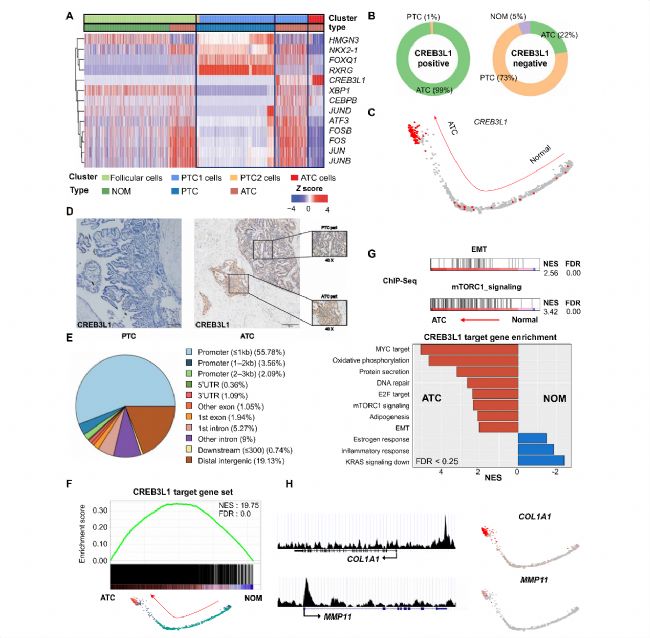
5. 驱动的通路与甲状腺癌进展的相关性
对来自GEO数据库的4项独立的甲状腺癌bulk RNA做GSEA分析,进一步评估CREB3L1对ATC形成的影响。分析结果均显示,CREB3L1和参与EMT/mTORC1途径的基因在ATC中显著富集(图5A)。根据CREB3L1表达水平将来自TCGA的甲状腺癌样本分为两组。在两组之间总共鉴定了1115个DEGs,EMT相关基因在CREB3L1high组中高表达(图5 B)。有趣的是,CREB3L1高表达可以预测TCGA中PTC患者的显著更差的总体存活率(图5E)。为了进一步评估CREB3L1的功能,作者在PTC细胞系中过表达CREB3L1,其迁移能力显著增加(P = 0.004)(图5G),并诱导了多种EMT相关标志物高表达,抑制与EMT负相关的E-钙粘蛋白的表达(图5 H)。此外,CREB3L1染色在其他癌症的甲状腺转移中不存在(例如,肺腺癌、非霍奇金淋巴瘤和鳞状细胞癌)。因此,CREB3L1免疫组化染色阳性有助于该病的鉴别诊断和指导临床治疗,这些发现表明CREB3L1表达可能决定甲状腺癌的细胞命运,并促进甲状腺癌患者的ATC进展和不良临床结局。
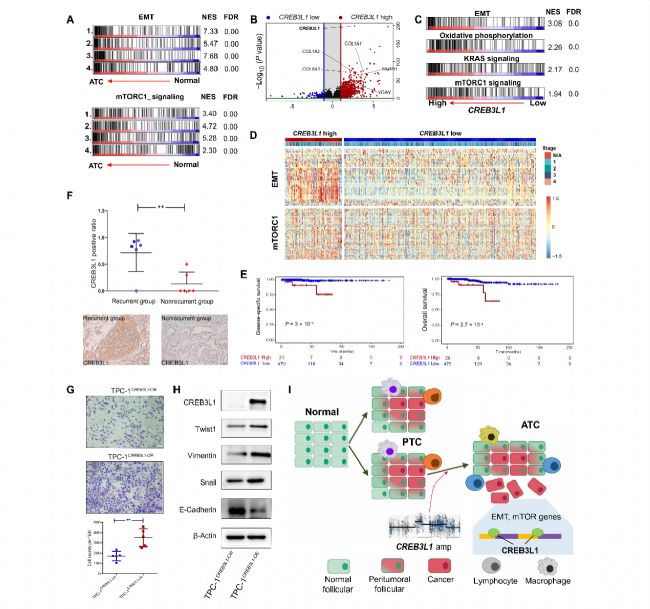
图5 CREB3L1在甲状腺癌进展中的功能
参考文献:
Luo H, Xia X, Kim GD, et al (2021) Characterizing dedifferentiation of thyroid cancer by integrated analysis. Sci Adv 7:eabf3657. https://doi.org/10.1126/sciadv.abf3657





