文献解读:CXCR6和CD8+T细胞在小鼠AD发病机制中的作用

期刊:nature immunology
影响因子:30.5
主要技术:scRNA-seq
导语
神经退行性疾病,包括阿尔茨海默病(AD),以先天免疫介导的炎症为特征,但适应性免疫系统的功能和机制作用尚不清楚。该研究鉴定了人类和小鼠阿尔茨海默病大脑中共表达CXCR6和PD-1的脑驻留CD8+T细胞,这些细胞靠近斑块相关的小胶质细胞,还确定CD8+T细胞限制AD病理,包括β-淀粉样蛋白沉积和认知能力下降,总之,该研究揭示了脑CD8+细胞和CXCR6在小鼠AD发病机制中的保护作用,并强调了微环境特异性的细胞间通讯协调组织稳态和保护神经炎症。
关键技术
scRNA-seq,scTCR-seq
研究结果
1. CD8+T细胞保护小鼠免受AD相关病理作用
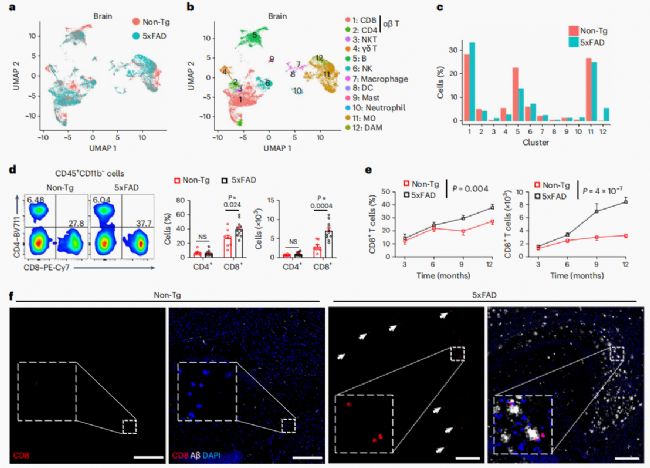
对5xFAD和非转基因(Non-Tg)对照小鼠的脑组织或脑膜组织进行了scRNA-seq分析。通过降维聚类确定了12种Clusters。,与疾病相关的小胶质细胞(DAM)仅存在于5xFAD小鼠中(图1a-c)。值得注意的是,在5xFAD小鼠中,CD8+T细胞的频率升高,而CD4+ T细胞或γδT细胞的频率没有升高(图1c)。流式细胞术分析显示,5xFAD小鼠大脑中CD3+TCRβ+T细胞的频率和数量的增加主要归因于CD8+T细胞的积累(图1d)。与非转基因小鼠相比,5xFAD小鼠中CD3+或CD8+T细胞(而非CD4+T细胞)表现出更明显的年龄依赖性积聚(图1e)。并且,免疫染色实验在5xFAD小鼠中验证了以上观察结果(图1f)。因此,这些结果表明CD8+T细胞积累是一个保守的特征。
2. CXCL16-CXCR6协调小胶质细胞-CD8+T间细胞通讯
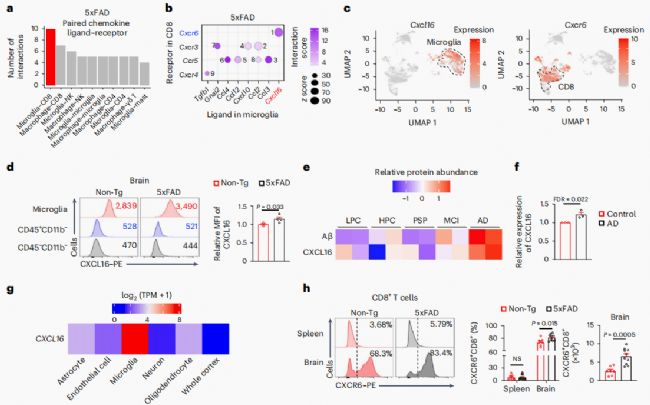
基于scRNA-seq数据进行配受体分析。分析预测出小胶质细胞和CD8+T细胞之间趋化因子配受体间相互作用的数量比其他细胞类型之间更多(图2a),这表明小胶质细胞和CD8+T细胞之间可能存在细胞间信息通讯。而后通过单个趋化因子配体受体对分析发现CXCL16-CXCR6是5xFAD小鼠小胶质细胞和CD8+T细胞之间排名第一的配体对(图2b);并且,CXCL16和CXCR6分别在小胶质细胞和T细胞簇中高表达(图2c)。而后发现CXCL16在5xFAD小鼠的微胶质细胞中的表达适度增加(图2d)。这些结果表明在多种AD小鼠模型中存在CXCL16-CXCR6介导的小胶质细胞和CD8+T细胞之间的通讯。另外发现,晚期AD患者死后脑组织中CXCL16的表达上调(图2e),数据集分析也有明显体现(图2f);CXCL16基因表达主要在小胶质细胞中上调(图2g)。因此表明CXCL16在小鼠AD模型和人之间的保守调节。
3. CXCR6的缺失导致了5xFAD小鼠的认知能力下降
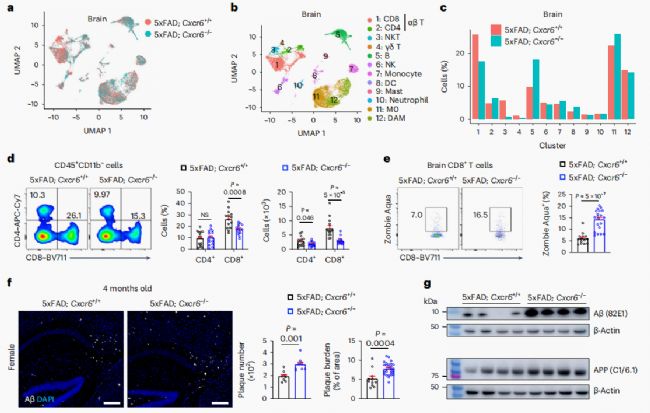
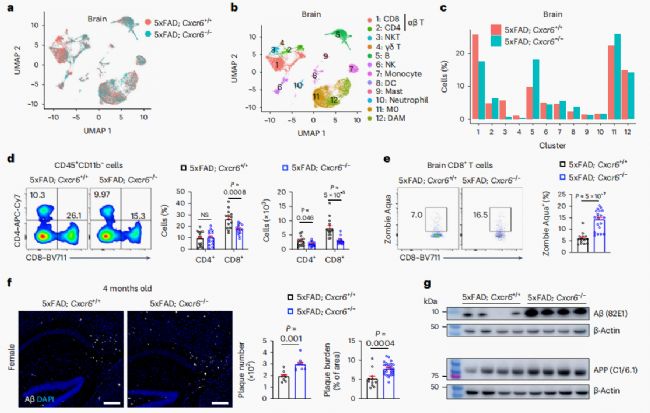
构建CXCR6缺陷的5xFAD小鼠(5xFAD; CXCR6-/-)对其大脑中的免疫细胞谱展开研究(图3a,b)。5xFAD; Cxcr6-/-小鼠脑CD8+T细胞或CD3+T细胞减少(图3c,d)。机制上,来自5xFAD; Cxcr6- / -小鼠细胞中的CD8+T细胞显示细胞死亡增加,但增殖状态正常(图3e)。因此,CXCR6对5xFAD小鼠大脑中CD8+T细胞的积累和存活很重要。进一步免疫染色确定雌性5xFAD; Cxcr6-/-小鼠都加重了Aβ沉积(图3f-g)。这表明这些小鼠AD病理的增强与Aβ斑块的总体数量增加有关,与表型无关。总之,CXCR6缺乏症与5xFAD小鼠脑CD8+T细胞的减少和疾病病理加剧相关。
4. CXCR6协调脑CD8+ T细胞的克隆扩增
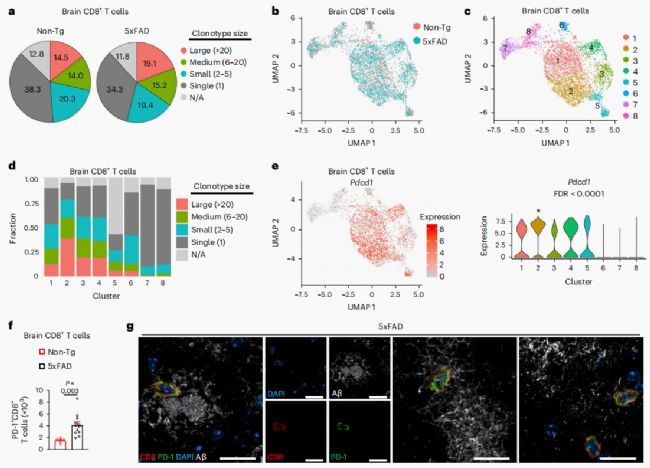
配对的scRNA-seq和scTCR-seq分析发现,大脑中的克隆扩增增加,在5xFAD小鼠中高度扩增的CD8+T细胞克隆,特别是克隆型大小>20的CD8+T细胞克隆占脑CD8+T细胞总数的比例更大(图4a)。鉴定出了8个亚簇(图4b,c),其中许多亚簇包含以高表达Pdcd1为特征的扩展克隆型,尤其是亚簇2(图4d,e)。此外,5xFAD小鼠的脑PD-1+CD8+T细胞显著增加(图4f),进一步支持脑内疾病相关克隆扩增。此外,成像分析显示CD8和PD-1在5xFAD小鼠和AD个体的大脑中共表达(图4h)。这些结果表明,PD-1上调发生在5xFAD小鼠大脑中的CD8+T细胞,并且PD-1的表达在很大程度上可区分克隆扩增与非扩增的CD8+T细胞。
5. CD8+T细胞抑制小胶质细胞的促炎活性
共聚焦成像显示5xFAD小鼠在Aβ斑块附近CD8+T细胞或CD3+T细胞与Iba1+小胶质细胞共定位(图6a)。接下来研究了CD8+T细胞积累对体内小胶质细胞炎症状态的贡献。5xFAD; B2m-/-和5xFAD; Cxcr6-/-小鼠的小胶质细胞TNF-α和pro-IL-1β表达增加或呈上升趋势(图6d、e)。此外,对小胶质细胞进行分析发现TNF-α信号信号在5xFAD; Tcra-/-小鼠的两个小胶质细胞亚群和5xFAD; B2m-/-小鼠的M0小胶质细胞中都富集(图6i,j)。总之,这些结果表明,脑CD8+T细胞的缺失或减少可导致小胶质细胞炎症状态升高。
结语
共表达CXCR6和PD-1的大脑驻留CD8+T细胞,存在于患有阿尔茨海默病(AD)人和小鼠大脑的斑块相关小胶质细胞中。CD8+T细胞会阻碍AD进展,包括β淀粉样蛋白沉积和认知能力下降。配体-受体相互作用分析可识别小胶质细胞和CD8+T细胞之间存在的CXCL16–CXCR6细胞间通讯。Cxcr6缺乏会损害脑PD-1+CD8+T细胞的积累、组织驻留和克隆扩增。Cxcr6或CD8+T细胞缺失最终会增加小胶质细胞中促炎细胞因子的产生,该研究强调了免疫系统和细胞间通讯在神经退行性疾病中的重要作用。
参考文献:
Su W, Saravia J, Risch I, Rankin S, Guy C, Chapman NM, Shi H, Sun Y, Kc A, Li W, Huang H, Lim SA, Hu H, Wang Y, Liu D, Jiao Y, Chen PC, Soliman H, Yan KK, Zhang J, Vogel P, Liu X, Serrano GE, Beach TG, Yu J, Peng J, Chi H. CXCR6 orchestrates brain CD8+ T cell residency and limits mouse Alzheimer's disease pathology. Nat Immunol. 2023 Oct;24(10):1735-1747. doi: 10.1038/s41590-023-01604-z. Epub 2023 Sep 7. PMID: 37679549.





