光合气体交换测量指南
本综述文章概述了光合作用气体交换测量的基本原理,并就如何获取测量数据和正确解释数据提供最佳实践指南。它旨在为新手提供气体交换技术方面的坚实基础,同时也为有经验的研究人员提供参考。
通过光合作用气体交换测量,可以从机理上深入了解植物叶片中碳和水通量的基本过程,进而了解从单个细胞到整个生态系统等不同尺度的相关过程。鉴于光合作用对全球气候讨论的重要性,学界普遍认为以下两点需要提升:1.广大研究人员应对所使用实验方法的基本原理有最基本的了解;2. 明确相关研究的最佳实践指南和正确的数据解释。2024年2月6日,Plant, Cell & Environment杂志刊发了英国伯明翰大学等多家单位署名的综述文章,标题为A guide to photosynthetic gas exchange measurements: Fundamental principles, best practice and potential pitfalls。在该综述中,Florian A. Busch等人概述了可通过气体交换测量方法研究的光合作用生物化学和生物物理参数,并就如何可靠地测量这些参数提供了逐步指导。此外,文章还提供了使用气体交换设备的最佳实践建议,并强调了实验设计和数据解读中可能存在的误区。补充信息包含示例数据集、实验方案和数据建模流程。这篇综述是一项团队协作的成果,旨在让实验研究人员和数据建模人员扎实了解气体交换测量的理论基础、不同实验方案背后的原理以及数据解读方法。

几十年来,使用红外气体分析仪(IRGAs)的气体交换技术已被广泛用于测量进出叶片的CO2和H2O通量,非叶片组织的通量测量则较少使用。通过这些测量可以评估叶片的生理活性,并确定光合作用的生化能力。对叶片水平气体交换的测量有助于从机理上理解决定碳和水通量的分子过程,并为理解生态系统功能提供信息。目前的商用气体交换系统在腔室设计和分析器设置方面的技术创新由来已久,这些系统精确、便携,而且相对易于使用。从热带到北极,从草原到森林再到农田,这些系统广泛应用在不同的生态系统中原位测量光合作用二氧化碳同化(A)和气孔导度(gs)。
气体交换测量可检验叶片和大气之间的CO2和H2O通量如何随着叶室内环境条件的变化而变化,以及不同环境条件下的长期生长如何影响光合作用的速率、生化能力和扩散限制。气体交换测量还增进了人们对进行不同类型光合作用物种(如 C3、C4和CAM)的生理学了解。
学界之前曾出版过几本气体交换入门指南,大多侧重于特定测量技术的细节。在下文中,Florian A. Busch等人将概述可通过气体交换测量来研究的生物化学和生物物理相关的光合作用过程,并概述可估算的参数。然后,文章还将讨论在C3植物中利用光合气体交换技术量化这些参数的合适方法,C3植物是光合作用的主要途径。不过,在许多情况下,这些方法经适当修改后也可应用于C4或CAM光合作用的物种,本文同样会涉及一些。
虽然使用目前市售设备记录气体交换数据相对容易,但获得的数据并不一定有意义。正确的实验设计和数据解释对于获得高质量的信息至关重要。因此,Florian A. Busch等人在本综述中提供了以往指南中没有的 "操作方法"提示。当然,商用气体交换设备的具体设计因制造商而异,读者应参考制造商的操作手册。我们的建议和术语基于当前的通用做法,但在我们认为新方法有益的地方会有所偏离。其中尤其包括对光响应曲线拟合的新建议。因此,这篇综述将为新手打下坚实的技术基础,同时也为经验丰富的研究人员提供一些新思路。总之,作者的目的是概述有助于成功测量的步骤,但同时也注意到,这些建议可以而且可能必须针对具体的研究问题进行修改。
从气体交换测量获得的关键参数
光合作用的CO2固定是一系列复杂生物化学和生物物理过程的结果,其中许多过程都可以通过气体交换技术进行测量。气体交换测量可让我们了解碳和水关系的各个方面,从与依赖光和不依赖光反应相关的过程到CO2/H2O扩散和叶片的吸收汇能力。气体交换测量直接提供给我们的唯一信息是CO2和H2O的浓度以及相关的净通量。不过,根据某些假设,可以从这些数值间接估算出一系列参数。这些参数可粗略地分为三类(图1,表1):第一类说明了叶片的"最大"能力,该类型的参数描述了叶片在不同光合作用方面投入的内在特性。这些参数可能对温度有固定的反应,也可能在叶片的整个生长过程中发生变化,但在其他情况下可被视为常数。第二类是叶片当前的生理状态,即测量期间实现的 "瞬时"或 "有效"速率。这些变量会随着光照强度、大气[CO2]或水分状况等环境条件的变化而在短期内(几秒到几小时)发生变化。第三类包括描述光合作用性能在某些特定方面的参数,这类参数可能并不直接对应某个单一可识别生理性状。例如,A从一种生化限制过渡到另一种限制时的CO2浓度,或限制A 的不同生理过程的相对贡献。

图1. 如何为自己的研究问题选择正确的测量参数。光合特性可分为描述生化和气体扩散特性的性状以及进入或流出叶片的气体通量。因此,第一步是确定气体交换测量要评估的性状大类。然后是所关注的光合特性是与叶片的固有特性有关,还是与叶片在特定环境条件下的运行状态有关。其他更具描述性的特性也可以通过气体交换测量来估算。为支持研究问题,文章给出了可以量化的参数,以及适用每种参数的实验方法,详细说明见补充资料 S1。参数和变量的定义见表 1。
表1 环境条件下的光合气体交换参数、单位和典型值
光合作用生理生化过程的最大气体交换能力由三个变量决定:1. 1,5-二磷酸核酮糖(RuBP)羧化的最大速率(Vcmax)代表卡尔文-本森-巴塞尔循环(CBB)中 RuBP 的消耗能力,其中核酮糖-二磷酸羧化酶-加氧酶(Rubisco) 被认为是关键的限速步骤。2. 光合电子传递的最大速率(Jcmax)代表参与 RuBP 再生的所有过程,它被认为受到光系统 II(PSII)的水分分解速率和/或通过细胞色素 b6f 的电子传递速率的限制。Vcmax和 Jcmax是叶绿体二氧化碳浓度(或Jcmax的光照强度)为无限时理论上可以达到的速率,除 Rubisco羧化(或电子传输)外,没有其他过程受到限制。3. 磷酸三糖的最大利用率Tpmax与叶绿体合成淀粉或输出蔗糖的能力有关。Tpmax可能反映了其他植物器官代谢或储存新同化物的限制,因此是描述植物整体吸收能力的 CBB 循环的下游。这三个参数是模拟 A 对环境条件反应的核心。
一组参数描述了特定环境条件下净CO2或H2O交换的最大速率。例如,Amax描述的是当光照和[CO2]达到饱和,Rubisco 加氧受到很大抑制时的最大CO2同化速率。Asat是环境CO2浓度和光饱和条件下的净CO2同化率,因此是自然环境光照波动条件下可达到的最大同化能力的良好指标。在一定温度范围内的最大CO2净同化率称为 Aopt。该参数有助于从功能上描述净光合作用对温度的响应。
在CO2同化通量进入叶片的同时,CO2还通过线粒体、叶绿体和细胞质中的脱羧过程从呼吸和光呼吸中释放出来。为简单起见,并与传统术语一致,这里将非光呼吸的CO2释放总和称为"线粒体"呼吸。黑暗中的呼吸速率(Rdark)在昼夜间有些变化,但总体而言是叶片线粒体活动的良好指标。Rdark是衡量植物在24小时昼夜过程中总体碳吸收量的一个重要参数,因为呼吸作用在整个夜间持续进行,抵消了白天的碳增量。由于碳吸收量是光合作用的CO2吸收量和呼吸作用的CO2释放量的组合,要模拟白天的碳吸收量对环境条件的响应,就必须了解光照下的呼吸作用(Rlight)。一些证据表明,呼吸作用在光照下会受到部分抑制,这突出表明需要对Rlight进行单独测量,以确定光合作用模型的参数。也有观点认为,Rdark和Rlight之间的差异可能在很大程度上是由于光照强度变化时叶绿体CO2浓度(Cc)发生了不可解释的变化,这意味着对 Rdark的测量可能足以对模型进行参数化:Rdark和Rlight通常指的是流出叶片的呼吸通量,而光合作用模型通常基于细胞内水平的呼吸通量(表示为Rd)。它们的区别在于流出叶片前被再固定的CO2量,据估计,从线粒体到细胞间隙的过程中,再固定的CO2量约为 24%-38%。如果假定光照不会抑制呼吸作用,则可将Rd设为Rdark。值得注意的是,作为叶片层面的属性,呼吸作用与CO2同化的符号相同,是一种 "正 "通量,尽管方向相反。
描述特定环境条件下光合作用有效特性的最重要变量是瞬时CO2净同化速率(A;通常也称作Anet)和蒸腾速率(E),这可以通过气体交换直接测量(见Box1)。根据这些变量,我们可以估算出植物在当前条件下的瞬时水分利用效率(WUE),即A与E之比。然而,E不仅取决于植物的生理状态和气孔的开放程度,还受到叶片内部与周围空气之间的蒸汽压差(VPDleaf)的很大影响。因此,E本身并不能告诉我们植物的内在状态,也不能告诉我们 WUE如何随着环境条件的变化而变化。因此,内在水分利用效率(iWUE)是对H2O损失和CO2吸收之间权衡的一种更生理学的描述,它表示为A与气孔对水蒸气的导度(阻力的倒数)之比(gsw)。

除了生化参数的最大能力外,我们还可以从气体交换中获得在特定环境条件下实现的相应值。实际光合电子传递速率(Ja)与依赖光的光合反应的当前状态有关,既反映了可用于驱动电子传递的光能,也反映了当前利用CBB循环中产生的NADPH和ATP的能力。与光无关的光合反应活性由Rubisco当前的羧化速率(Vc)和氧合作用速率(Vo)表示。根据这两个参数,我们可以推断出通过 CBB 循环和光呼吸途径的通量。最后,我们还可以量化任何特定环境条件下磷酸三糖的有效利用率(Tp)。这四个参数都不是通过气体交换直接测量的,而是借助下文所述的光合作用生化模型从A和E中推导出来的。
气体交换测量还可提供具有描述性的其他参数,有助于植物或处理之间的比较。这些参数包括A达到光饱和(Isat)时的入射光强度(Iinc;通常也称为Q)、光补偿点(Ic)和CO2补偿点(Γ),它们描述了光合作用和呼吸作用达到平衡(A=0)时的光强度或CO2浓度,以及光合作用达到最佳(Topt)时的叶片温度(Tleaf)。我们甚至可以通过限制分析得出参数,回答 "如果 "问题,限制分析的目的是量化由于气孔或生化限制而放弃的CO2吸收量。例如,相对气孔限制(ls)探究了气孔干扰CO2扩散导致A值减少的程度,或者相对生化限制(lb)量化了 Rubisco未完全激活对A值的相对影响。
上述一长串参数虽然并不全面,但却体现了可以从光合气体交换测量中提取的信息的多样性。它们提供了有关植物生理状态的重要信息,并可随着植物的老化和发育或对环境因素的反应而进行跟踪。要量化每个参数,都需要遵循一定的测量策略。虽然可以通过相对简单的调查测量来研究瞬时光合通量、呼吸通量和透气通量,但确定光合气体交换能力和限制的参数和性状需要对A对环境参数(如[CO2]、光照或温度)的反应进行更复杂的测量。下面我们将介绍哪些测量方法最适合获得所选参数,以及如何控制IRGA以获得可靠的数值。
测量和解释光合作用气体交换具有挑战性,主要有两个原因。首先,在测量过程中,光合作用对光照、温度、湿度和空气中的气体成分反应强烈,这意味着在测量光合作用本身的同时,需要严格控制和测量这些因素。其次,虽然气体交换测量通常确定的是净气体交换量,但观测结果通常反映的是几种综合过程的总通量。例如,CO2净交换量包括 CBB 循环中与RuBP羧化相关的CO2吸收通量,以及呼吸作用和光呼吸过程中释放的CO2。在一系列不同条件下进行的测量使我们能够将这些净通量分解为其总成分,这将在随后的章节中进一步解释。
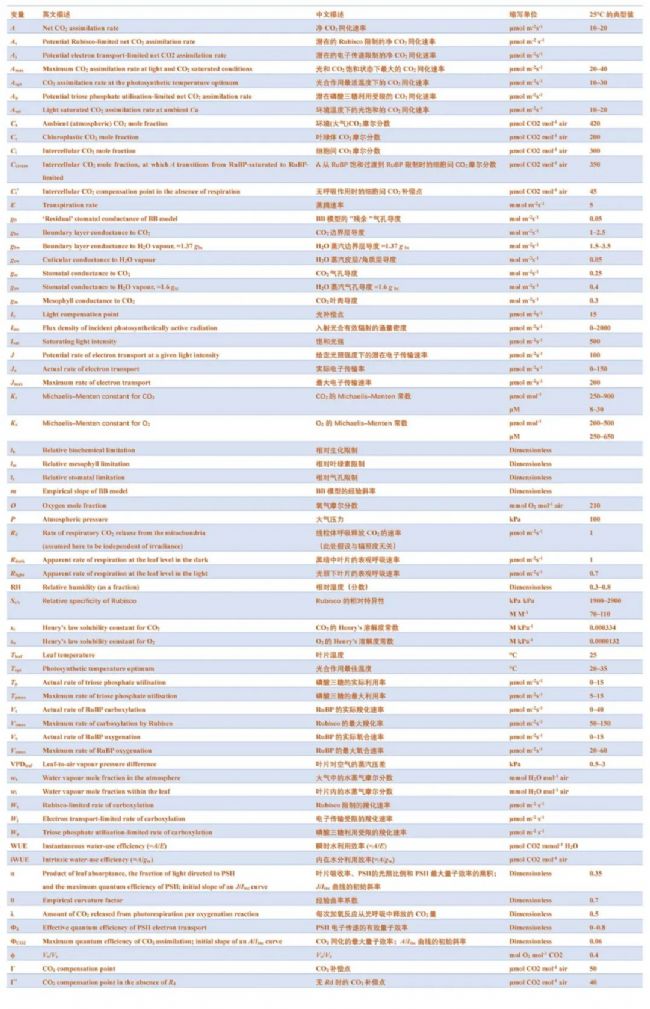
光合气体交换的决定因素可分为扩散限制和生化限制。CO2要被C3植物固定,首先必须穿过叶片周围静止空气的边界层,然后通过气孔穿过表皮层,到达叶片的细胞间气体空间(IAS)。在到达CO2固定地点之前,还需要经过细胞壁、质膜、细胞质、叶绿体包膜和部分基质等一系列扩散障碍(见图 2)。从周围空气(Ca)到 IAS(Ci),再从 IAS 到叶绿体基质(Cc)的CO2浓度梯度推动了这一扩散途径中的CO2净转移。这些梯度是由叶绿体基质通过 CBB 循环及其中心酶Rubisco的活性吸收CO2形成的,而CBB循环及其中心酶Rubisco的活性又依赖于叶绿体类囊体膜上光化反应产生的ATP和还原剂NADPH。
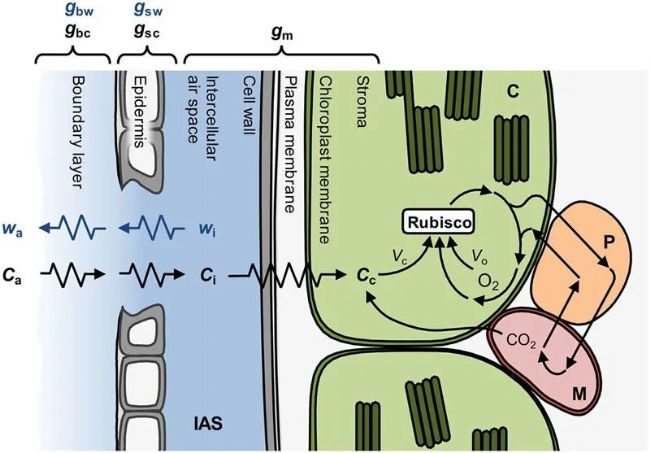
图2. 叶片内H2O和CO2扩散示意图。如果已知边界层对H2O扩散的导度(gbw),那么通过气孔排出叶片饱和细胞间气体空间(IAS)(wi)中的水蒸气可用于通过测量大气中的水蒸气浓度(wa)来量化气孔对H2O扩散的导度(gsw)。在气体交换测量过程中,使用高速风扇的气体交换室会将边界层降至最低,因此可以使用经验值对其进行合理的计算。由此,我们可以描述CO2反向扩散到IAS的路径,还需要额外的信息来描述向叶绿体(C)扩散的路径。通过边界层(gbc)、气孔(gsc)和叶肉(gm)进行CO2扩散的有限传导可被视为扩散阻力,它导致大气中的CO2浓度(Ca)逐渐下降到细胞间隙中的CO2浓度(Ci)和叶绿体中的CO2浓度(Cc)。Cc和叶绿体中的氧气浓度决定了Rubisco羧化(Vc)和加氧(Vo)的相对速率。在加氧反应之后,光呼吸CO2从线粒体(M)中释放出来,其中还涉及过氧物酶体(P)中的一些反应。
要分析光合作用的生化限制,首先需要确定CO2转移的扩散轨迹参数。在这方面,需要同时测量水蒸气交换。与进入叶片的CO2净转移类似,叶片外的水分转移也是由扩散决定的。从水蒸气可被假定为饱和(或在中低VPD条件下接近饱和)的IAS开始,水蒸气沿着蒸汽压力梯度向叶片周围较干燥的空气扩散。在大多数情况下,蒸腾作用造成的水分损失主要与通过气孔的扩散转移有关,不过观测到的水分释放率也可能包括通过角质层从叶片中流出的水分(见Box2)。

光合作用机理模型
除A、Rd和E外,大多数光合作用气体交换参数都无法直接测量,而是借助生化模型,根据A对环境参数(如CO2浓度或光照强度)变化的反应推导得出。对于C3光合作用,通常采用Farquhar等人1980 年提出的模型(以下简称 FvCB),von Caemmerer在2000年对该模型进行了更详细的描述。我们对FvCB模型进行了简明扼要的概括,并采用了一些对参数估计有用的修改(见Box3)。在其基本形式中,FvCB模型侧重于光合作用吸收CO2的主要原理,并将CBB循环反应的全部内容浓缩为Rubisco的活动等。不过,该模型可以进行调整,以解决新问题和参数估计的需要。本文讨论的许多光合作用参数可以通过将机理模型与不同环境条件下获得的实验数据(如CO2浓度或光照强度)进行拟合来量化。

反过来,在已知光合作用参数的情况下,FvCB模型可以预测多种环境条件下的CO2同化。因此,FvCB模型已被广泛集成到冠层、生态系统和全球碳通量模型中。由于光合气体交换参数在地球系统模型中的核心地位,人们在描述模型参数的遗传、发育和环境变异方面做出了巨大努力。
在前面的章节中,我们讨论了可从气体交换测量中得出的主要光合作用参数,以及这些参数与我们对光合作用功能的理解之间的关系。补充资料S1中概述了一系列"如何"可靠估算这些光合作用参数的实验程序。其中包括调查测量、A/Ci响应、A/Iinc 响应、A/T响应、Laisk和Kok测量的程序,以及其他较少应用的光合作用测量的简要说明。对于补充资料S1中的建议,我们总结了整体来说我们认为的 "最佳实践"。不过,有必要重申的是,不同的问题需要不同的测量方法,而且每个实验装置在设备和可用时间方面都有不同的限制,因此必须做出折衷。因此,我们的建议应被视为设计个性化方法的起点。
估算光合作用参数的模型拟合程序
通过非线性曲线拟合程序,可从CO2响应曲线(即Vcmax、J和Tpmax)和光响应曲线 (Jmax)估算光合作用能力参数,以最大限度地减小收集的CO2同化数据(A)与根据 FvCB 方程(公式18)模拟的基本预测A之间的差异。常用的数据分析工具包括基于Excel电子表格的光合响应曲线拟合方法、用于获得类似非线性拟合输出的R软件包(如plantecophys、plantecowrap、photosynthesis和msuRACiFit),甚至还有返回拟合数据的在线服务(如 leafweb.org)。尽管无论使用哪种工具,标准的A/Ci曲线拟合程序都基于相同的理论,但由于方法的特定固有假设和缺点,参数估计会出现差异。例如,基于电子表格的拟合工具对许多熟悉Excel求解器插件的生理学家来说都是可用的,但要求用户对限制因素做出判断,并指定从RuBP饱和到RuBP限制A的过渡,以分别求解Vcmax和J。因此,使用这种方法进行估算需要依靠用户经验做出主观判断,而且必须对每条曲线进行独立分析。虽然这种方法可以深入了解支持每项测量的数据,但却阻碍了大规模分析。广泛使用的 plantecophys R软件包通过在收集到的整个二氧化碳范围内将数据拟合为Ac、Aj和Ap的双曲线最小值,从而避免了靠经验指定数据限制的需要,不过过渡点可以固定,以便根据假设检查拟合结果。采用基于编码而非电子表格的曲线拟合程序的一大优势是减少了每条曲线的分析时间,提高了通量、可重复性和可共享性,但这取决于用户对编程语言的适应程度。下一代R软件包正在出现,包括光合作用软件包,其中不仅包含拟合A/Ci曲线的功能,还包含拟合A/Iinc曲线、Rlight、叶肉和气孔导度以及水力曲线的功能。在这一点上需要注意:不同统计软件包之间的参数符号可能并不统一,可能与本文不同。同样,用于拟合数据的函数也存在差异,尤其是用于拟合A/Iinc反应的函数。
FvCB模型的准确性取决于对Rubisco动力特性的正确表述,并需要对Rubisco Michaelis–Menten常数(Kc、Ko或空气中的有效值Km)和Γ*及其温度依赖性(公式 22和23)进行估算。现在已经从体外测量中获得了这些参数的许多特定物种估计值,并显示出物种间的巨大差异。然而,使用Rubisco动力温度响应的体外估算值可能会产生A的模型值,随着温度向冷暖极端移动,这些值会偏离观察到的测量值。使用这些温度函数需要假设体内条件,如pH值和二氧化碳向羧化部位的扩散,体外测定条件的差异可能会使这一假设变得更加复杂。但另一方面,体外获得的动力学参数不需要知道Cc或每次 Rubisco 加氧反应释放的CO2量(λ),这可能是最重要的误差来源。光合作用对氧气或二氧化碳浓度变化的敏感性可独立确定光合作用的基本限制。
影响二氧化碳响应曲线估计值的另一个参数是叶肉导度(gm),它影响叶绿体内二氧化碳的有效分压,因此会影响拟合的Vcmax。低gm会降低A/Ci曲线的曲率,如果有独立的测量值,电子表格和基于编码的曲线拟合工具都可以将其考虑在内。如果没有独立的测量值,则可通过在等式 22 和 23 中用(Ci - A/gm)代替Cc,并使用非线性曲线拟合来估算gm,以尽量减少与观测数据之间的差异。独立的gm测量值可通过稳定碳同位素技术、气体交换与叶绿素荧光测量相结合或曲线拟合等方法获得。曲线拟合法假定gm恒定不变,而稳定碳同位素技术可用于评估gm在不同环境条件下的变化情况。
气体交换(光合仪)的良好操作规范
测量前的基本检查
在机器预热期间,执行制造商建议的测试。这可能包括检查温度参数和传感器的准确性和响应性、照明控制和叶室气体混匀风扇的功能。
定期标定和校准机器
由于老化(如红外光强度降低)或由于吸收红外线的颗粒(如灰尘)累积而衰减,红外气体分析仪的信号会随时间漂移。除了定期对IRGA的CO2和H2O进行零点标定之外,在测量开始前或对IRGA进行维护(如清洁光学工作台)时,根据低浓度和高浓度的参考气体(截距和斜率)标定IRGA的跨度也是一个不错的做法。对不同机器使用相同的标定气体可提高测量精度并减少仪器间偏差。
检查气路是否漏气
每次将叶片放入叶室夹紧后,都必须检查气路是否漏气。多孔海绵垫圈会吸收/释放 CO2和H2O,可能会导致叶室内外的微小通量。这些扩散通量的相对影响在二氧化碳响应曲线中使用的高[CO2]和低[CO2]条件下会加剧。如果外部CO2已知,通常可以对其进行校正(参见制造商的文档)。第二种漏气是由于垫片与叶片形状(尤其是主要叶脉)不完全吻合,导致垫片与叶片接触面出现缝隙。要检测这种漏气,应在监测室内[CO2]的同时将呼出的空气吹到腔室附近。如果室内的[CO2]没有出现尖峰,则表明没有严重的漏气。如果无法调整叶片在叶室内的位置以避免漏气,可小心使用真空硅脂密封叶室。如果无法避免漏气,则可采用几种方法进行部分校正。
检查密封垫片状态
海绵垫片通常具有弹性,以适应叶片的形状。然而,随着使用时间的推移,它们可能会偏离原来的位置或老化变平,从而降低与叶片保持良好密封的效果。建议在不进行测量时或在储存期间将叶室置于打开状态,以延长密封垫片的寿命。
在测量过程中检查稳定性
在进行叶片气体交换测量时,重要的是至少在短时间内(几分钟)进入叶室的空气中的 [CO2]和 [H2O]保持稳定。如果没有使用机器的气体混合器自动控制,则可以通过使用缓冲瓶来抑制环境气流的快速波动并实现进入仪器的气体浓度稳定。
监控系统参数
试验室条件会在无意中迅速变化,例如,叶片温度会随光照强度迅速升高,这也会影响VPDleaf。动态控制叶片温度而不是保持叶室温度恒定可以避免Tleaf的变化,但在光照强度变化后,由于进入的空气温度和水蒸气的快速变化与叶室条件达到新的平衡,可能会在测量中产生瞬时距离波动(如气孔导度的大幅飙升)。gs和/或VPDleaf的变化也会影响叶室内空气的相对湿度(RH),并有可能达到饱和状态。因此,务必时刻监测叶室内的露点温度,以避免出现冷凝现象,尤其是在低流速和高叶片蒸腾量的情况下。在输入控制此参数时对其进行查看也很重要,这样可以在时间过长而需要重复测量之前发现气孔闭合或CO2钢瓶耗尽等情况。
最大限度地提高信噪比
虽然叶室内气体的高流速可加快测量响应速度,但同时也会降低参考和样品IRGA之间测得的[CO2]和[H2O]差值。当浓度差值过小时,当IRGA的检测极限大于所测得的差值时,光合作用和气孔导度等计算数据就会变得嘈杂。减小通过叶室的气流可以增大差值,有利于提高信噪比。然而,这同时也会增加潜在漏气对测量的影响,因为空气在叶室内的停留时间更长,腔体压力更低,会加剧气体通过垫片的扩散泄漏。流速越低,叶片蒸腾作用对湿度控制的影响就越大,因为水蒸气会在叶室内积聚。建议从制造商推荐的流速值开始,然后根据叶片的反应进行调整。
调整光质组合比例
辐射光源通常由红色和蓝色波长的LED组合而成。长期以来,默认情况是高比例的红光用于驱动光合作用(90%),少量蓝光用于刺激气孔开放(10%)。由于叶片吸收率取决于波长,不同比例的红光和蓝光强度会导致不同的光合作用测量值。关于红光和蓝光重要性的传统观点受到了质疑,因为有些物种对蓝光没有反应,而其他波长的光,如绿光和远红光,可能在推动光合作用方面发挥重要作用。
匹配 IRGA
根据所使用的气体交换系统,叶室内外的CO2和H2O可能由两个不同的IRGA测量,如果它们的标定或响应稍有不同,就会产生系统偏差。为了解决这个问题,可将相同的空气同时通过两个IRGA,并通过电子方式将浓度读数"匹配"为相同的值。通常在[CO2]和/或[H2O]发生变化或设定时间(如30分钟)后对IRGA进行匹配。过于频繁地进行匹配,尤其是当[CO2]和/或[H2O]发生瞬时变化时,可能无法获得更准确的测量结果。通常最好等测量结果稳定后再进行匹配(但这取决于系统,请查阅制造商手册)。对于长期测量(如昼夜动力学),必须定期进行匹配,因为IRGA随时间的漂移可能会妨碍昼夜节律对光合作用影响的解释。
选择合适的叶室尺寸
理想情况下,气体交换室的大小应与叶片尺寸成正比,因为当叶片覆盖整个气体交换室时,设置通常更容易操作。对于较小的叶室,由于空气容量较小,反应时间较快,而较大的叶室则受叶片异质性(如气孔斑块)的影响较小,两者之间需要权衡。气孔斑块是一种空间或时间异质性,可能由相邻气孔之间的水力相互作用引起,并影响细胞间CO2浓度测量的准确性。因此,气体交换叶室的大小应与实验的要求和目的相匹配。
叶室气流混匀风扇的转速
叶室气流混匀风扇可降低叶片周围的边界层。叶室气流混匀风扇的高转速可将边界层降至最低,确保叶室内空气充分混合,从而降低真实gs值的不确定性。在使用定制叶室设置时,请使用大功率风扇以确保叶室空气的良好混合。值得注意的是,对于给定的VPDleaf,室内边界层的减少意味着叶片比室外的叶片失水更多,如果有足够的时间,这可能会影响gs。因此,尽管环境条件可能相同,但叶室内外的叶片所处的"真实环境"并不相同,。
除了对边界层的影响外,高风扇转速还能促进空气与叶片表面以及叶室壁体之间的热交换。当测量温度低于环境温度时,低风扇转速可能会成为一个问题,因为热交换受阻会导致叶室内冷却不足,进而产生冷凝问题。
保持叶室清洁
叶室内的灰尘和污垢会吸收和释放气体,从而干扰测量,尤其是当腔室内的条件快速变化时。当异物积聚在IRGA中时,会造成信号噪音并减弱信号强度。小动物(如蜘蛛、蓟马)会导致信号出现不稳定的尖峰,因此在将叶片插入叶室内之前必须检查叶片表面。尽量不要使用被害虫破坏或受伤的叶片进行测量,因为它们会显示出高蒸腾速率,而这并不是气孔开度的结果。在田间测量时,确保将主机架离地面,以减少灰尘通过进气口进入系统。
定期检查化学药品的性能
在开始一系列新的测量之前,必须使用新鲜的化学试剂(如碱石灰和硅胶/干燥剂),以避免在测量过程中出现环境控制问题。大多数化学试剂都具有颜色指示功能,可以帮助判断何时需要更换。在IRGA零点标定时,向进气口吹气有助于评估碱石灰的性能:在分析器CO2零点标定的情况下,不应有CO2通过气路。
修正测量的叶面积
在某些情况下,室内的叶片不能完全覆盖整个测量区域,因此需要手动确定并输入一个值。叶面积可以通过叶片在腔体内的照片得出(如果是透明顶腔),也可以用笔标出垫片的位置,然后拍摄照片。然后可以使用成像软件(如开源图像处理软件包ImagJ)来估算面积。对于禾本科植物的叶片来说,测出叶片在叶室两侧的宽度通常就足以根据矩形形状估算面积。由于光合通量以面积为基础,因此要尽量避免叶片面积估算的误差。
合理选择要测量的叶片
大多数研究都使用最新完全展开的叶片进行测量。然而,在植物冠层内,由于光照梯度和叶龄的不同,光合作用能力存在很大差异。因此,在选择测量植物的叶片时必须保持一致,并考虑时间因素,如长期实验中的叶片老化。
应避免的 8 个"坑"
结露/冷凝
当叶室内空气的露点温度接近任何系统组件的最低温度(通常是叶室壁体温度)时,就会出现冷凝现象。尽管通常无法直接看到冷凝现象,但它仍会导致光合作用测量结果无效。一旦检测到冷凝现象,就需要在进一步测量之前将机器烘干。为确保良好的湿度控制,测量前应确保干燥剂新鲜,IRGA正确归零。在测量过程中,我们建议相对湿度不要超过85%。通过确保空气露点温度始终比叶片、空气或测量室温度的最低值至少低一度来控制湿度,可防止测量室内形成高相对湿度和冷凝水。特别需要注意测量室壁的温度,因为这是最有可能出现冷凝水的地方。在将叶片放入测量室后的几分钟内要特别注意,以确保在气孔适应新条件时,蒸腾作用不会导致相对湿度过高。如果仅靠湿度控制无法维持设定湿度,需要降低湿度,则可提高叶室控制温度和/或流速。
胞间CO2浓度Ci负值
作为空气中CO2分子的摩尔分数,Ci值应始终为正值。如果叶室中出现冷凝现象,Ci值的计算就可能不正确,从而出现负值。在低[CO2]时的CO2响应曲线中,发生这种情况的风险尤其大,因为此时气孔往往打开得最多。对于不能自动调节相对湿度以防止冷凝的机器,请遵循上述避免叶室内冷凝的建议。
漏气
漏气的主要原因通常是通过固定叶片在测量头上的垫圈、未接牢固的排气管、测量头连接点上损坏的O形环以及干燥剂药品管接头密封不严造成的。流量无法达到设定点,CO2值波动较大,无法达到高于空气的CO2控制值,都可能表明存在漏气。如果怀疑有漏气,请进行以下检查(另请参见 "良好操作规范"部分):
1.测量头是否正确关闭,密封垫是否完好?如果老化导致密封不良,请更换密封垫片。
2.排气管是否正确连接到测量头和主机?
3.加湿剂和干燥剂管是否正确安装就位,盖子是否密封,空气过滤器是否完好?
4.热电偶是否安装正确?
5.检查所有O形环,更换损坏的O形环。
气孔关闭
如果gs过低,例如当植物处于干旱胁迫时,则很难获得较高的Ci值和有用的A/Ci响应。对于这些测量,适当调整VPDleaf非常重要,因为过度蒸腾是造成气孔关闭的主要原因:一般来说,为避免气孔关闭,VPDleaf不应超过1.5千帕,同时需要确保相对湿度不超过 85%,以避免冷凝。适合大多数测量的VPDleaf范围约为0.8-1.2千帕。适当的VPDleaf水平还取决于机器是否需要加热或冷却叶室以达到设定的测量温度。在前一种情况下,相对湿度为85%可能比较合适,而在后一种情况下,高的相对湿度则会导致冷凝。保持植物水分充足,不要在测量前温度/湿度骤变的情况下接触植物,这很有帮助。如果尽管如此,气孔反应仍然非常缓慢,请检查光质设置(蓝光的贡献率至少应为10%,参见上文"调整光质")。也可将叶片短暂置于低[CO2](约100 μmol mol-1)环境中,这有助于诱导气孔开放。
环境空气与叶室之间的温差较大
测量空气的温度与叶室控制温度之间的差异过大,有可能导致冷凝或无法达到足够低的VPDleaf以确保气孔开放。此外,由于叶片热电偶测得的温度会受到周围空气温度的影响,因此叶室内空气与叶片之间较大的温度梯度可能会导致Tleaf不正确。通过使所有系统组件尽可能接近设定的Tleaf,可将这些问题降至最低。如果要在环境条件之外空间内进行测量,则应将整个气体交换系统和测量头置于气候受控的空间内,如生长室或培养箱。这样就可以将IRGA周围的温度设定在接近Tleaf的范围内,从而最大限度地减少温度梯度和冷凝现象,并扩大测量的温度范围。
热电偶接触叶片的位置
叶片热电偶必须正确安装,并在测量时接触叶片背面。如果不接触叶片,热电偶将测量叶室内的空气温度。如果推得太远,可能会撕裂叶片并弄弯热电偶。对于较大的叶室,单个热电偶可能不足以捕捉整个叶片的异质性,如果可以,请使用第二个热电偶。计算gs和Ci等许多参数都需要精确测量叶片温度,热电偶位置不正确或损坏会导致曲线拟合中光合作用能力的估算不正确。在无法接触叶面的情况下,可采用能量平衡法估算参数。
昼夜节律效应
许多物种以昼夜为周期进行光合作用,有些物种由于气孔关闭或在高温和强光条件下光保护或光抑制作用增强,中午光合作用明显减弱。在比较不同样品的光合作用能力时,应确保在gs不会过度限制光合作用时(即气孔基本开放时)进行测量。事先观察相关物种gs的昼夜变化规律,在一天中进行多组调查测量,有助于确定一天中什么时间最适合进行测量。
测量原位叶片与离体叶片
最好测量原位叶片,因为剪切叶片会导致叶片水势迅速发生变化,从而影响蒸腾和气孔导度反应。对于特定处理(如施用激素)或由于样品本身的特性限制(如大树冠层的叶片),可使用离体的叶片进行测量,但应注意对此类结果的解释,尤其是那些依赖于gs的结果。
重要提醒
原文页面的补充材料里有光合作用气体交换测量的实验流程,包含一般调查测量,A/Ci曲线(CO2响应曲线),A/Iinc曲线(光响应曲线) ,A/T曲线(温度响应曲线) ,Laisk方法测量光照下叶片的表观呼吸速率和无呼吸作用时的细胞间CO2补偿点, Kok方法测量 光照下叶片的表观呼吸速率Rlight以及其他常用光合作用气体交换测量方法的流程。
由于相关文章内容非常专业,难免有些理解不准确或者编辑整理的疏漏。另外,本翻译稿省略了文中的参考文献、扩展阅读、缩写注释。因此强烈建议感兴趣的老师和同学阅读原文(OA)。

电话:021-32555118






