环境浓度环丙沙星对蓝藻的致死效应——抗生素-光合蛋白结合的影响
翼鬃麒科技(北京)有限公司自主研发型号YZQ-201A藻类光合仪 助力科研实验,完成本文章中必要的部分实验数据

作者:朱寅杰、姚诗诗
通讯作者:陶益
通讯单位:清华大学深圳国际研究生院
图片摘要
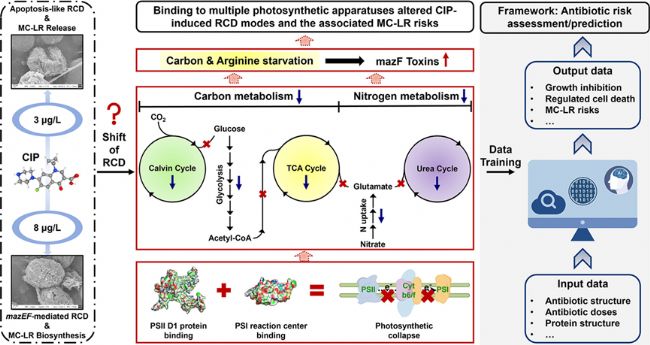
成果简介
近日,清华大学深圳国际研究生院陶益副教授团队在环境领域学术期刊Water Research上发表了题为“Variable cyanobacterial death modes caused by ciprofloxacin in the aquatic environment: Prioritizing antibiotic-photosynthetic protein interactions for risk assessment”的研究论文。文中识别了环境浓度环丙沙星在典型水华蓝藻铜绿微囊藻细胞内的多重靶位点:除了结合DNA回旋酶造成DNA损伤之外,环境浓度环丙沙星在不同暴露水平下对铜绿微囊藻不同光系统反应中心产生差异化结合。这种差异化结合造成蓝藻细胞内不同的碳氮代谢调控模式,使藻细胞在DNA损伤下执行不同的程序性死亡模式。本研究为进一步评估和预测环境浓度抗生素水生态风险提供了新的见解。
引言
不断排放到水环境中的抗生素能够和不同的光合蛋白表现出高亲和力结合,干扰光合生物的能量代谢和生长,进而影响水生态系统的初级生产力。然而,当前的研究将抗生素对光合生物的亚致死作用主要归因于对光系统II(PSII)蛋白的损伤,而忽略了PSI 蛋白作为潜在靶标的可能。在本研究中,我们研究了环境浓度(3-8 μg/L)环丙沙星(CIP)对典型水华蓝藻铜绿微囊藻的致死效应。研究发现,3-8 μg/L CIP通过损伤蓝藻细胞的DNA造成细胞程序性死亡。此外,在不同暴露水平下,CIP对不同光合蛋白存在差异化损伤并影响了蓝藻细胞的死亡表型。具体来说,3 μg/L CIP 仅同PSII的反应中心D1蛋白结合,上调了细胞三羧酸循环和脯氨酸分解代谢,以获取ATP。这有利于细胞类凋亡(AL-RCD)的执行。然而,除了结合PSII上的D1蛋白之外,8 μg/L CIP还能够和PSI的铁-硫簇中心蛋白结合,造成整条电子传递链的崩溃,诱导碳和精氨酸饥饿。这使藻细胞死亡模式从AL-RCD转变为 mazEF系统介导的RCD(mazEF-RCD)。此外,在AL-RCD和mazEF-RCD细胞中,MC-LR的被动释放水平和生物合成能力分别得到增强,表明CIP 暴露后MC-LR风险的提升。本研究强调了抗生素与不同光合蛋白之间复杂的相互作用,这些相互作用能够改变不同环境浓度暴露水平下抗生素的致死效应。从化合物-光合蛋白相互作用的角度出发,该项研究能为评估和预测环境浓度抗生素的生态风险提供新的视角。
图文导读
环境浓度CIP和光系统反应中心的结合
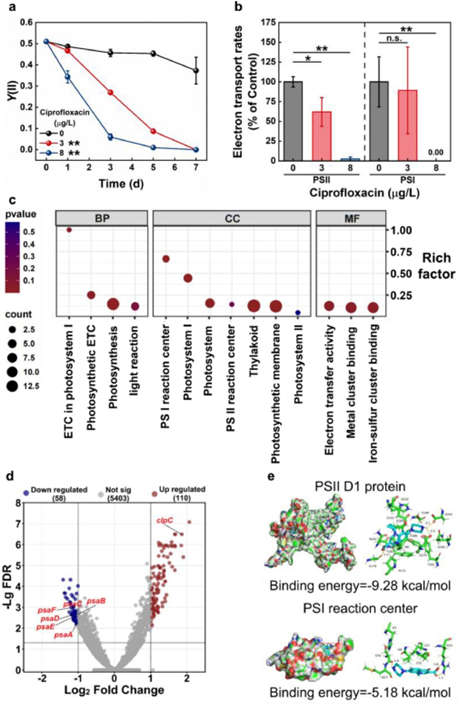
图1:环境浓度CIP胁迫下蓝藻(a) PSII光量子产率和(b) 光系统电子传递速率的变化。8 μg/L CIP暴露组vs3μg/L CIP暴露组差异基因的(c) GO富集分析和(d) 火山图。(e) CIP和PSII D1蛋白以及PSI Fe-S簇中心蛋白的分子对接。
首先,通过光合电子传递速率检测、PHYTO-PAM检测和转录组学分析评估了CIP暴露对铜绿微囊藻细胞光合系统的损伤。3 μg/L以上的CIP对PSII的有效光量子产率[Y(II)]造成浓度依赖的持久性损伤(图1a),并且降低了PSII中的电子传递速率(图 1b)。在3和8 μg/L CIP暴露的蓝藻细胞中,PSII的电子传递速率分别降低了38%和97%(图1b)。然而,在8 μg/L CIP暴露的蓝藻细胞中,PSI的电子传递完全崩溃(图 1b);而在3 μg/L CIP暴露下,蓝藻细胞PSI的电子传递速率并没有显著变化(下降约∼10%),表明该暴露水平对PSI微弱的损伤。通过比较3和8 μg/L CIP暴露下细胞的转录组数据发现,8 μg/L CIP暴露下蓝藻细胞的差异基因(DEGs)显著富集在PSI中(图 1c)。在这些DEGs中,psaC 是变化显著的下调基因[-1.21 log2|FC|,FDR = 0.00068]。
CIP对PSII D1蛋白具有更高的亲和力,但在高暴露水平下其也能够结合PSI Fe-S簇中心蛋白。通过分子对接计算验证上述结果。模拟计算结果显示(图 1e),CIP通过氢键和疏水作用力同PSII的D1蛋白和PSI的Fe-S簇中心蛋白分别产生-9.28和-5.18 kcal/mol的结合能,表明CIP对PSII D1蛋白有更高的亲和力;但是随着暴露水平的增加,CIP同PSI Fe-S簇中心蛋白的高亲和力导致了CIP对PSI的损伤。
环境浓度CIP造成的细胞裂解和毒素风险
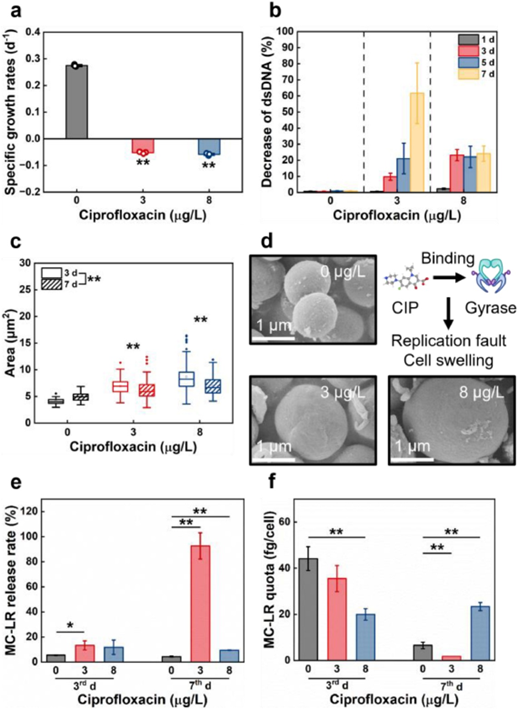
图2:环境浓度CIP胁迫下蓝藻(a) 比生长速率,(b)死亡率和(c)(d) 细胞尺寸的变化。MC-LR(e) 释放率和(f) 单细胞合成能力的变化。
3和8 μg/L CIP造成蓝藻细胞在21天暴露时间内持续的细胞裂解,裂解率达到70%左右(图 2a)。同时,在细胞持续裂解的过程中,蓝藻细胞的双链DNA(dsDNA)含量降低,死亡率增加(图 2b)。3 μg/L CIP暴露使蓝藻细胞的死亡率在7天内持续增加至60%左右(图 2b)。然而,在8 μg/L CIP暴露下,细胞死亡率在7天内稳定在25%左右(图 2b),这表明环境浓度CIP 在蓝藻细胞中引发了不同的死亡模式。除此之外,3和8 μg/L CIP暴露造成细胞尺寸的显著变大,增长至对照组细胞的1.5倍左右(图 1c和1d)。以上结果表明环境浓度暴露下蓝藻细胞DNA受到不可修复的损伤,最终导致细胞的死亡和裂解。
3和8 μg/L CIP造成了不同的MC-LR风险模式。3 μg/L CIP暴露使得MC-LR的被动释放水平在7天内较对照组显著提升9倍(图 1e),而单细胞合成能力得到抑制(图 1f)。8 μg/L CIP暴露则使得MC-LR的单细胞合成能力在7天内较对照组显著提升4倍(图1f),而释放水平则没有显著的变化(图 1e)。
环境浓度CIP造成的不同细胞程序性死亡模式
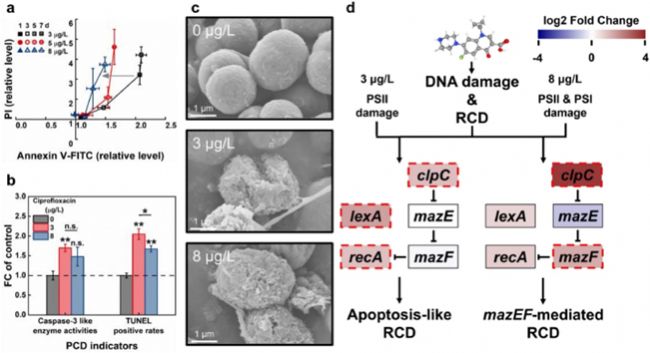
图3:环境浓度CIP胁迫下蓝藻(a) 膜通透性和磷脂酰丝氨酸(PS)外翻以及(b) Caspase-3酶活性和DNA断裂水平的变化。(c) 不同程序性死亡模式下细胞形貌的观察。(d) SOS响应和mazEF系统基因的表达模式。
3和8 μg/L CIP暴露使蓝藻细胞执行不同的程序性死亡模式。3 μg/L CIP暴露下,蓝藻细胞执行AL-RCD,主要表现为:PS外翻和膜通透化水平的同步升高(图 3a)、高水平的Caspase-3酶活性(1.7倍左右)和dsDNA断裂水平(2.0倍左右)(图 3b),以及持续的DNA降解(图 2b)。此外,3 μg/L CIP暴露下的细胞在形貌上表现出缩小、起皱的形态(图 3c)。基因表达水平变化上,3 μg/L CIP暴露下蓝藻细胞的SOS响应得到上调,而mazEF系统的基因表达没有显著变化(图 3d)。
多处证据表明8 μg/L CIP暴露下铜绿微囊藻细胞执行mazEF-RCD。在这些细胞中,膜通透化水平的时间变化显著快于PS外翻水平的时间变化(图 3a);同时,8 μg/L CIP暴露下细胞在形貌上表现出膜穿孔的形态(图 3c)。基因表达水平变化上,8 μg/L CIP暴露下蓝藻细胞的SOS响应显著下调,而mazEF系统中负责编码毒素蛋白的基因显著上调(图 3d)。
环境浓度CIP造成的不同碳氮代谢调控模式
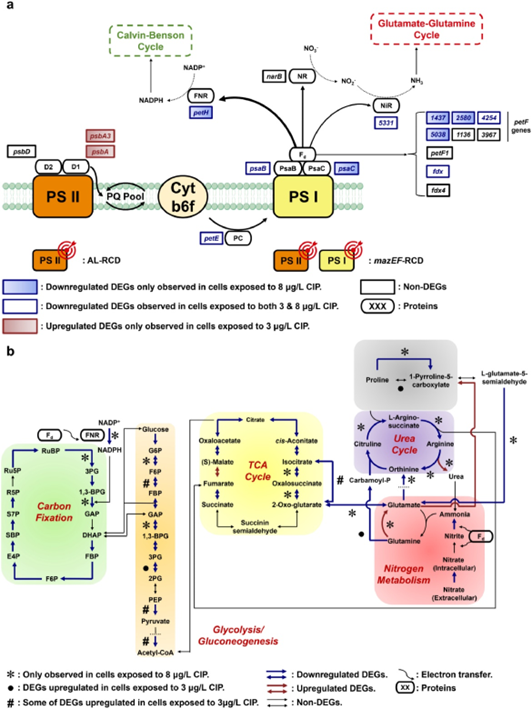
图4:环境浓度CIP胁迫下蓝藻(a) 关键光合蛋白编码基因和(b) 核心碳氮代谢路径的变化。
3 μg/L CIP暴露对PSII的损伤并没有对PSI末端铁氧还蛋白的合成造成显著的影响(图 4a),因而并没有对Calvin-Benson循环及其与糖酵解/糖异生的衔接产生严重的抑制(图4b)。同时,C₃H₄O₃和乙酰辅酶A合成的上调保证了三羧酸循环的进行。在三羧酸循环中,α-酮戊二酸的合成上调,这保证了碳氮代谢的有效衔接(图 4b)。除此之外,未受显著影响的铁氧还蛋白合成保证了谷氨酸盐-谷氨酰胺循环以及尿素循环的进行,并促进脯氨酸分解代谢(图4b),为AL-RCD的执行提供ATP并激活Caspase-3酶的活性(图 3b)。
8 μg/L CIP暴露对PSI的额外损伤使得铁氧还蛋白合成显著下调,造成Calvin-Benson循环,糖酵解/糖异生以及三羧酸循环过程的显著下调,导致蓝藻细胞碳代谢过程的崩溃(图4b)。除此之外,铁氧还蛋白合成下调同样造成蓝藻细胞氮代谢的下调,具体表现为HNO3盐摄取和还原的下调,精氨酸的分解,谷氨酰胺向谷氨酸盐的转化以及脯氨酸的积累(图4b)。总的来说,8 μg/L CIP暴露造成蓝藻细胞的碳和精氨酸饥饿,这激活了mazEF-RCD的执行。
环境意义
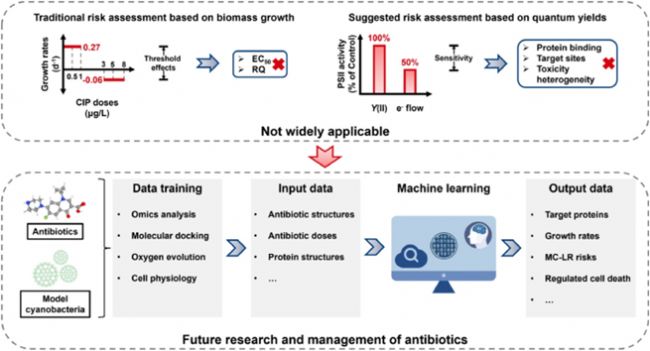
图5:未来抗生素生态毒理研究和管理的工作框架。
长期以来,蓝藻一直被作为评估水环境中抗生素生态风险的敏感筛查工具,该过程通过计算EC50和风险熵值来比较和评价抗生素的风险。然而,蓝藻的缓慢生长使得EC50的计算需要7天以上的暴露时间。本研究中,蓝藻细胞的裂解从暴露后的第3天开始。此外,EC50值的计算取决于抗生素种类。在我们的工作中,给出CIP的EC50值很困难,因为我们观察到不同CIP浓度暴露下几乎一致的细胞生长抑制和裂解(图 2a)水平。因此,在本研究中,EC50值的计算不是一项可靠的评价指标。
为了规避细胞生长抑制作为毒性终点的潜在问题,研究者通过测量光量子产率来快速评估抗生素的毒性。然而,对于3 μg/L CIP,我们在暴露后的第1天已经观察到PSII电子传递速率的下降(50%左右)(图 1b);然而此时我们并没有检测到Y(II)的显著下降(图 1a)。此外,仅评估该参数忽略了不同环境浓度暴露下CIP对不同光合蛋白损伤的差异性极其毒性的异质性。因此,本研究建议开发一种更灵敏的技术来详细评估和预测抗生素在光合生物中的毒性。具体来说,未来的工作应该侧重于化合物-蛋白质的相互作用及其对蓝藻生理的影响,并尝试开发机器学习来预测抗生素的毒性(图 5):
i) 通过基因表达变化、光量子产率和光合电子传递速率测量以及分子对接等综合手段来识别抗生素与光合蛋白之间的相互作用。需要重点研究在增加抗生素暴露水平时是否存在多个光合靶标。
ii) 需要通过对蓝藻细胞能量/毒素代谢进行生化/组学分析来研究和比较不同抗生素暴露水平下细胞的生理反应。
iii) 收集和整理上述数据用于训练机器学习。在输入光合蛋白和抗生素的结构以及抗生素剂量等信息后,该机器学习程序能够预测靶标光合蛋白、细胞的生长速率或 RCD,以及不同暴露水平下的蓝藻毒素风险。
小结
在本研究中,我们揭示了环境浓度CIP与铜绿微囊藻细胞中PSII和PSI反应中心蛋白的浓度依赖性结合。3 μg/L CIP与PSII D1蛋白结合,而8 μg/L CIP同时与 PSII D1和PSI Fe-S簇中心蛋白结合。这导致下游碳氮代谢的差异化调节。在大多数研究中,这种和光合蛋白的差异化结合无法通过光量子产率的测量来识别。碳氮代谢的差异化调节影响了蓝藻细胞对DNA损伤的响应,最终导致3和8 μg/L CIP暴露下蓝藻细胞分别执行AL-RCD和mazEF-RCD。伴随细胞死亡,MC-LR的被动释放水平(AL-RCD细胞)和单细胞合成能力(mazEF-RCD细胞)增强,表明单一抗生素胁迫下MC-LR风险水平的差异。总的来说,我们的研究阐明了抗生素-光合蛋白结合、碳氮代谢调节以及多样化蓝藻RCD模式之间的关系。
然而,需要更多的研究工作来使得这些结果更具有普适性,包括对不同作用模式的抗生素以及在形态和结构上与铜绿微囊藻不同的其他蓝藻物种的研究。此外,有必要探究抗生素重复暴露对蓝藻光合系统损伤的复杂性。
尽管本研究存在上述不足,但未来水生环境中抗生素的研究和管理应侧重于但不限于以下三个方面:i) 应针对抗生素对光合生物的生态风险进行更全面的评估,包括高于传统毒理效应阈值的致死效应;ii) 有必要对抗生素毒理效应的异质性开展细致的研究;iii) 识别化合物-蛋白质相互作用对于解释多样的毒理效应以及评估/预测抗生素风险是不可或缺的。
本研究得到了国家自然科学基金委和深圳市科创委的资助。
作者简介

通讯邮箱:tao.yi@sz.tsinghua.edu.cn
作者:

联系邮箱:zhu-yj24@mails.tsinghua.edu.cn
姚诗诗,清华大学深圳国际研究生院2020级硕士研究生,主要研究新污染物生态毒性风险。
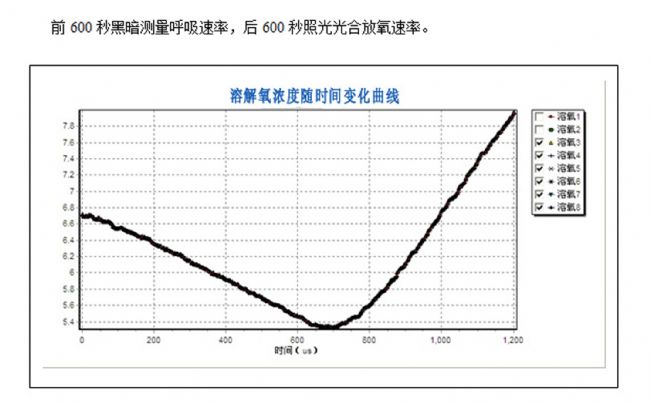
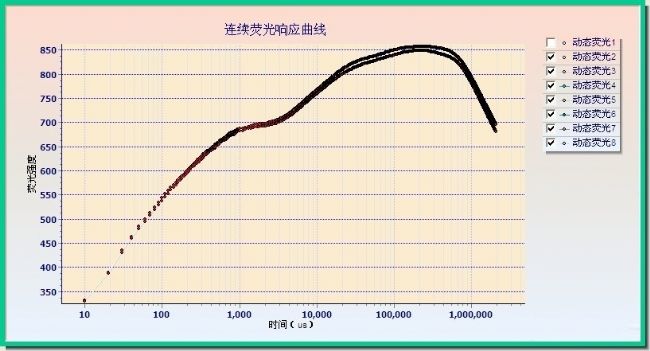
YZQ-201A藻类光合仪,是我公司“自主研发”的藻类生理的系列产品之一。该仪器特色是恒温控制、光谱可以调节、光强可以调节,控温精度达到±0.1℃。光谱分为暖白、R、G、B四种光谱可选,也可以多光谱定制。搭载新的荧光氧传感器(光学测量原理)测量微动态氧变化,自带搅拌功能使得测量更加稳定。实验设计可以是相同温度,不同光强,还可以是不同温度,同一光强对比测量均可实现。在恒温恒光环境下可连续监测藻类、根系、微生物、叶绿体等样本的微动态氧的变化,从而计算光合速率变化的状况。
功能与特点
1. 荧光氧电极(光学原理)的优势在于反应速度快,稳定性好,重复性好;对比极谱(CLARK)氧电极(电化学原理),不需要每次测量前要标定,不需要更换溶氧膜,不需要更换电解液,不需要打磨电极,不需要活化复新电极。
2. 恒定温度、不同光质、不同光强下样本光合速率的变化测量。
3. 不同温度梯度下的同一样本光合速率的变化测量
4. 自带搅拌使得测量数据更稳定。
5. 自带控制软件可进行实时控制。
应用
(1)藻类光合生理生态的研究
(2)微生物、根、花粉等呼吸速率的研究
(3)叶绿体等高等植物光合速率的研究

翼鬃麒科技(北京)有限公司,其他同类应用产品详细信息可登陆官网www.yzqm.net






