DSP助力供体胰腺的分析定义了早期肿瘤病变的转录组特征和微环境
文章题目:Analysis of donor pancreata defines the transcriptomic signature and microenvironment of early neoplastic lesions
中文题目:供体胰腺的分析定义了早期肿瘤病变的转录组特征和微环境
见刊时间:2023.06
期刊名称:Cancer Discovery
影响因子:28.2
实验平台:scRNA-seq (10x Genomics)、GeoMx DSP(NanoString)
DOI:10.1158/2159-8290.CD-23-0013
技术路线

文章摘要
由于缺乏在没有疾病和死后快速降解的情况下从胰腺获取组织的迹象,因此对成人健康胰腺的研究很少。研究者从脑死亡捐献者那里获得胰腺,从而避免了任何热缺血时间。这 30 名捐赠者年龄和种族各不相同,并且没有已知的胰腺疾病。对样本的组织病理学分析显示,无论年龄如何,大多数个体都存在胰腺上皮内瘤变(PanIN)病变。通过结合多重 IHC、单细胞 RNA 测序和空间转录组学,他们首次对成人胰腺的独特微环境和散发性 PanIN 病变进行了表征。他们将健康胰腺与胰腺癌和瘤周组织进行比较,观察到成纤维细胞和巨噬细胞中不同的转录组特征。来自健康胰腺的 PanIN 上皮细胞在转录上与癌细胞非常相似,这表明肿瘤途径在肿瘤发生的早期就开始了。
文章结果
1、成人胰腺经常出现 PanIN 病变
研究者从健康成人器官捐赠者那里收集了 30 个胰腺。每个块的组织病理学分析揭示了 30 个供体标本中的 18 个存在 PanIN以及正常腺泡实质、正常导管和腺泡到导管化生区域(ADM)。
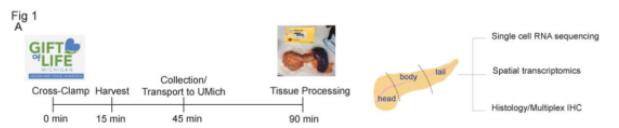
图1 成人胰腺经常出现 PanIN 病变
2、来自健康个体的 PanIN 被独特的微环境包围
为了表征 PanIN 微环境的免疫和基质组成,研究者对福尔马林固定、石蜡包埋的组织进行了多重荧光免疫组织化学分析。研究者将 PanIN 等区域的细胞组成与正常腺泡、导管或 ADM 等区域进行比较。结果显示,PanIN 的形成伴随着富含成纤维细胞、骨髓细胞和 T 细胞的独特微环境的建立,这与组织学上正常的胰腺不同。
为了进一步了解 PanIN 的组成及其微环境,研究者对 6 个供体器官(总共 44,068 个细胞)进行了单细胞 RNA 测序。组织学分析显示,4 个胰腺存在 PanIN 病变,而其余两个胰腺未检测到病变。研究者对其中骨髓细胞和淋巴细胞进行了进一步分析。多重免疫荧光数据显示,巨噬细胞存在于整个组织中,而 T 细胞更有可能位于 PanIN 附近。随后研究者又一起分析了成纤维细胞、内皮细胞和周细胞。最后研究者得出结论,无论是微环境的免疫成分还是非免疫成分,在供体样本中都是不同的。正常胰腺包括一组异质结构细胞,例如成纤维细胞、周细胞和内皮细胞以及免疫细胞。正常人类胰腺还呈现出组织学异质性,反映了年龄以及人类生活方式和遗传学的复杂性。
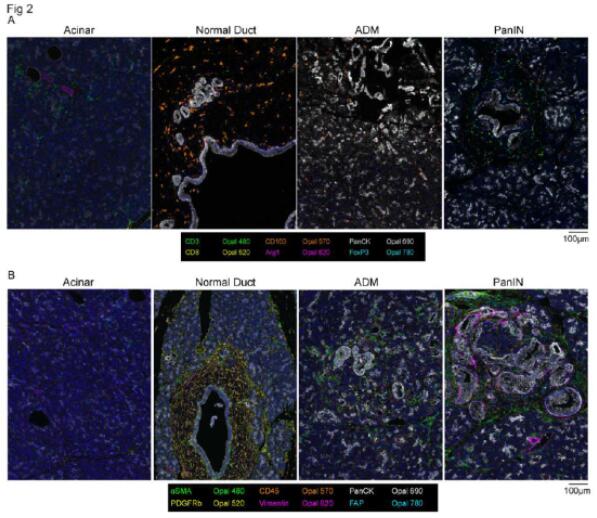
图2 健康胰腺中的 PanIN 病变被独特的微环境包围
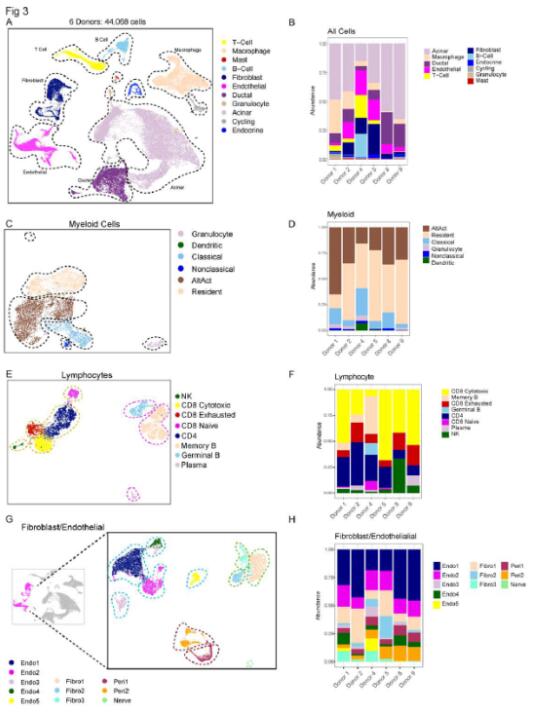
图3 健康的胰腺含有多种非上皮细胞群,包括骨髓细胞、淋巴细胞、成纤维细胞和内皮细胞
3.健康胰腺和胰腺肿瘤微环境的比较揭示了不同的基质特征
研究者接下来研究正常胰腺和胰腺癌微环境的差异。为此,他们将来自健康供体样本(6 个胰腺;总共11 个样本)的单细胞 RNA 测序数据与从数据库下载的数据进行了整合。先前发布的肿瘤 (n=16) 和邻近正常 (n=3) 样本的数据集。结果显示,肿瘤样本中巨噬细胞和 CD4+ T 细胞的比例较高。肿瘤样本和正常胰腺中细胞丰度明显不同。且差异基因分析显示两种类型样本中基因表达存在明显差异。研究者绘制了与正常样本相比肿瘤中增加的细胞群之间预测的配体受体相互作用。结果检测到了促胰腺癌发生相关的因子。同时,研究者进一步分析了骨髓细胞和成纤维细胞。细胞丰度、基因表达模式以及通路分析提示在健康样本和肿瘤样本之间存在明显差异。这些结果揭示了微环境组成部分的差异。
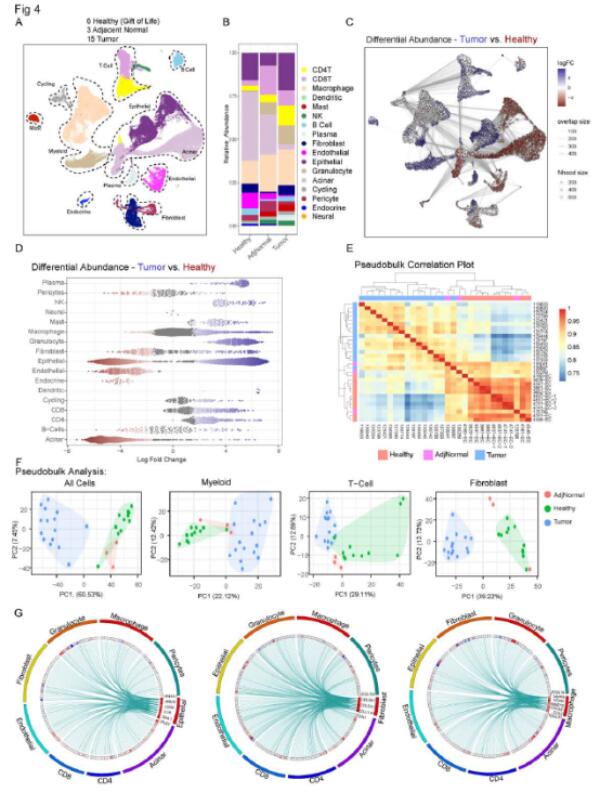
图4 健康胰腺和胰腺肿瘤微环境的比较揭示了不同的基质特征
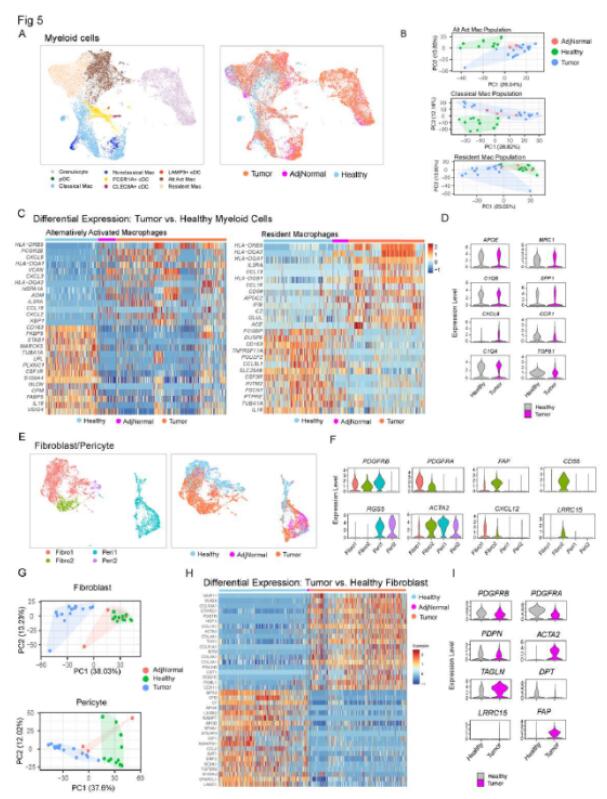
图5 与非肿瘤对应物相比,来自荷瘤胰腺的骨髓细胞和成纤维细胞群体表现出不同的转录组特征
4.空间转录组学揭示了 PanIN 病变的独特上皮基因特征,该特征与肿瘤上皮密切相关
为了直接评估 PanIN 的基因表达模式,他们利用了 GeoMx® Digital Spatial Profiler(DSP) 空间转录组学平台。研究者从供体胰腺中选择腺泡、正常导管、ADM 和 PanIN 感兴趣区域 (ROI)。此外,他们还收集了肿瘤附近腺泡和正常导管的 ROI 进行比较。为了避免基质的转录本混淆,使用全细胞角蛋白 (PanCK) 和 CD45 对每个区域的样本进行分割,以选择所有 ROI 中的 PanCK+/CD45- 细胞,但腺泡 ROI 除外,在其中选择 PanCK-/CD45-(作为腺泡)细胞不表达 PanCK,并且可以很容易地在组织学上识别。研究者提取了每种细胞类型特有的基因特征。基因集变异分析 (GSVA)显示来自其他健康胰腺的散发性 PanIN 与肿瘤邻近的 PanIN 相似但又不同。
随后,研究者将空间转录组学与单细胞 RNA 测序数据相结合。使用每个 ROI 类别的前 20 个基因,研究者定义了腺泡、导管、ADM、PanIN 和肿瘤细胞的细胞类型特异性基因特征,并将这些特征从单细胞上皮测序数据映射到上皮簇。研究者绘制了每个定义特征相对丰富的细胞群图。
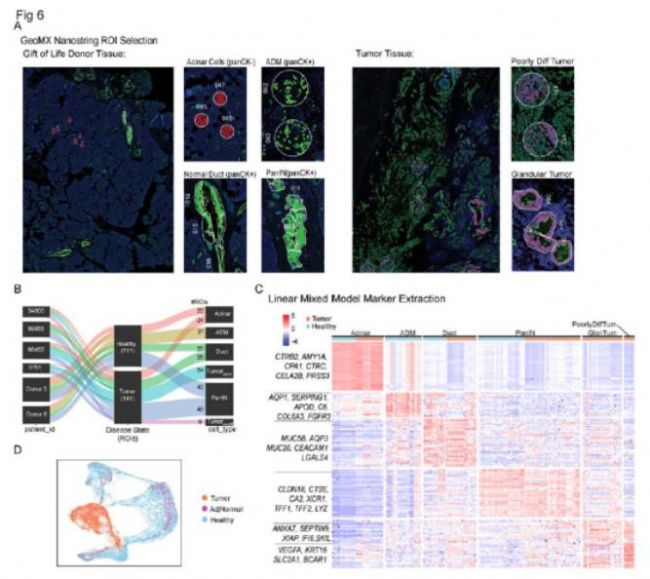
图6 空间转录组学揭示了 PanIN 病变的独特上皮基因特征,该特征与肿瘤上皮密切相关
5.Claudin 18、MUC5AC/B 和 AQP1/3 区分健康胰腺中的正常导管、ADM 和 PanIN
接下来,研究者验证供体组织中的基因特征,以确定它们是否准确地识别了不同的上皮细胞群,正如上述转录组数据所表明的那样。研究者选择了区分每种上皮细胞类型的标记,包括 AQP1(ADM 特异性)、MUC5B 和 AQP3(正常导管特异性)以及 CLDN18 和 TFF1(PanIN 特异性)的原位杂交探针。研究者将 MUC5AC 作为 PanIN 标记,因为他们的数据支持其在非肿瘤样本中 PanIN 中的独特表达(与正常导管、ADM 和腺泡细胞相比)。结果显示,在同时含有 PanIN 和正常导管的切片中,MUC5B 仅对正常导管染色,而 MUC5AC 对 PanIN 具有特异性。CLDN18 染色在 PanIN 中升高,但在 ADM 中也呈较低程度的阳性。AQP3 仅对正常导管染色,而 AQP1 对 ADM 具有特异性。TFF1 与 CLDN18 在 PanIN 中共表达。最后,PanIN 病变表达高水平的 p-ERK,而 ADM 区域的 p-ERK 也呈阳性。因此,空间转录组学衍生的特征定义了个体上皮细胞群,并正确预测了独特谱系标记的蛋白质表达。
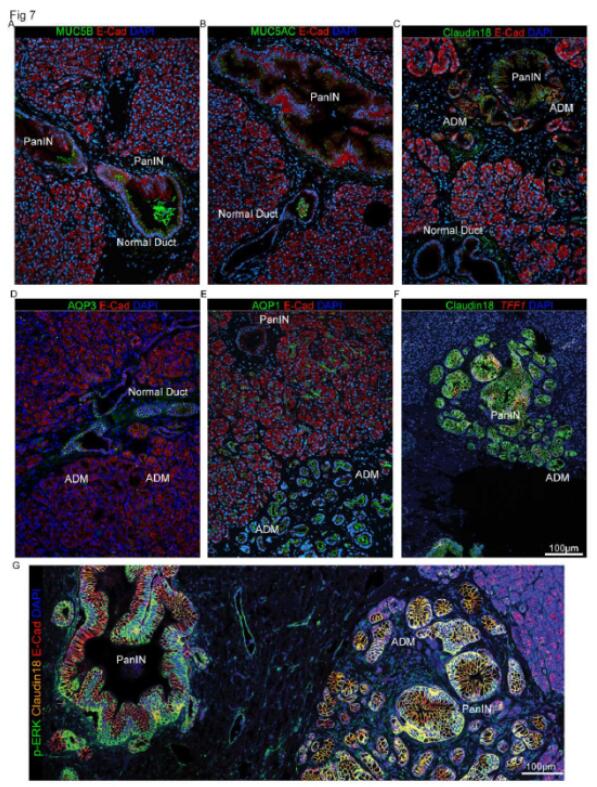
图7 Claudin 18、MUC5AC/B 和 AQP1/3 区分健康胰腺中的正常导管、ADM 和 PanIN
文章意义
由于胰腺癌的前驱病变特征尚不清楚。研究者分析了供体胰腺,发现前体病变的检出率远高于胰腺癌的发病率,这为阐明抑制或相反促进恶性进展的微环境和细胞内在因素奠定了基础。





