间充质干细胞治疗在新冠肺炎的临床研究的应用
 截止2020年3月15日全球确诊新型冠状病毒(Corona Virus Disease 2019,COVID-19)感染病例已突破15万例,死亡6千多例。3月11日,世卫组织总干事谭德塞宣布新冠肺炎疫情已经构成全球性大流行。新冠病毒肺炎目前治疗包括支持治疗或对症治疗等一般治疗,抗病毒治疗、抗菌治疗及中医药治疗等。在缺乏特效治疗方案的背景下,间充质干细胞因具有强大的抗炎和免疫调节功能,并能降低肺部纤维化水平、增强组织损伤修复被应用于新冠肺炎患者的救治,多项临床试验证实间充质干细胞在新冠肺炎尤其是对重症患者的治疗具有成效,本文将就间充质干细胞治疗新冠肺炎的进展以及发挥作用的潜在机制做一总结。 干细胞治疗已引起广泛关注,间充质干细胞成为宠儿! 干细胞治疗新冠病毒的前沿动态 ❶ 2020年2月5日 第一例间充质干细胞治疗COVID-19患者的临床试验正式注册,而后越来越多的干细胞疗法治疗新冠肺炎申请注册。临床试验使用的干细胞,主要是间充质干细胞(Mesenchymal Stem Cells, MSCs)。随着临床试验的开展及研究的不断深入,已有部分结果输出。
❷ 2020年2月27-28日 在中国科学院科技论文预发布平台(ChinaXiv)上相继有两篇关于间充质干细胞应用于新冠肺炎治疗的文章发布,两篇文章都提示,间充质干细胞的移植治疗或可改善COVID-19肺炎患者的预后,尤其是重症、危重症患者,移植MSCs是安全有效的治疗方法[1-2]。 ❸ 2020年3月2日
国家领导人提出,要采取恢复期血浆、干细胞、单克隆抗体等先进治疗方式,提升重症、危重症救治水平。 ❹ 2020年3月4日
湖北日报报道,8例重症新冠肺炎患者接受脐带间充质干细胞治疗,已完成第一个疗程,取得初步疗效,进入临床观察期。随后,武汉又有10名患者接受间充质干细胞治疗,症状获得明显改善。虽然MSCs移植治疗对新冠肺炎具有安全性和有效性,但仍需更多临床数据对MSCs的有效性进行证实。 ❺ 2020年3月14日
间充质干细胞治疗新冠肺炎的临床研究已被列为国家科技攻关的紧急专项,由王福生院士牵头。 ❻ 截止2020年3月15日
已有12项间充质干细胞治疗新型冠状病毒肺炎(COVID-19)相关临床研究登记注册(数据来自http://www.chictr.org.cn/searchproj.aspx)。 |
 |
| MSCs为何在新冠肺炎治疗中脱颖而出? |
|
▍▏MSCs的来源与特性 ▏▎ ❶ 来源
人类对MSC的最初的认识可以追溯到1687年,德国病理学家Cohnheim在研究创伤愈合时,首次提出了骨髓中除造血干细胞外,还存在向非造血系统多向分化的其他干细胞的观点[3]。MSCs首次发现是在骨髓中,之后研究发现脂肪组织、脐带血、胎盘组织、外周血、牙髓、尿液和羊水等同样存在MSCs。 MSCs来源于发育早期的中胚层和外胚层,属于多能干细胞,具有自我复制及增殖能力,具有多项分化的潜能,可分泌多种细胞因子和外泌体,具有免疫调节、组织修复、造血支持、促进血管再生、抗纤维化等能力[4]。
❷ 特性
MSCs免疫原性低,进入人体不会诱发排异反应,移植到患者体内无需配型,无恶向转化的可能,安全性较高,不受伦理问题和安全问题的限制,超低温冷冻储存时间长达10年之久,是干细胞治疗的理想来源。脐带或胎盘组织的间充质干细胞因其取材方便,可获取的细胞数量多,增殖能力强,免疫调节能力强,分泌的细胞因子含量高,便于扩增和传代,极适用于临床研究和应用。 ▍▏MSCs治疗新冠肺炎的潜在机制 ▏▎ ❶ 抑制细胞因子风暴
2020年1月25日《柳叶刀》(Lancet)发布的新型冠状病毒相关的研究论文表明,在确诊的COID-19重症患者中,大量患者出现致命的细胞因子释放综合征(Cytokine Release Syndrome, CRS) [5]。而MSCs可通过自身旁分泌机制,分泌多种抑炎因子(TGF-β1, IL-10, IL-11等),抑制CRS。 在病毒感染过程中,MSCs也可通过细胞间接触及分泌多种可溶性细胞因子、微囊体及外泌体等,下调树突状细胞(Dendritic , DC)、巨噬细胞、T淋巴细胞等促炎因子(IL-1α, IL-1β, TNF-α, IL-6和IL-12等)的释放,上调其抑炎因子(TGF-β1, IL-10和IL-4等)的表达,从而达到抑制CRS的目的。
临床试验数据显示,输注MSCs的COVID-19肺炎患者血清中抗炎因子IL-10含量显著升高,促炎因子TNF-α含量显著下降,趋化因子IP-10及生长因子VEGF有上升趋势[1],为MSCs抑制CRS提供了有力证据。
|
 |
| COVID-19肺炎患者输注MSCs组与未输注组血清细胞因子分析比较[1] |
| PeproTech整理了200多篇文献后,总结了全面的MSCs所分泌的细胞因子,如下面挂图所示 |
 |
|
提取码:d4wf
|
|
❷ 精确调节多种免疫细胞功能
COVID-19肺炎患者外周血白细胞、中性粒细胞数量显著升高,CD4+ CD8+ T细胞数量显著减少,但过度激活,提示COVID-19肺炎患者免疫系统已严重受损。MSCs可精确调节多种免疫细胞功能,调节免疫应答反应。 Jelena M. Dokic等研究发现,MSCs可通过细胞间接触和分泌可溶性因子,抑制CD14+单核细胞向树突状细胞(Dendritic , DC)的分化、成熟,减少DC活化,并影响其细胞因子的表达模式[6-8]。 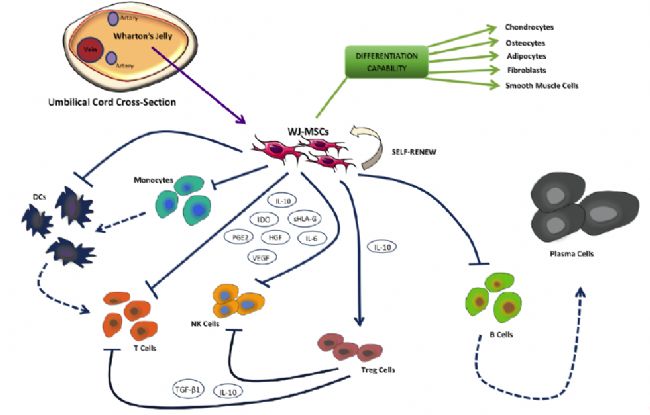 间充质干细胞对DC、NK、T、B细胞的免疫调节[6]
|
|
MSCs可抑制免疫细胞过度活化,调节免疫系统功能使其比例恢复到正常水平,降低新型冠状病毒对肺造成的损伤。 |
| PeproTech可为您提供人MSCs相关产品 |
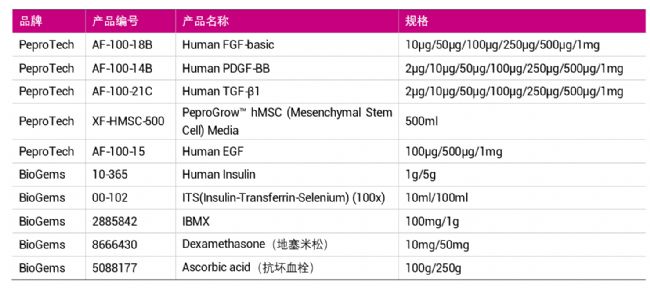
| ▍▏MSCs扩增及分化用产品 ▏▎ |
 |
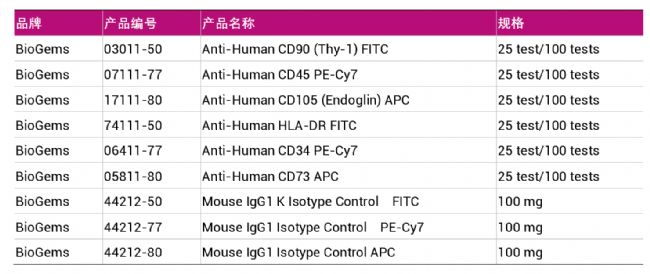
| ▍▏MSCs鉴定用抗体 ▏▎ |
 |
| ☆ 其它鉴定抗体请咨询:40000 53055 |
| 参考文献 |
|
1. Zikuan L, et al. (2020) Transplantation of ACE2- mesenchymal stem cells improves the outcome of patients with COVID-19 pneumonia. ChinaXiv
2. Bing L, et al. (2020) Clinical remission of a critically ill COVID-19 patient treated by human umbilical cord mesenchymal stem cells. ChinaXiv
3. AI Caplan, et,al. (1991) Mesenchymal stem cells Journal of or thopaedic research, Wiley Online Library
4. Pittenger MF, et al. (1999) Multi-lineage potential of adult human mesenchymal stem cells[J]. Science, 284: 143-147.
5. C Huang, et al. ( 2020) Clinical Features of Patients Infected With 2019 Novel Coronavirus in Wuhan, China. Lancet 395 (10223), 497-506
6. L Marino et al. (2019) Mesenchymal Stem Cells From the Wharton's Jelly of the Human Umbilical Cord: Biological Properties and Therapeutic Potential. Int J Stem Cells 12 (2), 218-226.
7. JM Dokic, et al. (2016) Cross-Talk Between Mesenchymal Stem/Stromal Cells and Dendritic Cells. Curr Stem Cell Res Ther, 11 (1), 51-65 2
8. A Uccelli, et al. (2015) The Immunomodulatory Function of Mesenchymal Stem Cells: Mode of Action and Pathways. Ann N Y Acad Sci 1351, 114-26.
9. Guan W, et al. (2018) Kynurenic Acid, an IDO Metabolite, Controls TSG-6-mediated Immunosuppression of Human Mesenchymal Stem Cells Cell Death Differ, 25 (7), 1209-1223
10. Yuxian S, et al. (2017) Exosomal miR-146a Contributes to the Enhanced Therapeutic Efficacy of Interleukin-1β-Primed Mesenchymal Stem Cells Against Sepsis Stem Cells, 35 (5), 1208-1221
11. Pontikoglou C, et al. (2011) Bone marrow mesenchymal stem cells: biological properties and their role in hematopoiesis and hematopoietic stem cell transplantation. Stem Cell Rev;7:569-589
12. Che N, et al. (2012) Umbilical cord mesenchymal stem cells suppress B-cellproliferation and differentiation. Cell Immunol ;274:46-53
13. M Rojas et al. (2005) Bone Marrow-Derived Mesenchymal Stem Cells in Repair of the Injured Lung Am J Respir Cell Mol Biol 33 (2), 145-52.
14. X Fu, et al. (2019) Mesenchymal Stem Cell Migration and Tissue Repair Cells 8 (8).
15. Y Moodley et al. (2009) Human Umbilical Cord Mesenchymal Stem Cells Reduce Fibrosis of Bleomycin-Induced Lung InjuryAm J Pathol 175 (1), 303-13. Jul 2009.
16. Wu X, et al. (2018) Intrinsic Immunity Shapes Viral Resistance of Stem Cells.Cell, 172 (3), 423-438.e25
|





