用户文章:基于LC-MS/MS鉴定丝绸种类以提供古代使用野生蚕丝的证据
蚕丝是一种纤维蛋白,通常通过养殖家蚕(Bombyx mori)来生产。最早使用蚕丝制作纺织品的历时可以追溯到大约6000年前中国的新石器时代[1]。历史证据表明,与此同时或在此之前,可能已有多种蚕种被用于蚕丝采集和纺织品生产[2,3,4]。时至今日,多种野生蚕丝已被用于纺织品生产,例如天蚕(Antheraea)和桑蚕(Samia)。这些物种适应在不同的气候条件下生活(从热带到温带),栖息在亚洲大部分地区并具有区域依赖性。丝绸是连接亚洲与中东和欧洲近 2000年的重要商品[1],在古丝绸之路及附近的考古遗址也发现了大量疑似丝绸的材料,对这些材料的种类进行鉴定将有助于更好地了解古代和史前时期的丝绸生产概况,可以提供纺织品的使用、技术发展以及丝绸贸易的起源和发展的重要信息。然而,研究蚕桑业的起源很困难,因为基于传统的光学显微镜、SEM、FTIR等技术进行形态观察和化学表征很难捕捉到蚕丝物种间的细微变化,古代样品由于发生氧化和降解等反应,使得难度进一步提高。通过LC-MS/MS可以确定氨基酸序列,然后可以通过遗传和蛋白质组数据库在物种水平上将其与特定蛋白质匹配[5],还可以观察到由于遗传漂变和物种形成而导致的同一蛋白质在不同物种中发生氨基酸序列变化[6,7]。
来自英国牛津大学化学系的James S. O. McCullagh教授和考古与艺术史研究实验室的A. Mark Pollard教授联合发表了基于质谱蛋白质组学方法成功将现代蚕丝(Bombyx)、天蚕丝(Antheraea)和萨米亚蚕丝(Samia)区分到物种水平的研究: “Species identification of silks by protein mass spectrometry reveals evidence of wild silk use in antiquity” 。多肽和蛋白鉴定使用PEAKS®️ Studio完成。而且,他们分析了从古城巴尔米拉出土的考古蚕丝材料,蚕丝的溶解表现和蛋白质组学分析结果表明这些丝绸是由野生印度柞蚕(Antheraea mylitta)的蚕丝织成的,是首次证明古代印度野生蚕丝参与生产和贸易的物种级考古生化证据。
丝素蛋白溶解实验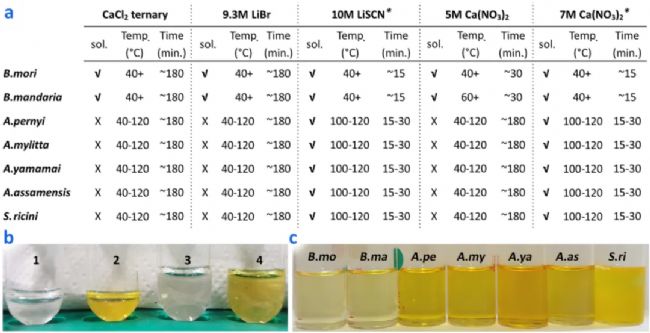 图1 不同蚕丝的溶解条件测试
图1 不同蚕丝的溶解条件测试
蛋白参考序列及其理论酶切模式
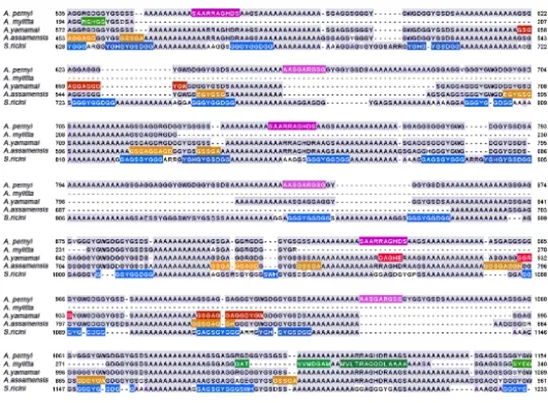
为了预估最佳的蛋白酶切方案,作者对Swiss-Prot库中的B. mori(P05790)和B. mandarina(Q99059),TrEMBL库中的A. pernyi(O75786)、 A. mylitta(Q8ISB3)、A. yamamai(E1CGA3)、A. assamensis(A0A0K0KR73)和S. ricini(A0A0D5ZYI3)进行了氨基酸序列比对和计算机理论酶切。对比结果显示,即使来自于同一个属,不同物种间的蛋白也存在各自独有的序列片段(图2),从而导致在酶切过程中产生不同的肽段,辅助进行物种区分。然后,作者在PeptideMass在线模拟Trypsin、Chymotrypsin和Trypsin-Chymotrypsin酶切覆盖度。Trypsin和Chymotrypsin单独酶切在不同样品中的覆盖度并不均匀,但Trypsin-Chymotrypsin联合酶切比较稳定,在B. mori HC中实现了48%的序列覆盖率,在B. mandarina HC中实现了100%,在Antheraea中实现了92-100%,在S. ricini中实现了100%,这表明与单独使用Trypsin相比,Trypsin-Chymotrypsin可为大多数丝素蛋白提供较高的多肽覆盖率。
通过LC-MS/MS鉴定不同丝素蛋白
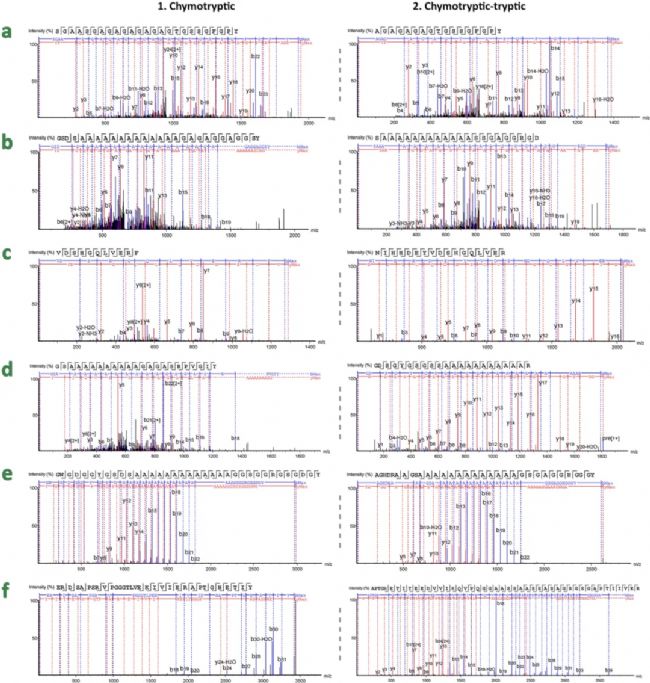
为了确定计算机预测是否可实际应用于不同物种的丝素蛋白区分,作者首先用7M Ca(NO3)2溶解丝素蛋白,然后分别使用 (1)Trypsin,(2) FA-Trypsin(甲酸后再用胰蛋白酶),(3) Chymotrypsin,以及 (4) Chymotrypsin-Trypsin(糜蛋白酶后再用胰蛋白酶)四种方法分别对7 种丝素蛋白样品进行酶切,总得到28 个待测样品,用于后续nanoLC-MS/MS分析。质谱数据使用PEAKS®️ Studio进行分析。每个物种都鉴定到了特征序列,包括B. mori特有的六肽GAGAGA和GAGAGT(图3a)、Antheraea特有的肽SGAGG(图3c)和多聚丙氨酸片段(图3b、d、e)和S. ricini特有的肽GGGYGGDGG(图3f)。使用Chymotrypsin消化Bombyx 丝素蛋白的HC、A. pernyi和A. mylitta可鉴定出最多的独有肽段,但使用Chymotrypsin-Trypsin酶消化A. yamamai、A. assamensis和S. ricini可鉴定出最多的特异肽段。
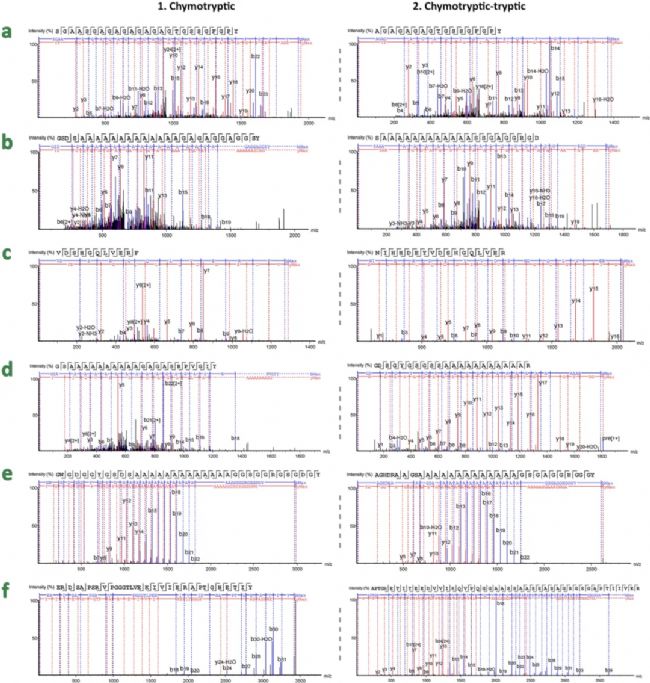 图3 七个蚕丝样品中可信度较高的特异肽段谱图
图3 七个蚕丝样品中可信度较高的特异肽段谱图
帕尔米拉样品的蚕丝物种鉴定
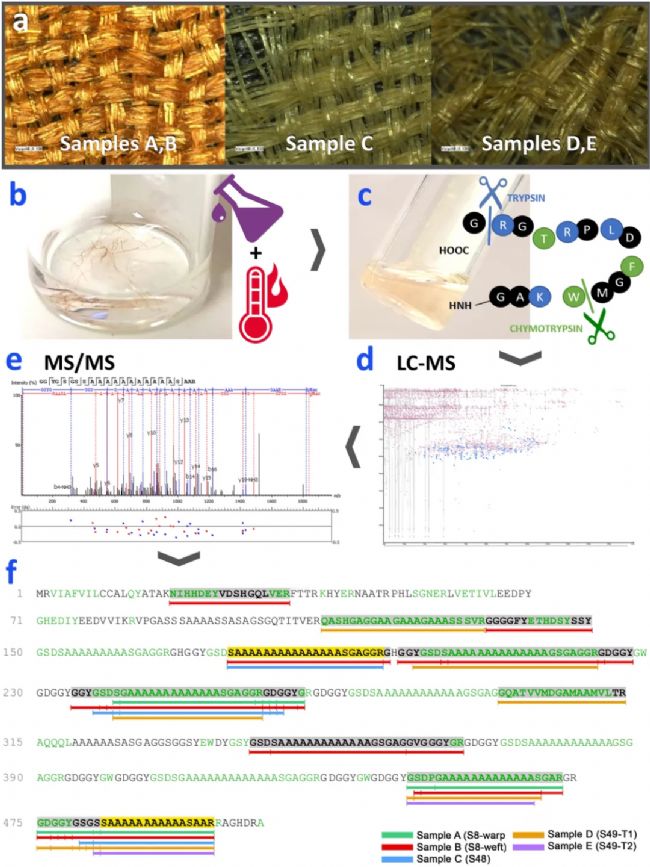
作者采集了从帕尔米拉考古遗址发现的五个疑似丝绸的纤维样本(图4a),S8号样品(左)由非常有光泽的扁平纤维制成,根据之前的显微镜分析,只在Z方向轴上有轻微扭曲。S48(中)和S49号(右)样品的经线和纬线看起来都是相似的扁平纤维。据推测,这三种纺织品都不是由B.mori的蚕丝制成的,但由于缺乏合适的分析技术[8],至今无法确认具体成分。因此作者使用上述优化的7M Ca(NO3)2溶解样品,在 40-80 °C之间未观察到溶解(图4a),但在100-125°C之间溶解较充分(图4b、c),与先前使用现代野生蚕丝标准品进行实验时观察到的结果一致。样本充分溶解后,用Chymotrypsin-Trypsin联合酶切,然后通过nanoLC-MS/MS对酶切后的样品进行分析。表2汇总了数据库搜索(PEAKS DB)与翻译后修饰搜索(PEAKS PTM)、同源序列匹配(PEAKS SPIDER)分析得到的特异肽段信息。由于A. mylitta丝素蛋白的参考序列不完整,比其他Antheraea物种的蛋白序列短75%以上,为此作者进行了PEAKS SPIDER搜索,将从头测序(de novo)标签映射到已知参考序列中高度同源的区域。
表2 帕尔米拉样品中特异肽段的鉴定结果
所有帕尔米拉样品中均发现了先前在现代蚕丝样品中发现的Antheraea丝素蛋白的特有肽段SGAGG和An≥8片段(表2)。结合PEAKS DB和PEAKS SPIDER分析,样品A、B和D的丝素蛋白可以确定来源于A. mylitta(图4f)。样品C和E与其他Antheraea蛋白的匹配得分略高,但样品C中的GGYGSGSSA11SAAR(478–500)和 SA15SGAGGR(176–197),样品E中的SA11SAAR(485–500),均属于A. mylitta(表2)。A15S和SSA11S的基序是A.mylitta(Q8ISB3)独有的,因此对于未知待测样品,可以检测这些肽段基序来区分A. mylitta和其他物种。
小结
原文链接
https://www.nature.com/articles/s41598-022-08167-3
参考文献
1. Vainker, S. J. Chinese Silk: A Cultural History (British Museum Press, 2004).
2. Gilroy, C. G. The History of Silk, Cotton, Linen, Wool, and Other Fibrous Substances (C. M. Saxton, E. R. Fellows, 1853).
3. Good, I. On the question of silk in pre-Han Eurasia. Antiquity 69, 959–968 (1995).
4. Ray, H. P. Textiles in Indian Ocean Societies (ed. Barnes, R.). (Taylor & Francis, 2004).
5. Zhao, Y. & Lin, Y. H. Whole-cell protein identification using the concept of unique peptides. Genomics Proteomics Bioinform. 8, 33–41. https://doi.org/10.1016/s1672-0229(10)60004-6 (2010).
6.Solazzo, C., Fitzhugh, W., Kaplan, S., Potter, C. & Dyer, J. M. Molecular markers in keratins from Mysticeti whales for species identification of baleen in museum and archaeological collections. PLoS ONE12, e0183053. https://doi.org/10.1371/journal.pone.0183053 (2017).
7. Azémard, C. et al. Animal fibre use in the Keriya valley (Xinjiang, China) during the Bronze and Iron Ages: A proteomic approach. J. Archaeol. Sci.
8. Schmidt-Colinet, A., Stauffer, A. & Asʻad, K. Die Textilien aus Palmyra. (Ph. von Zabern, 2000).
作为生物信息学的领军企业,BSI专注于蛋白质组学和生物药领域,通过机器学习和先进算法提供世界领先的质谱数据分析软件和蛋白质组学服务解决方案,以推进生物学研究和药物发现。我们通过基于AI的计算方案,为您提供对蛋白质组学、基因组学和医学的卓越洞见。旗下著名的PEAKS®️系列软件在全世界拥有数千家学术和工业用户,包括:PEAKS®️ Studio,PEAKS®️ Online,PEAKS®️ GlycanFinder, PEAKS®️ AB,DeepImmu®️ 免疫肽组发现服务和抗体综合表征服务等。
来自英国牛津大学化学系的James S. O. McCullagh教授和考古与艺术史研究实验室的A. Mark Pollard教授联合发表了基于质谱蛋白质组学方法成功将现代蚕丝(Bombyx)、天蚕丝(Antheraea)和萨米亚蚕丝(Samia)区分到物种水平的研究: “Species identification of silks by protein mass spectrometry reveals evidence of wild silk use in antiquity” 。多肽和蛋白鉴定使用PEAKS®️ Studio完成。而且,他们分析了从古城巴尔米拉出土的考古蚕丝材料,蚕丝的溶解表现和蛋白质组学分析结果表明这些丝绸是由野生印度柞蚕(Antheraea mylitta)的蚕丝织成的,是首次证明古代印度野生蚕丝参与生产和贸易的物种级考古生化证据。
丝素蛋白溶解实验
蚕丝一般由丝胶和丝素蛋白两部分组成。丝胶是一种胶质蛋白,主要由亲水链组成,通常可通过热水或温和的化学处理将其剥离。而丝素蛋白具有疏水性结构,富含短甘氨酸和丙氨酸残基,可实现β片层紧密堆积和氨基酸R基互锁排列,不易被溶解,且野生蚕丝比家蚕丝更难溶解。Bombyx蛋白包含重链(HC,390kDa)、轻链(LC,30kDa)和六肽(P25,25kDa),Antheraea和Samia蛋白仅包含通过二硫键连接的重链。为了充分溶解来自不同物种的丝素蛋白以便进行更准确的蛋白质组学鉴定,作者配置了5种溶液体系,分别对B. mori、B. mandarina、A.pernyi、A. mylitta、A. yamamai、A. assamensis和S. ricini七种蚕丝进行溶解测试(图1a)。溶解效果通过黄色反应测定(图1b,c),结果显示不同的盐溶液对不同种类的丝素蛋白的溶解度不同,溶解所需的加热温度也因丝的类型而异。
 图1 不同蚕丝的溶解条件测试
图1 不同蚕丝的溶解条件测试蛋白参考序列及其理论酶切模式
为了预估最佳的蛋白酶切方案,作者对Swiss-Prot库中的B. mori(P05790)和B. mandarina(Q99059),TrEMBL库中的A. pernyi(O75786)、 A. mylitta(Q8ISB3)、A. yamamai(E1CGA3)、A. assamensis(A0A0K0KR73)和S. ricini(A0A0D5ZYI3)进行了氨基酸序列比对和计算机理论酶切。对比结果显示,即使来自于同一个属,不同物种间的蛋白也存在各自独有的序列片段(图2),从而导致在酶切过程中产生不同的肽段,辅助进行物种区分。然后,作者在PeptideMass在线模拟Trypsin、Chymotrypsin和Trypsin-Chymotrypsin酶切覆盖度。Trypsin和Chymotrypsin单独酶切在不同样品中的覆盖度并不均匀,但Trypsin-Chymotrypsin联合酶切比较稳定,在B. mori HC中实现了48%的序列覆盖率,在B. mandarina HC中实现了100%,在Antheraea中实现了92-100%,在S. ricini中实现了100%,这表明与单独使用Trypsin相比,Trypsin-Chymotrypsin可为大多数丝素蛋白提供较高的多肽覆盖率。

图2 不同蚕丝的特异序列(部分)
通过LC-MS/MS鉴定不同丝素蛋白
为了确定计算机预测是否可实际应用于不同物种的丝素蛋白区分,作者首先用7M Ca(NO3)2溶解丝素蛋白,然后分别使用 (1)Trypsin,(2) FA-Trypsin(甲酸后再用胰蛋白酶),(3) Chymotrypsin,以及 (4) Chymotrypsin-Trypsin(糜蛋白酶后再用胰蛋白酶)四种方法分别对7 种丝素蛋白样品进行酶切,总得到28 个待测样品,用于后续nanoLC-MS/MS分析。质谱数据使用PEAKS®️ Studio进行分析。每个物种都鉴定到了特征序列,包括B. mori特有的六肽GAGAGA和GAGAGT(图3a)、Antheraea特有的肽SGAGG(图3c)和多聚丙氨酸片段(图3b、d、e)和S. ricini特有的肽GGGYGGDGG(图3f)。使用Chymotrypsin消化Bombyx 丝素蛋白的HC、A. pernyi和A. mylitta可鉴定出最多的独有肽段,但使用Chymotrypsin-Trypsin酶消化A. yamamai、A. assamensis和S. ricini可鉴定出最多的特异肽段。
 图3 七个蚕丝样品中可信度较高的特异肽段谱图
图3 七个蚕丝样品中可信度较高的特异肽段谱图帕尔米拉样品的蚕丝物种鉴定
作者采集了从帕尔米拉考古遗址发现的五个疑似丝绸的纤维样本(图4a),S8号样品(左)由非常有光泽的扁平纤维制成,根据之前的显微镜分析,只在Z方向轴上有轻微扭曲。S48(中)和S49号(右)样品的经线和纬线看起来都是相似的扁平纤维。据推测,这三种纺织品都不是由B.mori的蚕丝制成的,但由于缺乏合适的分析技术[8],至今无法确认具体成分。因此作者使用上述优化的7M Ca(NO3)2溶解样品,在 40-80 °C之间未观察到溶解(图4a),但在100-125°C之间溶解较充分(图4b、c),与先前使用现代野生蚕丝标准品进行实验时观察到的结果一致。样本充分溶解后,用Chymotrypsin-Trypsin联合酶切,然后通过nanoLC-MS/MS对酶切后的样品进行分析。表2汇总了数据库搜索(PEAKS DB)与翻译后修饰搜索(PEAKS PTM)、同源序列匹配(PEAKS SPIDER)分析得到的特异肽段信息。由于A. mylitta丝素蛋白的参考序列不完整,比其他Antheraea物种的蛋白序列短75%以上,为此作者进行了PEAKS SPIDER搜索,将从头测序(de novo)标签映射到已知参考序列中高度同源的区域。
表2 帕尔米拉样品中特异肽段的鉴定结果

所有帕尔米拉样品中均发现了先前在现代蚕丝样品中发现的Antheraea丝素蛋白的特有肽段SGAGG和An≥8片段(表2)。结合PEAKS DB和PEAKS SPIDER分析,样品A、B和D的丝素蛋白可以确定来源于A. mylitta(图4f)。样品C和E与其他Antheraea蛋白的匹配得分略高,但样品C中的GGYGSGSSA11SAAR(478–500)和 SA15SGAGGR(176–197),样品E中的SA11SAAR(485–500),均属于A. mylitta(表2)。A15S和SSA11S的基序是A.mylitta(Q8ISB3)独有的,因此对于未知待测样品,可以检测这些肽段基序来区分A. mylitta和其他物种。

图4 古代丝绸样品的物种鉴定
小结
本研究优化了不同种类蚕丝的最佳溶解方法,并通过nanoLC-MS/MS进行物种识别。该方法通过提供丝素蛋白组成的直接分子证据(包括以前无法从野生丝素蛋白中获得的物种水平信息),克服了一些传统丝绸识别技术的局限性。该方法已成功应用于七种现代丝绸物种的分析,随后还用于分析古代帕尔米拉的考古丝绸样品。首次提供了古代使用印度野生柞蚕(A. mylitta)蚕丝生产和出口丝绸的直接证据。但由于目前公开的丝蛋白参考序列不完整,尤其是B. mandarina和A. mylitta,丰富与蚕丝素蛋白有关的蛋白质数据库将使得本研究方法得到更广泛的应用,并提高对严重降解或污染的考古丝绸样品进行分析的成功率。本方法还为研究工程液态丝绸提供了参考,有望在材料科学领域实现新的广泛应用。
原文链接
参考文献
1. Vainker, S. J. Chinese Silk: A Cultural History (British Museum Press, 2004).
2. Gilroy, C. G. The History of Silk, Cotton, Linen, Wool, and Other Fibrous Substances (C. M. Saxton, E. R. Fellows, 1853).
3. Good, I. On the question of silk in pre-Han Eurasia. Antiquity 69, 959–968 (1995).
4. Ray, H. P. Textiles in Indian Ocean Societies (ed. Barnes, R.). (Taylor & Francis, 2004).
5. Zhao, Y. & Lin, Y. H. Whole-cell protein identification using the concept of unique peptides. Genomics Proteomics Bioinform. 8, 33–41. https://doi.org/10.1016/s1672-0229(10)60004-6 (2010).
6.Solazzo, C., Fitzhugh, W., Kaplan, S., Potter, C. & Dyer, J. M. Molecular markers in keratins from Mysticeti whales for species identification of baleen in museum and archaeological collections. PLoS ONE12, e0183053. https://doi.org/10.1371/journal.pone.0183053 (2017).
7. Azémard, C. et al. Animal fibre use in the Keriya valley (Xinjiang, China) during the Bronze and Iron Ages: A proteomic approach. J. Archaeol. Sci.
8. Schmidt-Colinet, A., Stauffer, A. & Asʻad, K. Die Textilien aus Palmyra. (Ph. von Zabern, 2000).
标签:
多肽鉴定





