大肠杆菌HMS174和BLR菌株HCP表征及纯化指导数据库构建详解
纵观生物制药生产的发展历史,从目标产物中检测并有效去除宿主细胞蛋白(HCP)杂质一直是业内人员重点关注和深入研究的问题[1-3]。如果最终的药品制剂中杂质含量超标,会对患者安全或产品稳定性产生不利影响,例如,ChAdOx1 nCoV-19疫苗的强烈副作用就很可能与大量HCP杂质残留有关[4]。为了尽量提高产品质量,减少对用药患者的影响,加快生物制药工艺开发,有效去除HCP杂质是至关重要的。由于裂解宿主细胞获取表达产物时,来自宿主的杂质如HCPs、DNA、RNA和内毒素也同时被释放,因此,必须采用多重方法逐步减少HCP的残留,直至达到质量标准(图1)。然而,有些HCP的结构和物理化学性质很可能与靶标蛋白非常相似,因此消除此类HCP存在巨大挑战。
作为一种无偏的检测方法,基于质谱的蛋白质组学被越来越多地应用于监测纯化过程或检测最终药物制品中的关键宿主细胞蛋白质残留。在蛋白亚单位疫苗一类的新生生物药的工艺开发过程中,对宿主细胞蛋白质组的深度了解非常有助于寻找更合理的工艺设计方案。
荷兰代尔夫特理工大学生物技术系的Marcel Ottens等研究人员在Biotechnology Journal上发表了文章“Characterisation of the E. coli HMS174 and BLR host cell proteome to guide purification process development”,对两种广泛使用的大肠杆菌菌株BLR和HMS174的完整宿主细胞蛋白质组进行了表征,基于鉴定到的蛋白质组学数据,结合表达水平、疏水性、等电点(pI)、分子量(MW)、亚基信息、可能的翻译后修饰(PTMs)和每种可能的基因产物的毒性等信息进一步构建了全面的宿主细胞蛋白质资源库。其中,HCP质谱数据深度解析使用PEAKS®️ Studio完成。

图1 HCP纯化过程开发方法示意图
菌株宿主细胞蛋白全面表征
首先基于shot gun蛋白质组学方法鉴定了BLR和HMS174菌株的全蛋白质组,并通过Matlab和其他软件工具预测了蛋白的疏水性/pI/电荷/毒性等理化性质,构建了全面的蛋白信息资源库。
然后,作者比较了BLR和HMS174(空载质粒)菌株之间的蛋白质组学表达谱,约80%的蛋白在两个菌株中均被检测到,且其蛋白相对丰度(PAI)的线性回归结果表明,即使在不同的大肠杆菌菌株之间,HCPs的总量也是相当的(图2A)。此外,我们比较了BLR空载质粒菌与相应抗原表达菌株之间的蛋白表达,发现约90%的蛋白在两个样品中是相同的,但丰度存在少许差异(图2B),可能是与制备过程的细微差异有关,因为抗原表达菌株纯化前会有一次冻融。另一个原因可能是抗原的表达会对检测到的宿主细胞蛋白质产生一定的影响,但这种差异一般很小,因此空载质粒菌株的蛋白表达可以用于指导抗原表达菌株的纯化工艺。

图2 菌株蛋白差异比较
HCP蛋白丰度与分子量、等电点和疏水性分布
作者比较了空载质粒BLR与HMS174菌株中分别表达的“抗原1”和“抗原2”与HCPs的MW(分子量)、pI(等电点)、GRAVY(疏水性)等指标。在两个菌株中,HCPs的分子量总体分布在2 - 250 kDa,大多数蛋白质的分子量< 50 kDa(图3A和3D),丰度较高的蛋白质均分布在低分子量范围内。抗原1的分子量为59 kDa,而抗原2的分子量小一些,为28 kDa。可以初步利用基于分子大小的分离机制,例如SEC,将抗原从分子量相差较大的HCPs中分离出来。但是在剩下的高丰度HCPs的区域,通过质量差来分离目标抗原的效果可能就不是很理想了。
HCPs的pI分布范围为pH 3.4-12.2,其中大多数蛋白质是酸性的(图3B和3E)。在pI为7和8之间检测到的蛋白较少,这是因为大肠杆菌的胞内pH为7.5,降低了具有相似pI蛋白质的稳定性。抗原1和抗原2的pI分布区间内鉴定的蛋白均较少,说明两种抗原的pI都与HCPs有显著不同,因此可以考虑IEX等方法进行分离。
所有蛋白的预测GRAVY值范围为−1.526~+1.369。抗原1的GRAVY值与大多数HCPs相差较大,因此可以使用HIC等方法基于疏水性进行分离。
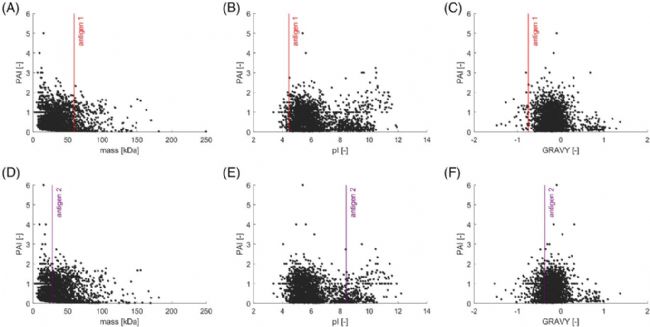
图3 HCP属性比较
HCP疏水性与等电点
作者进一步比较了HCPs的疏水性(GRAVY)与pI,并绘制了20个丰度最高的HCPs和模型抗原的分布图(图4B和4D)。由于pI和GRAVY均较低,因此IEX和HIC的组合方案更加适合用于抗原1的纯化。抗原2的疏水性与其他HCPs没有显著差异,而pI则差异较大,因此IEX更加适合抗原2的纯化。
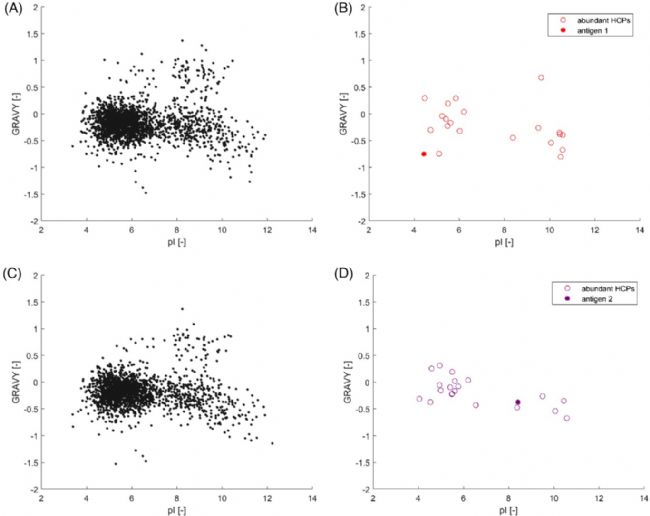
图4 疏水性与等电点分布
HCP净电荷与疏水性
蛋白质的净电荷状态取决于溶剂或缓冲液的pI和pH值。因此,了解不同pH值下HCPs的净电荷有助于在使用IEX时选择最合适的条件。作者计算了pH为7.0时HCPs的净电荷,并将它们与预测的GRAVY值进行了对比,结果如图5所示。
BLR菌株中,抗原1带较多的负电荷,且与其他HCPs相比具有显著差异(图5B),因此可以考虑使用pH =7.0的阴离子交换色谱法进行吸附-洗脱分离。HMS174中大多数高丰度的HCPs在pH= 7.0时带负电荷,抗原2带少量正电荷,因此可以通过阳离子交换色谱法结合低离子强度的盐洗脱方法进行纯化,或者在流动模式下使用阴离子交换色谱法分离。

图5 蛋白电荷(pH=7)与疏水性分布
综上,该研究对广泛使用的大肠杆菌菌株BLR和HMS174的完整宿主细胞蛋白质组进行了全面表征,并通过整合疏水性(GRAVY)、pI和不同pH值下的预测净电荷等理化性质,构建了全面的大肠杆菌HCP蛋白质组属性资源库,可用于高效的纯化工艺设计,避免了较高的试错成本和单一的基于专家知识依赖的选择。
原文链接:https://analyticalsciencejournals.onlinelibrary.wiley.com/doi/10.1002/biot.202300068
若您想深入了解PEAKS®️ Studio软件在HCP领域的功能和应用,欢迎扫描下方二维码咨询我们!
参考文献
1. Bracewell, D. G., Francis, R., & Smales, C. M. (2015). The future of host cell protein (HCP) identification during process development and manufacturing linked to a risk-based management for their control.Biotechnology and Bioengineering, 112, 1727–1737.
2. Jones, M., Palackal, N., Wang, F., Gaza-Bulseco, G., Hurkmans, K., Zhao,Y., Chitikila, C., Clavier, S., Liu, S., Menesale, E., Schonenbach, N. S.,Sharma, S., Valax, P.,Waerner, T., Zhang, L., & Connolly, T. (2021). “Highrisk” host cell proteins (HCPs): A multi-company collaborative view.Biotechnology and Bioengineering, 118, 2870–2885.
3. Vanderlaan, M., Zhu-Shimoni, J., Lin, S., Gunawan, F., Waerner, T., &Van Cott, K. E. (2018). Experience with host cell protein impurities in biopharmaceuticals. Biotechnology Progress, 34, 828–837.
4. Krutzke, L., Roesler, R., & Wiese, S. (2021). Research Square, DOI 10.21203/rs.3.rs-477964/v1.

-扫码关注-
www.bioinfor.com (EN)
www.deepproteomics.cn(CN)
作为生物信息学的领军企业,BSI专注于蛋白质组学和生物药领域,通过机器学习和先进算法提供世界领先的质谱数据分析软件和蛋白质组学服务解决方案,以推进生物学研究和药物发现。我们通过基于AI的计算方案,为您提供对蛋白质组学、基因组学和医学的卓越洞见。旗下著名的PEAKS®️系列软件在全世界拥有数千家学术和工业用户,包括:PEAKS®️ Studio,PEAKS®️ Online,PEAKS®️ GlycanFinder, PEAKS®️ AB及抗体综合表征服务等。
联系方式:021-60919891;sales-china@bioinfor.com





