染色质重塑/组蛋白修饰/DNA甲基化应用:人早期胚胎发育的表观遗传调控
哺乳动物发育研究促进了对协调胚胎发生遗传、表观遗传和细胞过程的理解,并揭示了对人类胚胎发生特异性新见解。最近研究生成了人类早期胚胎发生的第一个表观遗传学图谱,激发了关于表观遗传学重编程、细胞命运调控以及支撑人类胚胎发育可塑性的潜在机制新想法。本综述讨论了这些对人类早期发育的表观遗传学调控新见解以及这些过程对保护发育的重要性,还强调了尚未解决的问题和尚待解决的关键挑战。
背景(Introduction)
表观基因组在胚胎发育的最初几天会发生巨大变化。表观基因组重置和建立在胚胎发生的更广泛过程中进行协调和促进。因此需要表观遗传调控来保护发育并建立在整个生命过程中对基因组功能有影响的长期表观遗传状态。
表观遗传信息通过告诉细胞它们的过去、现在和未来来促进胚胎发育。它提供了对所做决定和过去遇到情况的分子记忆,将早期事件作为化学标记整合到基因组中并稳定传递。这些标记也会预示未来事件,尤其是谱系分化决定,并由不同的表观遗传调节因子的调控下发挥广泛作用,这些调节因子本身具有不同的功能并划分不同的基因组元件。多种表观遗传通路(包括染色质重塑、组蛋白修饰和DNA甲基化)的协调调控着基因时空表达,并严格限制胚胎发生过程中重复元件的必要但潜在有害的活动。
受精后,高度特化的精子和卵母细胞的表观基因组被重编程,以建立适合胚胎发育的全能性状态。母系遗传因素在受精后的前3天维持人类胚胎的分裂,然后在4细胞期(4C)到8细胞(8C)期发生胚胎基因组激活(embryonic genome activation,EGA)的主要波。经过EGA后,人类胚胎首先形成桑葚胚,然后形成具有明确内细胞团(ICM)的早期囊胚,植入囊胚有三种不同的细胞系:上胚层(epiblast,产生所有胎儿组织)、下胚层(hypoblast,形成卵黄囊)和滋养外胚层(trophectoderm,后来形成胎盘)。在接下来的一周内,胚胎形成额外的胚胎外谱系,外胚层开始按照原肠胚形成的预期进行定型,这在胚胎发生的第三周开始。
关于人类胚胎发生的许多知识来自于对组织学的集合研究。最近改进的方法使人类胚胎的体外培养和研究成为可能,直到大约胚胎第14天(E)。与此同时,由于人类胚胎研究存在重大技术和伦理挑战,大量的体外系统旨在复制全部或部分早期人类胚胎。这些细胞包括反映原肠胚形成前期的细胞,包括8c样细胞(8clc)、初始和启动的人多能干细胞(hPSCs)和谱系限制性细胞系。其中一些细胞类型还提供了构建更复杂结构的基础,如基于干细胞的整合模型(囊胚和植入后组装体)和非整合模型,如原肠样细胞。
本综述讨论了早期人类发育的表观遗传表征的新见解。这些研究对于理解表观遗传过程如何帮助调控和协调人类胚胎发生,以及表观遗传过程如何在这一时期与其他细胞和分子通路协调发生具有重要意义。对表观遗传过程的深入了解也将揭示表观基因组对遗传和环境变异的脆弱性。尽管重点是人类胚胎发育,但在相关条件下与其他物种的新数据以及基于干细胞的胚胎模型进行了比较。这些替代系统对于帮助建立发育过程中表观遗传过程的因果关系至关重要。此外还概述了当前的知识差距和关键的未决问题。
染色质重塑:打开胚胎基因组以塑造发育程序
在人类胚胎发生期间,染色质广泛重塑以改变其可及性,最大变化与关键发育的重要阶段重合(图1)。染色质可及性可定义为DNA可用于因子(包括转录机制和表观遗传修饰因子)结合的程度,其中主要决定因素包括核小体密度和间距。这样,染色质可及性代表了区域调控基因表达的潜力。

图1:人类胚胎发育中的整体表观基因组变化
染色质可及性(可及区域的数量)、组蛋白修饰和DNA甲基化的整体水平(黑色实线)的相对变化,以及TAD信号的相对变化。粉色和蓝色虚线分别表示母本和父本基因组之间的差异。灰色阴影表示变异性。橙色虚线表示食蟹猴胚胎的动态变化。Ecto,外胚层(ectoderm);Endo,内胚层(endoderm); Meso,中胚层(mesoderm);PS,原始条纹(primitive streak)。
酶的DNA可及性是用于定量染色质可及性的技术基础。这些酶既可以切割可及DNA (DNase-seq和ATAC-seq),也可以甲基化可及胞嘧啶(NOMe-seq),这两种酶都可以通过高通量测序进行检测。将这些方法应用于微量(low-input)和单细胞(single-cell)应用,能够对人类胚胎的染色质可及性进行分析。
这些研究的一致发现是,在2-细胞(2C)和囊胚期之间,人类胚胎基因组中已鉴定的可接近区域的数量逐渐增加(图1)。不同研究中增加的程度有很大差异,可能是由于用于鉴定可接近染色质的实验和计算方法不同。但总体趋势一致。与可接近区域的数量相反,在增加到囊胚期之前,从受精卵到8C期的总染色质可及性(通过基于甲基化的基因组中可及胞嘧啶比例定量确定)短暂降低。这一模式可能表明人类受精卵具有全基因组开放的染色质状态,这是切割方法无法检测到的。总之,这些染色质可及性的动态变化支持基因调控网络(GRNs)在早期发育过程中多次重塑,以建立新的发育程序。
受精卵的初始重塑定义pre-EGA染色质可及性
在整个人类胚胎发育过程中,可及性区域富集了启动子、CpG岛和远端调控元件(如增强子),与卵母细胞相比,超过8000个启动子在人类受精卵中获得可及性,这些启动子通常在植入前发育的整个过程中保持开放状态。
鉴于胚胎基因组的主要转录直到EGA才发生,那么在8C期之前大量可及性染色质区域的功能是什么?一种可能性是这些染色质变化是亲本基因组从配子状态重塑到胚胎状态的副作用。卵母细胞的染色质相对开放,而精子的染色质高度浓缩在人类胚胎中,受精后父源基因组的可及性迅速增加,达到高于母源基因组的水平。这种不对称差异一直维持至4C期,此时母本和父本基因组的可及性在EGA中相等。
另一种可能性是在受精卵中获得可及性区域支持次要EGA,即少量基因在主要pre-EGA转录。然而这并不能完全解释在pre-EGA胚胎中存在数千个可及区域。第三种情况与发育基因调控相关。人类2C胚胎中的大多数可及启动子也在8C期获得,尽管这些启动子转录不在2C期发生,但其中许多基因后来在8C期表达 (图2A)。因此,这些可接近启动子可能在2C期“蓄势”以备以后的激活,这意味着pre-EGA染色质谱的建立可能对EGA主要基因子集的及时表达非常重要。这种pre-EGA启动子形式已经在斑马鱼中报道过,在人类胚胎中,在pre-EGA获得可及性区域在代谢和生物合成等功能上富集。单细胞方法表明,相同胚胎期的单个细胞之间总是可接近这些区域 (图2B)。与在早期发育后期获得可及性或以更异质性方式获得可及性的基因相比,这种早期可及性获得同质模式的基因在EGA后表达更高。因此,pre-EGA染色质可及性景观也可能为重要的管家(housekeeping)基因提供高水平表达的基础,从而为发育过程的发生提供基础。
图2:人类植入前胚胎发育中染色质可及性和组蛋白修饰的区域特异性动态变化
EGA的主要染色质可及性重塑
早期人类胚胎中染色质可及性的最大差异,特别是在启动子上,区分了4C和早期与8C和后期。这个分离点与EGA一致,事实上,大多数在EGA转录上调的基因在4C和8C期之间变得可接近。
这种染色质谱的重塑在EGA中是否具有功能作用?单细胞中染色质可及性和转录组的联合分析显示,从2C到桑椹胚期的基因表达动态反映在其启动子和假定的远端调控区的可及性动态。这些关系的因果关系尚不清楚。许多启动子在EGA处表现出其可及性区域扩大,这与转录增加一致。然而在经转录抑制剂α-amanitin处理的胚胎中,大多数启动子的可及性区域都会扩大。这表明,至少对于启动子来说,可及性增加主要先于基因表达增加。相反,可接近启动子的转录非依赖性扩大可以通过重新定位核小体的整体过程来介导。相反,α-amanitin处理也导致8C胚胎具有类似于Pre-EGA胚胎的远端调节元件可及性。这表明转录对于EGA染色质可及性的改变是必要的,至少在远端元件是如此。总之,调控区域染色质可及性与基因表达相关;然而染色质可及性变化可能在不同的调控区环境中驱动或反映EGA结果。
染色质可及性变化与谱系特异性有关
从人类发育的桑葚胚期及其以后在其启动子处获得可及性的基因在发育过程中富集。这一可及性的增加先于第一次谱系决定,表明染色质可及性可能在细胞谱系分离过程中对GRN形成具有重要的功能。仅从转录组数据就可以推断出GRN。然而,在GRN分析中纳入染色质可及性数据可提高准确性,特别是对于人类胚胎数据等低样本量的数据,并且可以预测增强子相关性。这些方法在人类囊胚谱系中鉴定出保守的GRN,由JUND和SOX4组成,它们共同调节TFAP2C表达,而TFAP2C又调控GCM1表达。这些结果强调了染色质可及性图谱对于理解GRN在早期胚胎发育过程中如何变化的价值。
可能影响细胞命运决定的另一个重要特征是,染色质可及性(尤其是启动子)的细胞间变化从桑葚胚期开始显著增加(图1)。启动子可及性与这些区域的基因表达呈强相关,这意味着启动子可及性变化可能驱动基因表达变化(图2B)。同时,ICM调节因子(OCT4、KLF和SOX家族)和滋养细胞外胚层调节因子(GATA和TEAD家族)的motif区域富集。因此,胚胎内染色质可及性异质性可能提供了细胞命运决定的灵活性,或使细胞偏向于特定命运。
尽管人类胚胎中介导与谱系分离和变化相关的染色质可及性变化因子尚未鉴定,但有几个很有前景的线索。这包括早期小鼠胚胎发育所需的核小体重塑复合物(SWI/SNF、CHD和ISWI) ,以及与初始hPSCs中的外胚层转录因子OCT4相关的核小体重塑SNF2家族亚基,以调节囊胚谱系基因。此外虽然在人类植入前发育的所有阶段,可及性和DNA甲基化之间呈负相关,但在同一胚胎期细胞中,染色质可及性最可变区域是最一致的低甲基化区域。这表明低甲基化可能支持染色质可及性变化。这可能通过允许甲基化微小变化驱动核小体占位实质性变化,从而实现染色质可及性。或者低甲基化可能构成一种允许其他因子(包括转录因子)结合的状态,而转录因子又根据可变的可利用性影响染色质可及性。通过这种方式,染色质重塑和DNA甲基化互作可能有助于人类早期发育的细胞可塑性。
对于大多数启动子,post-EGA期可及性增加与该阶段各自基因转录相关。然而其他基因显示出更复杂的关系,可能意味着调控发育基因的不同机制。高达30%启动子在8C或桑椹胚期可及,但在post-EGA植入前期没有表达。这些启动子可以在植入后期被激活。虽然这种可能性需要进一步研究,但一项相关发现是8CLC可及区域富集通常与原肠胚形成后谱系相关的转录因子motif。这些可及基因可能在早期表达,但在被其他过程沉默时保持其可及性。一个例子是EGA基因在桑葚胚期被沉默。
人类胚胎植入后的染色质可及性还有待研究。因此染色质可及性谱如何在植入后谱系中解决仍然未知。然而染色质可及性已在食蟹猴胚胎植入后发育中进行了研究。该研究结果表明,染色质可及性在原始条索状细胞中达到峰值,之后在分化较强的胚层谱系中下降(图1)。这在人类胚胎中是否保守具有重要意义。为此研究者在基于干细胞植入后人类发育模型中共同研究了染色质可及性和转录组数据进行联合分析,以研究这一人类模型对灵长类胚胎是否显示出类似的染色质可及性动态变化,以及植入后的谱系命运是否可能在发育早期就已确定。
总之染色质重塑改变了早期人类胚胎发育的多个时期可及性图谱,并涉及从胚胎转录激活到未来基因表达鉴定等广泛过程。关键问题包括:启动子状态是否持续至植入后阶段?染色质可及性变化是否指导细胞命运决定,这种变化的诱导因子?人类胚胎发育背景下可及性区域广度如何影响区域调控潜力?转录因子、核小体重塑因子和转录本身可能部分导致染色质可及性变化。然而染色质重塑发生在更广泛的表观遗传重编程背景下,因此DNA甲基化和组蛋白修饰变化也可能有助于染色质重塑的最终功能结局。
组蛋白修饰:基因组激活和发育基因的动态调控因子
与染色质可及性相似,组蛋白修饰在发育过程中也高度动态(图1)。组蛋白修饰变化普遍存在,发生在不同的发育时期和不同类型的基因组区域之间。组蛋白修饰具有组合作用,大致可分为两类:(1)促进性染色质相关修饰,如启动子上的H3K4me3,增强子和其他基因间区域的H3K4me1,以及活性增强子和启动子上的H3K27ac;(2)抑制性染色质相关修饰,如H3K27me3和H3K9me3。每一种修饰又会招募下游效应因子,进而介导对基因组功能和活性的进一步影响。可以识别或调节组蛋白的系统具有多种亚基、亚型和变异体,其复杂性非常巨大,而且还在不断扩大。
发育过程中组蛋白修饰图谱绘制落后于其他表观遗传标记,主要是因为组蛋白分析方法通常需要数千~数百万个细胞,因此与可用胚胎细胞数量匹配。同时也已经开发出需要更少样本的方法,例如low-input染色质免疫沉淀测序(ChIP-seq)、CUT&RUN和CUT&Tag,并已被用于生成第一个人类胚胎和其他物种的组蛋白修饰图。
卵母细胞和早期胚胎中的经典和非经典组蛋白修饰模式
在哺乳动物卵母细胞和早期胚胎生长过程中,组蛋白标记沉积在时间和空间上受到高度调节。人类和其他哺乳动物的卵母细胞含有较大的非转录部分DNA甲基化结构域(PMDs)。在大多数哺乳动物物种中,卵母细胞中的PMD由H3K4me3标记。但在人类卵母细胞中,PMDs没有被H3K4me3标记,相反卵母细胞在基因启动子处具有H3K4me3强富集的狭窄区域的典型模式,精子中也存在类似的模式(图2A)。受精后,2C和4C人类胚胎在卵母细胞遗传的PMD中获得中等水平的H3K4me3。这样pre-EGA人类胚胎获得了在这个发育期与小鼠胚胎更相似的一种整体H3K4me3模式。然而与小鼠相比,人类卵母细胞PMDs中H3K4me3增加是有限,因为这些区域的H3K4me3水平相对于启动子中的H3K4me3水平较低,并且也仅限于富集基因的卵母细胞的PMD子集。此外一些启动子获得H3K4me3,与转录无关,但似乎反映了活性甲基转移酶的靶向性,特别是对未甲基化的CpG富集区域。在小鼠中,H3K4甲基转移酶KMT2B在启动子和PMD上以不依赖转录的方式催化H3K4me3,并可能在pre-EGA人类胚胎发挥类似作用。
其他组蛋白修饰的式在物种间更为保守。在人类和其他物种的卵母细胞中,PMD具有广泛的H3K27me3覆盖率。虽然这种覆盖率功能尚不确定,但小鼠卵母细胞和早期胚胎中较大的基因间H3K27me3修饰区域形成了自我互作结构域,据推测这些结构域可以划分母本基因组以诱导抑制重复元件。H3K27me3也存在于人类卵母细胞、精子和早期胚胎中,位于与发育基因启动子重叠的强富集典型位点。H3K9me3相对于其他胚胎期,在人类卵母细胞的基因密集区域富集,这可能提供了抑制卵母细胞转录的另一种机制。
到2C期,大多数精子遗传的H3K27me3丢失,而卵母细胞特异性H3K27me3被短暂保留,然后在4C期去除。这些动态变化与受精后的牛和猪胚胎相似,但与小鼠胚胎不同,小鼠胚胎在囊胚期前保留了一些卵母细胞遗传的H3K27me3。这些差异对小鼠依赖卵母细胞来源的H3K27me3维持过程具有重要意义。与受精后PMD中H3K27me3去除相一致,这些广泛区域中的大多数基因在2C和4C胚胎中被H3K27ac标记,与H3K4me3重叠。鉴于这些结构域在卵母细胞中被H3K27me3修饰,H3K27ac很可能在受精后的PMDs中de novo 建立。需要在人卵母细胞对H3K27ac进行分析来证实这一假设。
特别重要的是这些表观基因组变化是否调控EGA基因激活。可能调节EGA基因的增强子序列经历重编程,从而导致H3K9me3丢失,并在4C期和8C期之间更易接近性,这与EGA基因被激活时间相对应。通过表达dCas9-KRAB诱导H3K9甲基转移酶的位点特异性募集,从而在人类胚胎中实验性强制H3K9me3的持久性,导致EGA基因不能完全激活和发育迟缓。这些实验表明EGA基因调控区域需要重塑,以调控其在发育过程中的激活时间。另一种可能性是4C胚胎中广泛的H3K4me3结构域有助于瞬时抑制EGA直到合适时间。这一观点在小鼠和猪受精卵中H3K4me3去甲基化酶敲除的研究中得到支持,这导致EGA基因激活减少且未能发育到囊胚期。这表明及时解决这些大结构域是必需步骤。成功EGA可能需要将H3K27ac的广泛结构域分解成narrow peaks,因为人类受精卵中组蛋白去乙酰化酶失活限制EGA基因子集转录诱导。总之,EGA前调控去除特定组蛋白修饰是确保发育进展的主要表观遗传事件。
Post-EGA表观遗传重构建立新的发育程序
从8C期到囊胚期人类胚胎发育涵盖了广泛的组蛋白修饰变化(图2A)。这一时期的一个显著特征是8C人类胚胎中几乎不存在H3K27me3。这可能是由于缺乏母体提供的催化H3K27me3的polycomb蛋白,以及受精后不久H3K27me3(尤其是精子来源的H3K27me3)主动清除。在EGA之前,启动子区H3K27me3的去除在物种间高度保守。
8 C期EGA显著改变了表观遗传修饰因子丰度,每个修饰因子都有其对经典或非经典靶点偏好。因此,EGA(母系遗传)前与EGA(基因组转录)后表观遗传修饰因子可用性差异重塑表观基因组。例如,Polycomb组蛋白在EGA之后转录,并在发育基因附近沉积H3K27me3,在此过程中将大多数CpG富集调节区域分解为活性、二价或抑制染色质状态(图2A)。确认共修饰的二价核小体(H3K27me3和H3K4me3)需要进一步分析,如单核小体分析或ChIP分析。H3K27me3的另一个潜在功能是在EGA完成后帮助抑制启动EGA基因。在囊胚中,H3K27me3存在于EGA基因启动子处,表明其可能在影响EGA退出中发挥作用。已在牛胚胎中使用α-amanitin蛋白阻断胚胎基因组转录,从而诱导polycomb组蛋白表达。处理后胚胎的染色质状态保持在pre-EGA模式,表明转录和激活polycomb组蛋白表达是重组EGA后表观遗传图谱所必需。H3K4me3水平在4C和8C期间也发生显著变化,这与卵母细胞遗传的PMDs中H3K4me3减少和许多基因启动子中H3K4me3减少有关。这些变化伴随着H3K4去甲基化酶KDM5B的转录诱导和H3K4甲基转移酶KMT2B的下调,尽管这些蛋白在人类胚胎中的功能作用尚未验证。
一个关键的问题是为什么胚胎在早期胚胎发生中经历组蛋白标记重编程。有几个潜在的原因:解决预先存在的染色质状态,去除亲本遗传的表观遗传标记和表观突变(epimutations),或支持发病和关闭EGA。无论是什么原因,一旦重置,新的染色质状态将继续建立,由CpG序列存在、染色质蛋白可用性以及与其他基因调控过程互作,从而导致顺式调控区域的重新标记和发育程序出现。
组蛋白修饰对胚胎谱系分化的影响
组蛋白修饰是否以及如何影响植入前人类胚胎的谱系命运是重要的,尚未解决的问题。一些外胚层特异性和内胚层特异性基因在滋养外胚层细胞中被H3K27me3标记,尽管大多数滋养外胚层特异性基因在早期胚泡的ICM细胞中基本上没有H3K27me3。这些不对称模式可能会随着胚胎的发育而加强谱系决定。在牛胚泡中也观察到了某些谱系调节因子的交叉抑制模。事实上,干扰H3K27me3在人胚泡细胞和初始hPSC中的沉积会导致从外胚层样状态转变为滋养外胚层样状态。
同样的,可以拮抗某些转录因子与其靶序列结合的H3K9me3也可能有助于形成新的GRN。H3K9me3沉积中的细胞特异性差异可能通过限制早期滋养外胚层中的特定转录因子结合和激活可能促进ICM命运的基因来加强谱系障碍。为了进一步定义GRN,绘制H3K27ac和染色质可及性已经确定了8C和ICM细胞中假定的活性增强子(图2A)。在这些增强子上富集的DNA序列包括那些与谱系限制性转录因子的目标motif匹配的序列。
总之,在早期人类胚胎发育过程中,组蛋白修饰在全基因组范围内发生重大变化,且在EGA因子和发育基因调控的特定基因组表征上发生变化。关键的未解决问题包括:组蛋白修饰是否调控EGA基因的及时诱导和随后的抑制?染色质修饰过程在赋予早期胚胎细胞与多谱系分化的持续能力相关的发育可塑性方面的确切作用是什么?在更多的胚胎期(包括植入后)对组蛋白修饰进行进一步分析,以及有针对性的表观基因组工程和功能丧失方法,以检测定义因子在胚胎和胚胎模型中的致病作用,将有助于克服其中一些知识空白。更广泛地说,在其他情况下的研究已经证实,染色质的组蛋白状态也决定了其他基本的细胞过程,包括DNA复制和DNA修复。更好地了解组蛋白修饰与早期人类胚胎发生中DNA复制/修复之间的关系是一个很有前景的研究方向。鉴于人类胚胎中非整倍体细胞的高发生率,这一点尤其重要。
DNA甲基化:保护基因组稳定性和发育基因表达
DNA甲基化是指在胞嘧啶中添加甲基以形成5-甲基胞嘧啶(5-methylcytosine, 5mC),其主要发生在CpG二核苷酸上。DNA甲基化模式由DNA甲基转移酶DNMT3A和DNMT3B建立,并由DNMT1维持,非催化蛋白DNMT3L作为辅因子,在它们缺失的情况下,5mC通过被动去甲基化或通过TET羟化酶将5mC氧化成5-羟甲基胞嘧啶(5-hydroxymethylcytosine, 5hmC)的主动DNA去甲基化从基因组中去除。检测胚胎发生过程中DNA甲基化的主要方法是用识别5mC的抗体进行免疫细胞化学和分析技术,包括简化基因组甲基化测序(reduced representation bisulfite sequencing,RRBS),全基因组重亚硫酸盐测序(whole-genome bisulfite sequencing,WGBS)和PBAT甲基化测序(post-bisulfite adapter tagging)。
胚胎植入前发育过程中DNA去甲基化和甲基化变化
DNA甲基化的重编程涉及在人类胚胎发育的植入前和植入后期去除和重建DNA甲基化模式(图1)。这些事件对于重置遗传亲本甲基化至关重要,从而构建新的DNA甲基化谱。
整体DNA甲基化去除发生在植入前人类胚胎发育的几个时期。受精后12小时内发生了一次主要的去甲基化,其中基因间区域(如增强子)以及基因体区域主要发生去甲基化。从受精卵后期到2C期,然后从8C到桑椹胚和胚泡期,进一步发生去甲基化。在这些阶段,内含子和SINE元件尤其是年轻Alu亚家族的去甲基化很明显。小鼠中有几个因子与受精卵的快速去甲基化有关,最显著的是TET3,小鼠胚胎分析显示,去甲基化位点在5hmC中大量富集。TET3在人卵母细胞中也高表达;然而,介导去甲基化过程的机制以及不同机制是否在不同时期起作用仍有待在人类胚胎中进行实验验证。
几项研究进一步确定了父源基因组和母源基因组之间去甲基化存在显著差异。与小鼠类似,人类精子的甲基化水平高于卵母细胞,在胚胎植入前的所有时期,父源基因组经历更快的去甲基化,而母源基因组在所有植入前阶段都保持较高的残留甲基化水平。除了不同的亲本效应外,甲基化标记的基因组位点也存在差异,从而在受精卵的两个亲本基因组之间产生差异甲基化区域:父本高甲基化区域在基因间区域相对富集,而母本高甲基化区域在基因内区域富集,包括外显子和内含子。这些母系遗传的甲基化标记中的一些一直持续到胚泡期和胎盘中。除了几个特定序列外,由于亲本基因组之间的大多数DNA甲基化差异似乎不影响植入前阶段的等位基因特异性基因表达,亲本特异性甲基化的功能重要性仍不确定。
发育中的胚胎中的大多数常染色体基因都在两个基因组中表达,但一组印迹基因表现出亲本依赖性表达,其中一个拷贝被关闭。在这些印迹基因中,一个等位基因在配子发生过程中在其相应的初级印迹调控区(ICR)被DNA甲基化标记。为保护ICR免受去甲基化,在人类发育过程中保护ICR的蛋白质开始被发现,并且可能具有物种特异性。其他逃脱DNA去甲基化区域由一个年轻的LINE家族代表,特别是L1PA家族。这表明了一种保护机制,可以防止这些进化上年轻的转座元件激活。
尽管在植入前发育过程中发生了甲基化丢失,但从4C期到8C期也发生了de novo DNA甲基化。新的甲基化区域在重复元件富集,例如SINE,LINEs和长末端重复序列(LTR)。且经历de novo甲基化的区域通常在桑椹胚和囊胚期再次去甲基化,强调了甲基化变化的瞬时性和动态性。
DNA甲基化对植入后胚胎发育的影响
在人类囊胚中,ICM和滋养外胚层具有相似的DNA甲基化谱,表明滋养外胚层的初始诱导在很大程度上独立于DNA甲基化。然而DNA甲基化如何影响人类胚胎的谱系成熟和植入后发育是关键问题。植入后人类胚胎的DNA甲基化组分析表明,相当大的DNA再甲基化发生在E7和E12之间。调节de novo甲基化机制已在小鼠中得到表征,但DNMT3A和DNMT3B的相对功能贡献(两者在植入后在人类胚胎中转录上调)仍有待在人类植入后发育中进行实验验证。人类胚胎的外胚层,滋养外胚层和内胚层在DNA de novo甲基化模式中具有显著的变异性和不同步性。特别是植入后,植入后,与外胚层和滋养外胚层谱系的细胞相比,内胚层的DNA再甲基化速度较慢,并且在同一发育时期,内胚层的中位DNA甲基化水平约为外胚层的一半(33%:60%)。这表明尽管外胚层和内胚层细胞都起源于ICM,但它们具有不同的DNA再甲基化机制。也许这表明在这个特定的发育时期,相对于外胚层谱系,内胚层具有更大的发育可塑性。
三个谱系中的DNA再甲基化也发生在具有谱系特异性表征的特定基因组元件上。在植入后人类发育过程中,超过200个启动子区域DNA甲基化。此外,E8的每个细胞谱系都具有特定的甲基化模式:外胚层相关基因的启动子在滋养外胚层中被甲基化,但在外胚层和内胚层谱系中均未被甲基化。相比之下,滋养外胚层限制基因的启动子在外胚层和内胚层谱系中被甲基化,内胚层相关基因启动子在外胚层和滋养外胚层谱系中被甲基化。这些发现表明DNA甲基化一旦形成,可能有助于维持不同的谱系命运。
通过原肠胚形成和神经形成期培养食蟹猴胚胎的新方法,为研究植入后胚胎的表观遗传变化提供了机会。单细胞多组学分析结果表明,食蟹猴胚胎在每种鉴定的细胞类型中都会经历特定的DNA甲基化模式。胚胎细胞的DNA甲基化水平明显高于胚外细胞。这一发现与先前在小鼠和人类中的报道一致。重要的是,食蟹猴胚胎中的启动子区域、LINEs、LTR区域和SINEs在食蟹猴胚胎中显示出与在每种细胞类型中观察到的总体DNA甲基化相似模式。然而,这些元件中的每一个都表现出不同程度的甲基化,这与小鼠的观察结果一致。
总之,DNA甲基化在早期胚胎发生过程中是一个高度动态的过程,涉及一系列的去甲基化和de novo甲基化。关键的问题包括:植入后人类胚胎发育中DNA甲基化的谱系特异性变化、基因组特征和功能调节因子是什么?植入前和植入后的物种特异性DNA甲基化模式是什么,这些信息可以更全面地了解进化过程中保守的DNA甲基化模式?
人类发育表观遗传学的重要性
确保胚胎发生过程中忠实的表观遗传调控的重要性不仅体现上述实验研究,而且还体现在表观遗传过程破坏的个体发育结果以及在某些人类胚胎模型和类器官中丧失表观遗传保真度中。
在模式生物中,许多表观遗传调节因子编码基因的纯合突变会导致早期发育失败。据推测,人类类似功能丧失突变也会导致早期妊娠丢失。人类其他突变(通常为杂合突变或半合突变)通常与发育一致,但可引起多种先天性疾病,包括Rubinstein-Taybi综合征(乙酰转移酶CBP和p300编码基因突变)、ICF综合征(通常与DNA甲基转移酶DNMT3B编码基因突变相关)和Kabuki综合征(影响组蛋白甲基转移酶KMT2D遗传变异)。
另一个重要特征是表观基因组建立可以使早期人类胚胎特别容易受应激或表观基因组改变过程中的变化影响。这种脆弱性与理解早期环境暴露的后果以及体外培养改变卵母细胞和植入前胚胎表观基因组的潜力相关。鉴于辅助生殖技术的日益普及,目前的工作至关重要,以确定这些技术对发育表观基因组的影响。
最后,必须强调的是,广泛应用的体外细胞模型也可能发生异常表观基因组变化。hPSCs基因组印记和XCI变化影响胚胎模型和这些细胞系源类器官的保真度。进一步的意义是,目前由初始hPSCs生成的大多数人类母细胞模型由于异常印记而存在“内在缺陷”。由于印记基因的忠实调控是哺乳动物发育所必需的,因此这一缺陷可能会限制人类母细胞持续发育的能力。未来的培养方法无疑将支持在初始hPSCs中维持正常印记,但在短期内,这一表观遗传异常对有关母细胞和其他胚胎模型的发育潜力和生存力的科学、伦理和政策讨论具有影响。即使在hPSCs中大多数印记达到了完美的保真度,重要的是要注意,胎盘特异性DNA甲基化印记在包括hPSCs在内的表母细胞来源的细胞系中缺失。胎盘印记及其相关基因的错误调节会破坏hPSCs来源的滋养层细胞的诱导和生长,因此,这种内在的错误调节也可能影响hPSCs来源的胚外细胞类型的干细胞胚胎模型的保真度。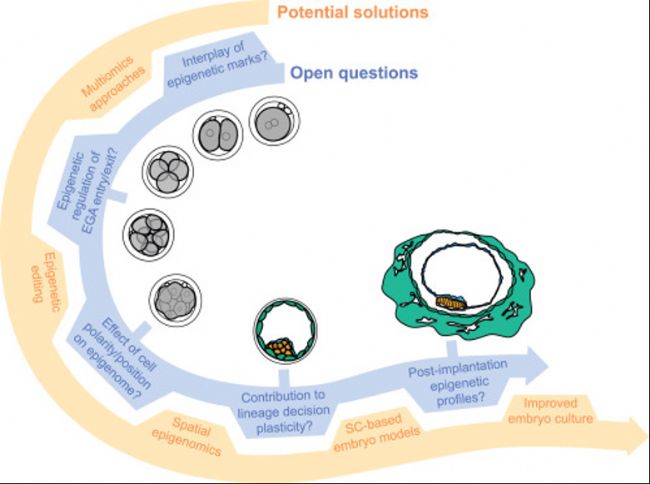
参考文献:
Wilkinson AL, Zorzan I, Rugg-Gunn PJ. Epigenetic regulation of early human embryo development. Cell Stem Cell. 2023 Oct 12. pii: S1934-5909(23)00331-4. doi: 10.1016/j.stem.2023.09.010. PubMed PMID: 37858333.
背景(Introduction)
表观基因组在胚胎发育的最初几天会发生巨大变化。表观基因组重置和建立在胚胎发生的更广泛过程中进行协调和促进。因此需要表观遗传调控来保护发育并建立在整个生命过程中对基因组功能有影响的长期表观遗传状态。
表观遗传信息通过告诉细胞它们的过去、现在和未来来促进胚胎发育。它提供了对所做决定和过去遇到情况的分子记忆,将早期事件作为化学标记整合到基因组中并稳定传递。这些标记也会预示未来事件,尤其是谱系分化决定,并由不同的表观遗传调节因子的调控下发挥广泛作用,这些调节因子本身具有不同的功能并划分不同的基因组元件。多种表观遗传通路(包括染色质重塑、组蛋白修饰和DNA甲基化)的协调调控着基因时空表达,并严格限制胚胎发生过程中重复元件的必要但潜在有害的活动。
受精后,高度特化的精子和卵母细胞的表观基因组被重编程,以建立适合胚胎发育的全能性状态。母系遗传因素在受精后的前3天维持人类胚胎的分裂,然后在4细胞期(4C)到8细胞(8C)期发生胚胎基因组激活(embryonic genome activation,EGA)的主要波。经过EGA后,人类胚胎首先形成桑葚胚,然后形成具有明确内细胞团(ICM)的早期囊胚,植入囊胚有三种不同的细胞系:上胚层(epiblast,产生所有胎儿组织)、下胚层(hypoblast,形成卵黄囊)和滋养外胚层(trophectoderm,后来形成胎盘)。在接下来的一周内,胚胎形成额外的胚胎外谱系,外胚层开始按照原肠胚形成的预期进行定型,这在胚胎发生的第三周开始。
关于人类胚胎发生的许多知识来自于对组织学的集合研究。最近改进的方法使人类胚胎的体外培养和研究成为可能,直到大约胚胎第14天(E)。与此同时,由于人类胚胎研究存在重大技术和伦理挑战,大量的体外系统旨在复制全部或部分早期人类胚胎。这些细胞包括反映原肠胚形成前期的细胞,包括8c样细胞(8clc)、初始和启动的人多能干细胞(hPSCs)和谱系限制性细胞系。其中一些细胞类型还提供了构建更复杂结构的基础,如基于干细胞的整合模型(囊胚和植入后组装体)和非整合模型,如原肠样细胞。
本综述讨论了早期人类发育的表观遗传表征的新见解。这些研究对于理解表观遗传过程如何帮助调控和协调人类胚胎发生,以及表观遗传过程如何在这一时期与其他细胞和分子通路协调发生具有重要意义。对表观遗传过程的深入了解也将揭示表观基因组对遗传和环境变异的脆弱性。尽管重点是人类胚胎发育,但在相关条件下与其他物种的新数据以及基于干细胞的胚胎模型进行了比较。这些替代系统对于帮助建立发育过程中表观遗传过程的因果关系至关重要。此外还概述了当前的知识差距和关键的未决问题。
染色质重塑:打开胚胎基因组以塑造发育程序
在人类胚胎发生期间,染色质广泛重塑以改变其可及性,最大变化与关键发育的重要阶段重合(图1)。染色质可及性可定义为DNA可用于因子(包括转录机制和表观遗传修饰因子)结合的程度,其中主要决定因素包括核小体密度和间距。这样,染色质可及性代表了区域调控基因表达的潜力。

图1:人类胚胎发育中的整体表观基因组变化
酶的DNA可及性是用于定量染色质可及性的技术基础。这些酶既可以切割可及DNA (DNase-seq和ATAC-seq),也可以甲基化可及胞嘧啶(NOMe-seq),这两种酶都可以通过高通量测序进行检测。将这些方法应用于微量(low-input)和单细胞(single-cell)应用,能够对人类胚胎的染色质可及性进行分析。
这些研究的一致发现是,在2-细胞(2C)和囊胚期之间,人类胚胎基因组中已鉴定的可接近区域的数量逐渐增加(图1)。不同研究中增加的程度有很大差异,可能是由于用于鉴定可接近染色质的实验和计算方法不同。但总体趋势一致。与可接近区域的数量相反,在增加到囊胚期之前,从受精卵到8C期的总染色质可及性(通过基于甲基化的基因组中可及胞嘧啶比例定量确定)短暂降低。这一模式可能表明人类受精卵具有全基因组开放的染色质状态,这是切割方法无法检测到的。总之,这些染色质可及性的动态变化支持基因调控网络(GRNs)在早期发育过程中多次重塑,以建立新的发育程序。
受精卵的初始重塑定义pre-EGA染色质可及性
在整个人类胚胎发育过程中,可及性区域富集了启动子、CpG岛和远端调控元件(如增强子),与卵母细胞相比,超过8000个启动子在人类受精卵中获得可及性,这些启动子通常在植入前发育的整个过程中保持开放状态。
鉴于胚胎基因组的主要转录直到EGA才发生,那么在8C期之前大量可及性染色质区域的功能是什么?一种可能性是这些染色质变化是亲本基因组从配子状态重塑到胚胎状态的副作用。卵母细胞的染色质相对开放,而精子的染色质高度浓缩在人类胚胎中,受精后父源基因组的可及性迅速增加,达到高于母源基因组的水平。这种不对称差异一直维持至4C期,此时母本和父本基因组的可及性在EGA中相等。
另一种可能性是在受精卵中获得可及性区域支持次要EGA,即少量基因在主要pre-EGA转录。然而这并不能完全解释在pre-EGA胚胎中存在数千个可及区域。第三种情况与发育基因调控相关。人类2C胚胎中的大多数可及启动子也在8C期获得,尽管这些启动子转录不在2C期发生,但其中许多基因后来在8C期表达 (图2A)。因此,这些可接近启动子可能在2C期“蓄势”以备以后的激活,这意味着pre-EGA染色质谱的建立可能对EGA主要基因子集的及时表达非常重要。这种pre-EGA启动子形式已经在斑马鱼中报道过,在人类胚胎中,在pre-EGA获得可及性区域在代谢和生物合成等功能上富集。单细胞方法表明,相同胚胎期的单个细胞之间总是可接近这些区域 (图2B)。与在早期发育后期获得可及性或以更异质性方式获得可及性的基因相比,这种早期可及性获得同质模式的基因在EGA后表达更高。因此,pre-EGA染色质可及性景观也可能为重要的管家(housekeeping)基因提供高水平表达的基础,从而为发育过程的发生提供基础。

图2:人类植入前胚胎发育中染色质可及性和组蛋白修饰的区域特异性动态变化
- 植入前胚胎发育过程中PMD、启动子和远端调控元件(包括增强子)的组蛋白修饰。
- 同一胚胎细胞在Pre-EGA和Post-EGA期的染色质可及性在管家基因中的变化,这些基因在Pre-EGA均匀可及,在Post-EGA表现出高表达;在发育基因中,这些基因在Pre-EGA不可及,在Post-EGA表现出不同水平的可及性和表达。
EGA的主要染色质可及性重塑
早期人类胚胎中染色质可及性的最大差异,特别是在启动子上,区分了4C和早期与8C和后期。这个分离点与EGA一致,事实上,大多数在EGA转录上调的基因在4C和8C期之间变得可接近。
这种染色质谱的重塑在EGA中是否具有功能作用?单细胞中染色质可及性和转录组的联合分析显示,从2C到桑椹胚期的基因表达动态反映在其启动子和假定的远端调控区的可及性动态。这些关系的因果关系尚不清楚。许多启动子在EGA处表现出其可及性区域扩大,这与转录增加一致。然而在经转录抑制剂α-amanitin处理的胚胎中,大多数启动子的可及性区域都会扩大。这表明,至少对于启动子来说,可及性增加主要先于基因表达增加。相反,可接近启动子的转录非依赖性扩大可以通过重新定位核小体的整体过程来介导。相反,α-amanitin处理也导致8C胚胎具有类似于Pre-EGA胚胎的远端调节元件可及性。这表明转录对于EGA染色质可及性的改变是必要的,至少在远端元件是如此。总之,调控区域染色质可及性与基因表达相关;然而染色质可及性变化可能在不同的调控区环境中驱动或反映EGA结果。
染色质可及性变化与谱系特异性有关
从人类发育的桑葚胚期及其以后在其启动子处获得可及性的基因在发育过程中富集。这一可及性的增加先于第一次谱系决定,表明染色质可及性可能在细胞谱系分离过程中对GRN形成具有重要的功能。仅从转录组数据就可以推断出GRN。然而,在GRN分析中纳入染色质可及性数据可提高准确性,特别是对于人类胚胎数据等低样本量的数据,并且可以预测增强子相关性。这些方法在人类囊胚谱系中鉴定出保守的GRN,由JUND和SOX4组成,它们共同调节TFAP2C表达,而TFAP2C又调控GCM1表达。这些结果强调了染色质可及性图谱对于理解GRN在早期胚胎发育过程中如何变化的价值。
可能影响细胞命运决定的另一个重要特征是,染色质可及性(尤其是启动子)的细胞间变化从桑葚胚期开始显著增加(图1)。启动子可及性与这些区域的基因表达呈强相关,这意味着启动子可及性变化可能驱动基因表达变化(图2B)。同时,ICM调节因子(OCT4、KLF和SOX家族)和滋养细胞外胚层调节因子(GATA和TEAD家族)的motif区域富集。因此,胚胎内染色质可及性异质性可能提供了细胞命运决定的灵活性,或使细胞偏向于特定命运。
尽管人类胚胎中介导与谱系分离和变化相关的染色质可及性变化因子尚未鉴定,但有几个很有前景的线索。这包括早期小鼠胚胎发育所需的核小体重塑复合物(SWI/SNF、CHD和ISWI) ,以及与初始hPSCs中的外胚层转录因子OCT4相关的核小体重塑SNF2家族亚基,以调节囊胚谱系基因。此外虽然在人类植入前发育的所有阶段,可及性和DNA甲基化之间呈负相关,但在同一胚胎期细胞中,染色质可及性最可变区域是最一致的低甲基化区域。这表明低甲基化可能支持染色质可及性变化。这可能通过允许甲基化微小变化驱动核小体占位实质性变化,从而实现染色质可及性。或者低甲基化可能构成一种允许其他因子(包括转录因子)结合的状态,而转录因子又根据可变的可利用性影响染色质可及性。通过这种方式,染色质重塑和DNA甲基化互作可能有助于人类早期发育的细胞可塑性。
对于大多数启动子,post-EGA期可及性增加与该阶段各自基因转录相关。然而其他基因显示出更复杂的关系,可能意味着调控发育基因的不同机制。高达30%启动子在8C或桑椹胚期可及,但在post-EGA植入前期没有表达。这些启动子可以在植入后期被激活。虽然这种可能性需要进一步研究,但一项相关发现是8CLC可及区域富集通常与原肠胚形成后谱系相关的转录因子motif。这些可及基因可能在早期表达,但在被其他过程沉默时保持其可及性。一个例子是EGA基因在桑葚胚期被沉默。
人类胚胎植入后的染色质可及性还有待研究。因此染色质可及性谱如何在植入后谱系中解决仍然未知。然而染色质可及性已在食蟹猴胚胎植入后发育中进行了研究。该研究结果表明,染色质可及性在原始条索状细胞中达到峰值,之后在分化较强的胚层谱系中下降(图1)。这在人类胚胎中是否保守具有重要意义。为此研究者在基于干细胞植入后人类发育模型中共同研究了染色质可及性和转录组数据进行联合分析,以研究这一人类模型对灵长类胚胎是否显示出类似的染色质可及性动态变化,以及植入后的谱系命运是否可能在发育早期就已确定。
总之染色质重塑改变了早期人类胚胎发育的多个时期可及性图谱,并涉及从胚胎转录激活到未来基因表达鉴定等广泛过程。关键问题包括:启动子状态是否持续至植入后阶段?染色质可及性变化是否指导细胞命运决定,这种变化的诱导因子?人类胚胎发育背景下可及性区域广度如何影响区域调控潜力?转录因子、核小体重塑因子和转录本身可能部分导致染色质可及性变化。然而染色质重塑发生在更广泛的表观遗传重编程背景下,因此DNA甲基化和组蛋白修饰变化也可能有助于染色质重塑的最终功能结局。
组蛋白修饰:基因组激活和发育基因的动态调控因子
与染色质可及性相似,组蛋白修饰在发育过程中也高度动态(图1)。组蛋白修饰变化普遍存在,发生在不同的发育时期和不同类型的基因组区域之间。组蛋白修饰具有组合作用,大致可分为两类:(1)促进性染色质相关修饰,如启动子上的H3K4me3,增强子和其他基因间区域的H3K4me1,以及活性增强子和启动子上的H3K27ac;(2)抑制性染色质相关修饰,如H3K27me3和H3K9me3。每一种修饰又会招募下游效应因子,进而介导对基因组功能和活性的进一步影响。可以识别或调节组蛋白的系统具有多种亚基、亚型和变异体,其复杂性非常巨大,而且还在不断扩大。
发育过程中组蛋白修饰图谱绘制落后于其他表观遗传标记,主要是因为组蛋白分析方法通常需要数千~数百万个细胞,因此与可用胚胎细胞数量匹配。同时也已经开发出需要更少样本的方法,例如low-input染色质免疫沉淀测序(ChIP-seq)、CUT&RUN和CUT&Tag,并已被用于生成第一个人类胚胎和其他物种的组蛋白修饰图。
卵母细胞和早期胚胎中的经典和非经典组蛋白修饰模式
在哺乳动物卵母细胞和早期胚胎生长过程中,组蛋白标记沉积在时间和空间上受到高度调节。人类和其他哺乳动物的卵母细胞含有较大的非转录部分DNA甲基化结构域(PMDs)。在大多数哺乳动物物种中,卵母细胞中的PMD由H3K4me3标记。但在人类卵母细胞中,PMDs没有被H3K4me3标记,相反卵母细胞在基因启动子处具有H3K4me3强富集的狭窄区域的典型模式,精子中也存在类似的模式(图2A)。受精后,2C和4C人类胚胎在卵母细胞遗传的PMD中获得中等水平的H3K4me3。这样pre-EGA人类胚胎获得了在这个发育期与小鼠胚胎更相似的一种整体H3K4me3模式。然而与小鼠相比,人类卵母细胞PMDs中H3K4me3增加是有限,因为这些区域的H3K4me3水平相对于启动子中的H3K4me3水平较低,并且也仅限于富集基因的卵母细胞的PMD子集。此外一些启动子获得H3K4me3,与转录无关,但似乎反映了活性甲基转移酶的靶向性,特别是对未甲基化的CpG富集区域。在小鼠中,H3K4甲基转移酶KMT2B在启动子和PMD上以不依赖转录的方式催化H3K4me3,并可能在pre-EGA人类胚胎发挥类似作用。
其他组蛋白修饰的式在物种间更为保守。在人类和其他物种的卵母细胞中,PMD具有广泛的H3K27me3覆盖率。虽然这种覆盖率功能尚不确定,但小鼠卵母细胞和早期胚胎中较大的基因间H3K27me3修饰区域形成了自我互作结构域,据推测这些结构域可以划分母本基因组以诱导抑制重复元件。H3K27me3也存在于人类卵母细胞、精子和早期胚胎中,位于与发育基因启动子重叠的强富集典型位点。H3K9me3相对于其他胚胎期,在人类卵母细胞的基因密集区域富集,这可能提供了抑制卵母细胞转录的另一种机制。
到2C期,大多数精子遗传的H3K27me3丢失,而卵母细胞特异性H3K27me3被短暂保留,然后在4C期去除。这些动态变化与受精后的牛和猪胚胎相似,但与小鼠胚胎不同,小鼠胚胎在囊胚期前保留了一些卵母细胞遗传的H3K27me3。这些差异对小鼠依赖卵母细胞来源的H3K27me3维持过程具有重要意义。与受精后PMD中H3K27me3去除相一致,这些广泛区域中的大多数基因在2C和4C胚胎中被H3K27ac标记,与H3K4me3重叠。鉴于这些结构域在卵母细胞中被H3K27me3修饰,H3K27ac很可能在受精后的PMDs中de novo 建立。需要在人卵母细胞对H3K27ac进行分析来证实这一假设。
特别重要的是这些表观基因组变化是否调控EGA基因激活。可能调节EGA基因的增强子序列经历重编程,从而导致H3K9me3丢失,并在4C期和8C期之间更易接近性,这与EGA基因被激活时间相对应。通过表达dCas9-KRAB诱导H3K9甲基转移酶的位点特异性募集,从而在人类胚胎中实验性强制H3K9me3的持久性,导致EGA基因不能完全激活和发育迟缓。这些实验表明EGA基因调控区域需要重塑,以调控其在发育过程中的激活时间。另一种可能性是4C胚胎中广泛的H3K4me3结构域有助于瞬时抑制EGA直到合适时间。这一观点在小鼠和猪受精卵中H3K4me3去甲基化酶敲除的研究中得到支持,这导致EGA基因激活减少且未能发育到囊胚期。这表明及时解决这些大结构域是必需步骤。成功EGA可能需要将H3K27ac的广泛结构域分解成narrow peaks,因为人类受精卵中组蛋白去乙酰化酶失活限制EGA基因子集转录诱导。总之,EGA前调控去除特定组蛋白修饰是确保发育进展的主要表观遗传事件。
Post-EGA表观遗传重构建立新的发育程序
从8C期到囊胚期人类胚胎发育涵盖了广泛的组蛋白修饰变化(图2A)。这一时期的一个显著特征是8C人类胚胎中几乎不存在H3K27me3。这可能是由于缺乏母体提供的催化H3K27me3的polycomb蛋白,以及受精后不久H3K27me3(尤其是精子来源的H3K27me3)主动清除。在EGA之前,启动子区H3K27me3的去除在物种间高度保守。
8 C期EGA显著改变了表观遗传修饰因子丰度,每个修饰因子都有其对经典或非经典靶点偏好。因此,EGA(母系遗传)前与EGA(基因组转录)后表观遗传修饰因子可用性差异重塑表观基因组。例如,Polycomb组蛋白在EGA之后转录,并在发育基因附近沉积H3K27me3,在此过程中将大多数CpG富集调节区域分解为活性、二价或抑制染色质状态(图2A)。确认共修饰的二价核小体(H3K27me3和H3K4me3)需要进一步分析,如单核小体分析或ChIP分析。H3K27me3的另一个潜在功能是在EGA完成后帮助抑制启动EGA基因。在囊胚中,H3K27me3存在于EGA基因启动子处,表明其可能在影响EGA退出中发挥作用。已在牛胚胎中使用α-amanitin蛋白阻断胚胎基因组转录,从而诱导polycomb组蛋白表达。处理后胚胎的染色质状态保持在pre-EGA模式,表明转录和激活polycomb组蛋白表达是重组EGA后表观遗传图谱所必需。H3K4me3水平在4C和8C期间也发生显著变化,这与卵母细胞遗传的PMDs中H3K4me3减少和许多基因启动子中H3K4me3减少有关。这些变化伴随着H3K4去甲基化酶KDM5B的转录诱导和H3K4甲基转移酶KMT2B的下调,尽管这些蛋白在人类胚胎中的功能作用尚未验证。
一个关键的问题是为什么胚胎在早期胚胎发生中经历组蛋白标记重编程。有几个潜在的原因:解决预先存在的染色质状态,去除亲本遗传的表观遗传标记和表观突变(epimutations),或支持发病和关闭EGA。无论是什么原因,一旦重置,新的染色质状态将继续建立,由CpG序列存在、染色质蛋白可用性以及与其他基因调控过程互作,从而导致顺式调控区域的重新标记和发育程序出现。
组蛋白修饰对胚胎谱系分化的影响
组蛋白修饰是否以及如何影响植入前人类胚胎的谱系命运是重要的,尚未解决的问题。一些外胚层特异性和内胚层特异性基因在滋养外胚层细胞中被H3K27me3标记,尽管大多数滋养外胚层特异性基因在早期胚泡的ICM细胞中基本上没有H3K27me3。这些不对称模式可能会随着胚胎的发育而加强谱系决定。在牛胚泡中也观察到了某些谱系调节因子的交叉抑制模。事实上,干扰H3K27me3在人胚泡细胞和初始hPSC中的沉积会导致从外胚层样状态转变为滋养外胚层样状态。
同样的,可以拮抗某些转录因子与其靶序列结合的H3K9me3也可能有助于形成新的GRN。H3K9me3沉积中的细胞特异性差异可能通过限制早期滋养外胚层中的特定转录因子结合和激活可能促进ICM命运的基因来加强谱系障碍。为了进一步定义GRN,绘制H3K27ac和染色质可及性已经确定了8C和ICM细胞中假定的活性增强子(图2A)。在这些增强子上富集的DNA序列包括那些与谱系限制性转录因子的目标motif匹配的序列。
总之,在早期人类胚胎发育过程中,组蛋白修饰在全基因组范围内发生重大变化,且在EGA因子和发育基因调控的特定基因组表征上发生变化。关键的未解决问题包括:组蛋白修饰是否调控EGA基因的及时诱导和随后的抑制?染色质修饰过程在赋予早期胚胎细胞与多谱系分化的持续能力相关的发育可塑性方面的确切作用是什么?在更多的胚胎期(包括植入后)对组蛋白修饰进行进一步分析,以及有针对性的表观基因组工程和功能丧失方法,以检测定义因子在胚胎和胚胎模型中的致病作用,将有助于克服其中一些知识空白。更广泛地说,在其他情况下的研究已经证实,染色质的组蛋白状态也决定了其他基本的细胞过程,包括DNA复制和DNA修复。更好地了解组蛋白修饰与早期人类胚胎发生中DNA复制/修复之间的关系是一个很有前景的研究方向。鉴于人类胚胎中非整倍体细胞的高发生率,这一点尤其重要。
DNA甲基化:保护基因组稳定性和发育基因表达
DNA甲基化是指在胞嘧啶中添加甲基以形成5-甲基胞嘧啶(5-methylcytosine, 5mC),其主要发生在CpG二核苷酸上。DNA甲基化模式由DNA甲基转移酶DNMT3A和DNMT3B建立,并由DNMT1维持,非催化蛋白DNMT3L作为辅因子,在它们缺失的情况下,5mC通过被动去甲基化或通过TET羟化酶将5mC氧化成5-羟甲基胞嘧啶(5-hydroxymethylcytosine, 5hmC)的主动DNA去甲基化从基因组中去除。检测胚胎发生过程中DNA甲基化的主要方法是用识别5mC的抗体进行免疫细胞化学和分析技术,包括简化基因组甲基化测序(reduced representation bisulfite sequencing,RRBS),全基因组重亚硫酸盐测序(whole-genome bisulfite sequencing,WGBS)和PBAT甲基化测序(post-bisulfite adapter tagging)。
胚胎植入前发育过程中DNA去甲基化和甲基化变化
DNA甲基化的重编程涉及在人类胚胎发育的植入前和植入后期去除和重建DNA甲基化模式(图1)。这些事件对于重置遗传亲本甲基化至关重要,从而构建新的DNA甲基化谱。
整体DNA甲基化去除发生在植入前人类胚胎发育的几个时期。受精后12小时内发生了一次主要的去甲基化,其中基因间区域(如增强子)以及基因体区域主要发生去甲基化。从受精卵后期到2C期,然后从8C到桑椹胚和胚泡期,进一步发生去甲基化。在这些阶段,内含子和SINE元件尤其是年轻Alu亚家族的去甲基化很明显。小鼠中有几个因子与受精卵的快速去甲基化有关,最显著的是TET3,小鼠胚胎分析显示,去甲基化位点在5hmC中大量富集。TET3在人卵母细胞中也高表达;然而,介导去甲基化过程的机制以及不同机制是否在不同时期起作用仍有待在人类胚胎中进行实验验证。
几项研究进一步确定了父源基因组和母源基因组之间去甲基化存在显著差异。与小鼠类似,人类精子的甲基化水平高于卵母细胞,在胚胎植入前的所有时期,父源基因组经历更快的去甲基化,而母源基因组在所有植入前阶段都保持较高的残留甲基化水平。除了不同的亲本效应外,甲基化标记的基因组位点也存在差异,从而在受精卵的两个亲本基因组之间产生差异甲基化区域:父本高甲基化区域在基因间区域相对富集,而母本高甲基化区域在基因内区域富集,包括外显子和内含子。这些母系遗传的甲基化标记中的一些一直持续到胚泡期和胎盘中。除了几个特定序列外,由于亲本基因组之间的大多数DNA甲基化差异似乎不影响植入前阶段的等位基因特异性基因表达,亲本特异性甲基化的功能重要性仍不确定。
发育中的胚胎中的大多数常染色体基因都在两个基因组中表达,但一组印迹基因表现出亲本依赖性表达,其中一个拷贝被关闭。在这些印迹基因中,一个等位基因在配子发生过程中在其相应的初级印迹调控区(ICR)被DNA甲基化标记。为保护ICR免受去甲基化,在人类发育过程中保护ICR的蛋白质开始被发现,并且可能具有物种特异性。其他逃脱DNA去甲基化区域由一个年轻的LINE家族代表,特别是L1PA家族。这表明了一种保护机制,可以防止这些进化上年轻的转座元件激活。
尽管在植入前发育过程中发生了甲基化丢失,但从4C期到8C期也发生了de novo DNA甲基化。新的甲基化区域在重复元件富集,例如SINE,LINEs和长末端重复序列(LTR)。且经历de novo甲基化的区域通常在桑椹胚和囊胚期再次去甲基化,强调了甲基化变化的瞬时性和动态性。
DNA甲基化对植入后胚胎发育的影响
在人类囊胚中,ICM和滋养外胚层具有相似的DNA甲基化谱,表明滋养外胚层的初始诱导在很大程度上独立于DNA甲基化。然而DNA甲基化如何影响人类胚胎的谱系成熟和植入后发育是关键问题。植入后人类胚胎的DNA甲基化组分析表明,相当大的DNA再甲基化发生在E7和E12之间。调节de novo甲基化机制已在小鼠中得到表征,但DNMT3A和DNMT3B的相对功能贡献(两者在植入后在人类胚胎中转录上调)仍有待在人类植入后发育中进行实验验证。人类胚胎的外胚层,滋养外胚层和内胚层在DNA de novo甲基化模式中具有显著的变异性和不同步性。特别是植入后,植入后,与外胚层和滋养外胚层谱系的细胞相比,内胚层的DNA再甲基化速度较慢,并且在同一发育时期,内胚层的中位DNA甲基化水平约为外胚层的一半(33%:60%)。这表明尽管外胚层和内胚层细胞都起源于ICM,但它们具有不同的DNA再甲基化机制。也许这表明在这个特定的发育时期,相对于外胚层谱系,内胚层具有更大的发育可塑性。
三个谱系中的DNA再甲基化也发生在具有谱系特异性表征的特定基因组元件上。在植入后人类发育过程中,超过200个启动子区域DNA甲基化。此外,E8的每个细胞谱系都具有特定的甲基化模式:外胚层相关基因的启动子在滋养外胚层中被甲基化,但在外胚层和内胚层谱系中均未被甲基化。相比之下,滋养外胚层限制基因的启动子在外胚层和内胚层谱系中被甲基化,内胚层相关基因启动子在外胚层和滋养外胚层谱系中被甲基化。这些发现表明DNA甲基化一旦形成,可能有助于维持不同的谱系命运。
通过原肠胚形成和神经形成期培养食蟹猴胚胎的新方法,为研究植入后胚胎的表观遗传变化提供了机会。单细胞多组学分析结果表明,食蟹猴胚胎在每种鉴定的细胞类型中都会经历特定的DNA甲基化模式。胚胎细胞的DNA甲基化水平明显高于胚外细胞。这一发现与先前在小鼠和人类中的报道一致。重要的是,食蟹猴胚胎中的启动子区域、LINEs、LTR区域和SINEs在食蟹猴胚胎中显示出与在每种细胞类型中观察到的总体DNA甲基化相似模式。然而,这些元件中的每一个都表现出不同程度的甲基化,这与小鼠的观察结果一致。
总之,DNA甲基化在早期胚胎发生过程中是一个高度动态的过程,涉及一系列的去甲基化和de novo甲基化。关键的问题包括:植入后人类胚胎发育中DNA甲基化的谱系特异性变化、基因组特征和功能调节因子是什么?植入前和植入后的物种特异性DNA甲基化模式是什么,这些信息可以更全面地了解进化过程中保守的DNA甲基化模式?
人类发育表观遗传学的重要性
确保胚胎发生过程中忠实的表观遗传调控的重要性不仅体现上述实验研究,而且还体现在表观遗传过程破坏的个体发育结果以及在某些人类胚胎模型和类器官中丧失表观遗传保真度中。
在模式生物中,许多表观遗传调节因子编码基因的纯合突变会导致早期发育失败。据推测,人类类似功能丧失突变也会导致早期妊娠丢失。人类其他突变(通常为杂合突变或半合突变)通常与发育一致,但可引起多种先天性疾病,包括Rubinstein-Taybi综合征(乙酰转移酶CBP和p300编码基因突变)、ICF综合征(通常与DNA甲基转移酶DNMT3B编码基因突变相关)和Kabuki综合征(影响组蛋白甲基转移酶KMT2D遗传变异)。
另一个重要特征是表观基因组建立可以使早期人类胚胎特别容易受应激或表观基因组改变过程中的变化影响。这种脆弱性与理解早期环境暴露的后果以及体外培养改变卵母细胞和植入前胚胎表观基因组的潜力相关。鉴于辅助生殖技术的日益普及,目前的工作至关重要,以确定这些技术对发育表观基因组的影响。
最后,必须强调的是,广泛应用的体外细胞模型也可能发生异常表观基因组变化。hPSCs基因组印记和XCI变化影响胚胎模型和这些细胞系源类器官的保真度。进一步的意义是,目前由初始hPSCs生成的大多数人类母细胞模型由于异常印记而存在“内在缺陷”。由于印记基因的忠实调控是哺乳动物发育所必需的,因此这一缺陷可能会限制人类母细胞持续发育的能力。未来的培养方法无疑将支持在初始hPSCs中维持正常印记,但在短期内,这一表观遗传异常对有关母细胞和其他胚胎模型的发育潜力和生存力的科学、伦理和政策讨论具有影响。即使在hPSCs中大多数印记达到了完美的保真度,重要的是要注意,胎盘特异性DNA甲基化印记在包括hPSCs在内的表母细胞来源的细胞系中缺失。胎盘印记及其相关基因的错误调节会破坏hPSCs来源的滋养层细胞的诱导和生长,因此,这种内在的错误调节也可能影响hPSCs来源的胚外细胞类型的干细胞胚胎模型的保真度。

图3:围绕人类胚胎发育的表观遗传调控的开放性问题以及解决这些问题的潜在解决方案
参考文献:
Wilkinson AL, Zorzan I, Rugg-Gunn PJ. Epigenetic regulation of early human embryo development. Cell Stem Cell. 2023 Oct 12. pii: S1934-5909(23)00331-4. doi: 10.1016/j.stem.2023.09.010. PubMed PMID: 37858333.
标签:
DNA甲基化





