文献分享:抑制术后癌症复发与转移的新型纳米药物IPI549@HMP研究
多色文献分享:一种能够抑制术后癌症复发与转移的新型纳米药物
对于大部分癌症来说,手术切除是最重要也是最切实有效的治疗手段,但是为什么有些病人术后依旧需要做化疗,并且癌症复发率很高?事实上,手术只能切除肉眼可见的癌症肿块,然后适当的多切除一些周围的“正常”组织,但这部分组织看似正常,实际可能已经潜藏癌细胞,通俗一点说:外科手术不能把癌细胞百分百清理掉。所以一旦术后的病理结果不乐观,患者依旧需要进行化疗,并同时还需要用一些免疫治疗的药物,恢复免疫细胞对肿瘤细胞的杀伤力。
由于肿瘤组织迅速增长,体积高度膨胀及肿瘤组织内部血管系统不完备,导致肿瘤组织内氧气供应不足,因此肿瘤微环境往往呈现出整体缺氧的特点。肿瘤细胞可以在缺氧环境中顽强生存,但免疫细胞却不行,因此这样的缺氧也会促进肿瘤的免疫逃逸。
2022年5月20日,同济大学医学院岳雯雯研究员、复旦大学附属中山医院徐辉雄教授和上海大学陈雨教授联合带领团队在Nature Communications杂志上发表题为Nanoparticle-enhanced radiotherapy synergizes with PD-L1 blockade to limit post-surgical cancer recurrence and metastasis的文章,该研究通过构建术后CT26小鼠结肠模型,证明了手术切除创造了一个以低氧和髓系细胞大量涌入为特征的免疫抑制环境,促进了癌症的发展,并阻碍了PD-L1阻断治疗。为了解决这一问题,团队设计开发了一种纳米药物IPI549@HMP,它能够靶向髓系细胞,并催化内源性过氧化氢生成O2,增强放射治疗效果以及PD-L1治疗的敏感性,从而抑制或消除残留的部分癌细胞,并唤醒患者自身免疫力抵抗肿瘤复发。
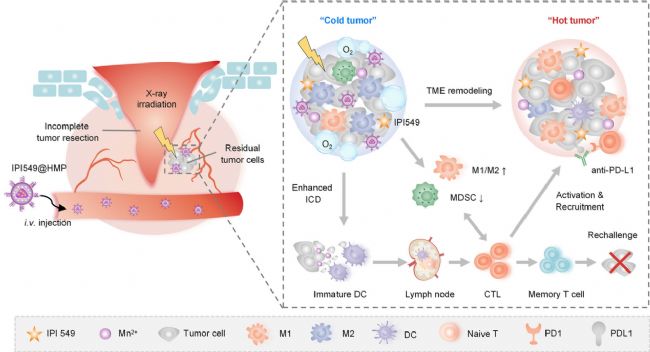
图1 纳米粒子IPI549增强放射治疗与PD-L1阻滞剂协同用于癌症术后免疫治疗示意图
为了更好地观察肿瘤切除手术前后免疫微环境的变化以及纳米药物IPI549@HMP增强肿瘤免疫的疗效,研究团队运用Absin五色多重荧光免疫组化染色试剂盒(鼠兔通用二抗)——abs50013进行多染,结果显示:与未治疗的肿瘤相比,切除手术治疗的肿瘤中CD45+免疫细胞的渗透显著增加,其中大部分是CD11b+髓系细胞,且术后肿瘤的增殖指数(Ki-67)和缺氧指数(HIF-α)也比术前要高得多(图2);进行IPI549@HMP联合放疗以后,肿瘤微环境中抑制荷瘤宿主的抗肿瘤免疫反应的Treg细胞(FOXP3+)和促进免疫逃逸的M2型巨噬细胞(CD206+)较治疗前显著减少,而对肿瘤细胞具有杀伤作用的CD8+T细胞明显增多(图3),证实了IPI549@HMP能够增强术后放疗对荷瘤小鼠的治疗效果。

图2
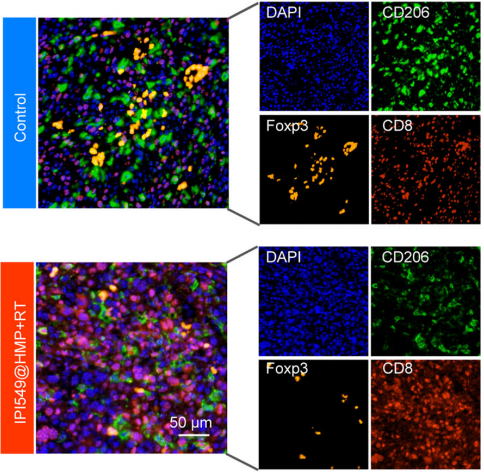
图3
为了攻克目前人类社会主要死亡原因之一的癌症,无数的科学家们殚精竭虑,各类抗癌药及治疗手段的涌现也为多数患者带来了生的希望,多重荧光免疫组化技术作为目前探索肿瘤微环境的主流手段之一,因其能在单张切片呈现更多更丰富的信息而备受广大学者青睐。期待Absin能在各位大神探索肿瘤领域的道路中,继续贡献自己的一份绵薄之力~
参考文献
Guan X, Sun L, Shen Y, Jin F, Bo X, Zhu C, Han X, Li X, Chen Y, Xu H, Yue W. Nanoparticle-enhanced radiotherapy synergizes with PD-L1 blockade to limit post-surgical cancer recurrence and metastasis. Nat Commun. 2022 May 20;13(1):2834. doi: 10.1038/s41467-022-30543-w. PMID: 35595770; PMCID: PMC9123179.





