机械超负荷下调核糖体蛋白通过信号促进软骨细胞衰老和骨关节炎进展
RPL35 downregulated by mechanical overloading promotes chondrocyte senescence and osteoarthritis development via Hedgehog-Gli1 signaling
Keywords: Chondrocyte; Hedgehog pathway; Osteoarthritis; Ribosomal protein L35; Senescence.
骨关节炎(OA)的特征是关节软骨退行性改变和受累关节软骨基质丢失,导致慢性疼痛、运动受限,最终降低生活质量。关节软骨主要由软骨细胞和细胞外基质(ECM)组成,其退变降解的过程主要由一系列软骨基质降解酶所介导。细胞衰老是与ECM降解和软骨细胞功能障碍密切相关的另一个因素。在病理状态下,软骨细胞可能会去分化,失去其功能表型,并趋向衰老。在培养过程中,软骨细胞衰老和去分化伴随着软骨细胞特异性蛋白(如II型胶原和糖蛋白)表达的降低。
软骨细胞维持软骨组织形态,对机械刺激是非常敏感的。生理范围内的机械负荷对于维持软骨细胞稳态是必要的。然而,由肥胖、关节不稳定、劳损或创伤引起的异常负荷可导致软骨退变,并且是与骨关节炎发展相关的重要危险因素。
核糖体蛋白在机体的生长发育以及细胞稳态的调节中起着关键作用。既往研究表明,lncNB1通过结合核糖体蛋白L35(RPL35)诱导神经母细胞瘤细胞的增殖和存活,而高水平的RPL35与肿瘤预后相关。RPL35作为核糖体60s的小亚基在蛋白质合成中起着至关重要的作用,如RPL35通过RPL35/ERK/HIF1α轴上调HIF1α促进有氧糖酵解。
基于此,广东省骨与关节退行性疾病重点实验室的科研团队在最近的一项研究中详细阐述了机械应力与细胞衰老之间的关系,并确定了 RPL35 蛋白表达的降低在过度机械应力促进的软骨细胞衰老中起着关键介质的作用。该研究表明,外源性添加 RPL35 可以减轻应力负荷诱导的Hedgehog(Hh)通路的激活。这表明关节内注射 RPL35 可作为 OA 治疗方法的潜力。研究成果发表在 Journal of Orthopaedic Translation 期刊题为“RPL35 downregulated by mechanical overloading promotes chondrocyte senescence and osteoarthritis development via Hedgehog-Gli1 signaling”。

过度机械负荷被认为是研究骨关节炎生理特征的良好模型,为了鉴定机械负荷后对软骨细胞的重要基因,施加 5%、10% 或20% 的0.5 Hz循环拉伸应力24小时,并进行 RNA 测序分析。差异表达分析揭示了459个差异表达的基因。与正常软骨细胞相比,过度机械负荷(20%)处理的软骨细胞中RPL35 基因表达表现出下调。进一步验证RPL35与过度机械负荷处理的软骨细胞之间的关联,发现过度机械应力不仅促进了分解代谢效应,而且刺激了软骨细胞衰老。
已知促炎细胞因子,如IL-1β和TNF-β,在OA的发病机制中起作用。因此,使用重组 IL-1β 刺激的原代小鼠软骨细胞建立了 OA 模型,WB结果显示,与正常软骨细胞相比,IL-1β刺激的软骨细胞中RPL35降低。这些数据表明,过度机械负荷诱导体外衰老软骨细胞中RPL35下调。
为了评估体外研究结果是否可以在体内应用,构建机械性超负荷引起的OA,将右膝关节给予60次 4、9和13.5 N的轴向压缩负荷,在人 OA 中检测了 RPL35 蛋白水平。IHC染色结果显示,与轻度损伤的外侧胫骨平台软骨样本相比,接受全膝关节置换术的OA患者胫骨平台内侧RPL35蛋白水平降低(图1 A、B)。当使用膝关节承受0.5 N的静态轴向压缩负荷10 分钟的OA小鼠模型时观察到相同的结果,即与正常软骨相比,RPL35 蛋白水平在 OA 小鼠中呈现进行性下调,并伴有软骨损伤增加(图1 C-E)。进一步分析机械负荷对关节软骨衰老的影响,在 13.5 N 的机械压缩作用2-4周后,发现小鼠关节软骨细胞中MMP13-、P16- 和P21- 阳性软骨细胞的数量增加,Col2- 阳性软骨细胞的数量显著减少。这表明,机械超负荷加速了关节软骨中的软骨细胞衰老。
番红O 染色显示,在 13.5 N 的峰值压缩负荷下持续多次刺激 2 或 4 周可诱导小鼠膝关节蛋白多糖的丢失。然而,在 4 N 和 9 N 的刺激下,软骨细胞没有显著变化(图1 F、G)。IHC 软骨染色同样证实,在施加 13.5 N 的过大机械压缩后,软骨细胞 RPL35 蛋白水平显著下降(图1 F-K)。这些发现揭示了 RPL35 蛋白水平随着 OA 的进展而降低,表明 OA 严重程度与 RPL35 表达之间存在关联。
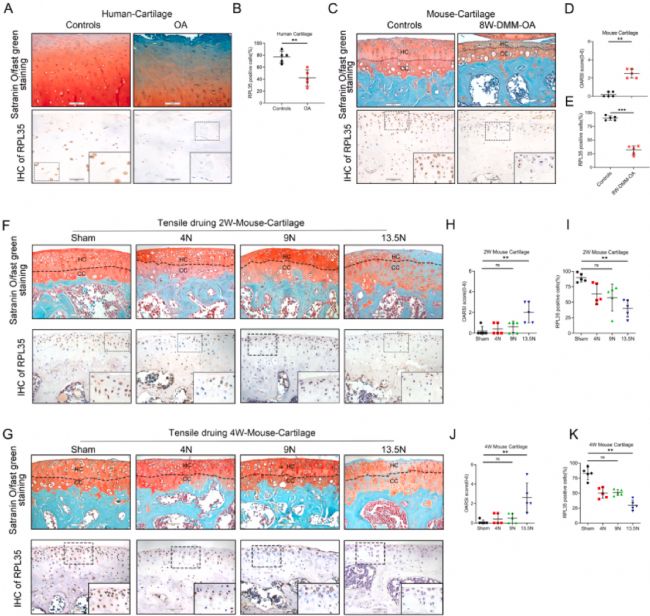
图1 软骨细胞RPL35水平因机械超负荷而降低,OA关节软骨的RPL35水平下降。
接下来,通过敲低 RPL35以探索其在 OA 进展中的作用,评估了RPL35的缺失是否驱动原代小鼠软骨细胞的退变。结果显示,RPL35敲低降低了Col2水平,增加了MMP13、P16和P21的水平。此外,还通过关节注射研究了 RPL35 在体内的作用,观察到体内敲低 RPL35 后软骨细胞中 RPL35 的表达显著降低,且这种降低伴随着软骨的退行性变化。在关节软骨承受过大机械应力的小鼠中也观察到了类似现象,但并未观察到其敲低加剧了骨关节炎的进展。
然后,通过过表达RPL35以探索其对软骨细胞稳态的影响,构建RPL35过表达(Ad-RPL35)和阴性对照(Ad-NC)载体。在关节内注射 Ad-RPL35 的机械负荷小鼠中,与接受机械负荷和 Ad-NC 处理的小鼠相比,OA 的严重程度显著降低,且未观察到软骨损伤。有趣的是,IHC结果显示,RPL35表达的变化与上述分析的关节软骨损伤程度的变化趋势一致(图2 A)。此外,与对照组相比,机械负荷处理4-6周的小鼠中,MMP13-、P16-和P21- 阳性软骨细胞的数量增加,而Col2- 阳性软骨细胞的数量显著减少。RPL35 的添加缓解了退行性病变(图2 B)。此外,过度的机械负荷刺激促进了这些衰老因子的表达,而 RPL35 的添加在体外逆转了这些效应(图2 C、D),表明其对软骨细胞衰老的保护作用。
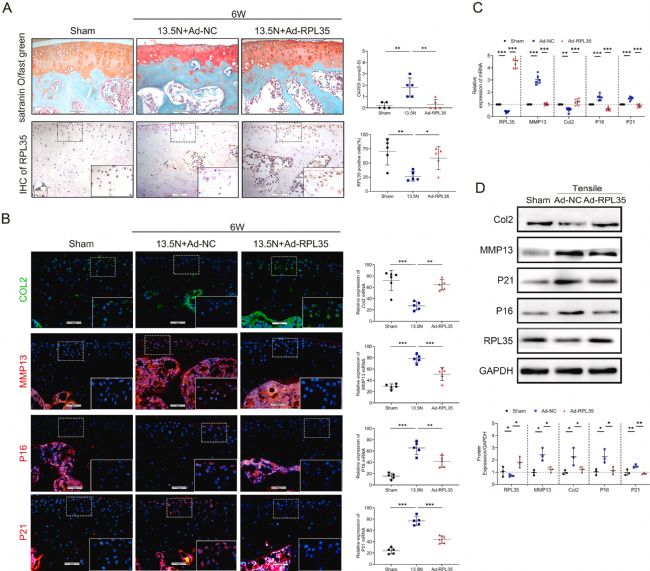
图2 RPL35在软骨细胞中的过表达可防止机械诱导的软骨细胞衰老和OA发展。
最后,研究人员试图确定哪种信号通路负责RPL35 敲低后诱导软骨细胞衰老。因此,鉴定了 4989 个转录本,发现上调的转录本大部分在 Hedgehog(Hh)通路中富集。qPCR结果显示,敲低RPL35或过度机械负荷导致软骨细胞GLI-1和SMO表达增加,它们是 Hh 通路激活的标志物。IHC 和 IF 均表明,在过度机械负荷下软骨中 SMO、Gli-1 和 PTCH1 Hh 信号增加,而添加 RPL35 恢复了 SMO、Gli-1 和 PTCH1 的表达。这些结果说明了RPL35对Hh通路的抑制作用。
此外,还确定了 Hh 的激活是否有助于 RPL35 缺失诱导的软骨细胞衰老,发现在原代小鼠软骨细胞中,Hh 通路抑制剂环巴胺(Cyclopamine)部分降低了 RPL35 缺失诱导的 P21、P16 和 MMP13 的蛋白表达水平。上述结果表明,Hh通路激活升高至少在一定程度上导致了RPL35缺失引起的关节软骨退化。
通路分析显示,与正常软骨细胞相比,用RPL35 siRNA处理的原代软骨细胞中,有17个上调的转录本介导Hh信号通路,其中酪蛋白激酶1ε(CK1ε)是突出的(图3 A、B)。qPCR和WB分析显示,软骨细胞中RPL35的敲低提高了内源性CK1ε水平(图3 C)。此外,在过度机械负荷处理的软骨细胞中也观察到 CK1ε 水平升高,而添加 RPL35 恢复了 CK1ε 的表达 (图3 D)。IF染色分析也观察到相同的趋势(图3 E)。
因此,探讨了CK1ε在OA发展中的作用。与正常软骨细胞相比,CK1ε 过表达的软骨细胞 MMP13 水平升高、Col2 水平降低以及衰老相关标志物 P16 和 P21 水平升高,而敲低CK1ε 则具有保护作用(图3 F)。此外,还探索了siRPL35是否通过靶向CK1ε/SMO信号来调控OA过程,WB结果表明,RPL35敲低的影响被CK1ε敲低显著减弱(图3 G)。此外,RPL35 敲低后 CK1ε 水平升高,并与 SMO 共定位增加(图3 H),进一步提示了CK1ε激活SMO的可能性。总之,这些数据表明,抑制RPL35 可导致 OA,可能是通过提高 CK1ε 蛋白水平,从而与 SMO接触激活,最终激活 Hh 通路。
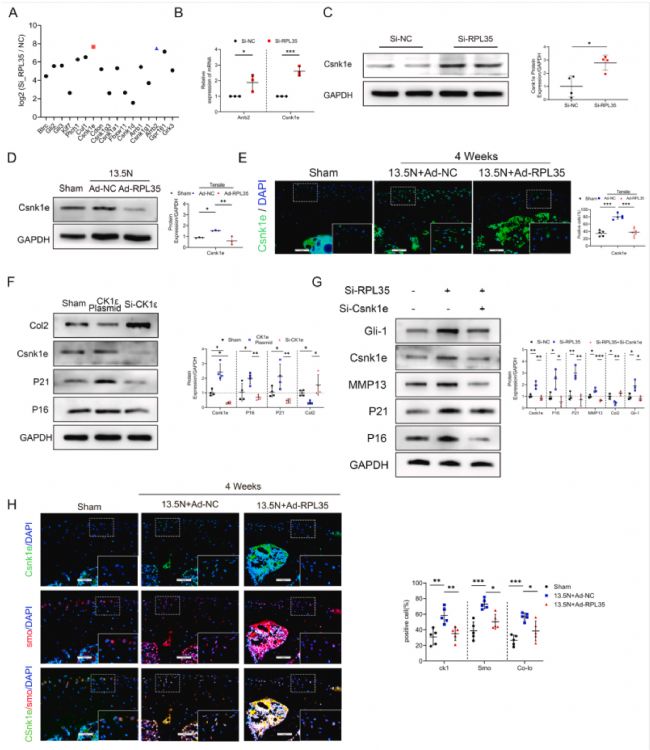
图3 RPL35 通过 Csnk1e(CK1ε)调节 Hh 信号转导活性。
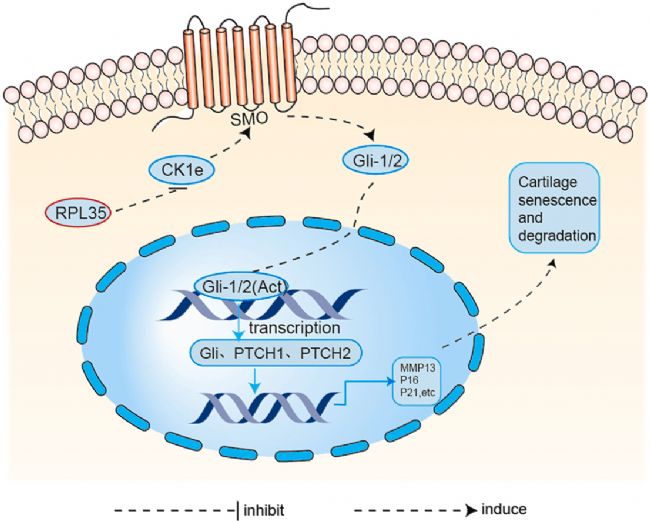
图4 图形概要
综上所述,该研究明确了RPL35和CK1ε在OA中的作用和联系,实验结果验证了CK1ε在关节软骨中的过表达激活了Hh通路,表明RPL35的缺失和CK1ε-Hh信号通路的激活在生物力学诱导的软骨细胞衰老和退变中起着关键作用。因此,靶向关节内补充 RPL35 是减缓 OA 发展的一种方式。
参考文献:Zhu J, Liu L, Lin R, Guo X, Yin J, Xie H, Lu Y, Zhang Z, Zhang H, Yao Z, Zhang H, Wang X, Zeng C, Cai D. RPL35 downregulated by mechanical overloading promotes chondrocyte senescence and osteoarthritis development via Hedgehog-Gli1 signaling. J Orthop Translat. 2024 Apr 1;45:226-235. doi: 10.1016/j.jot.2024.01.003. PMID: 38596341; PMCID: PMC11001632.
Impact Factor 5.9
Print ISSN: 2214-031X
Online ISSN: 2214-0328
原文链接:https://pubmed.ncbi.nlm.nih.gov/38596341/
图片来源:所有图片均来源于参考文献
小编旨在分享、学习、交流生物科学等领域的研究进展。如有侵权或引文不当请联系小编修正。如有任何的想法以及建议,欢迎联系小编。感谢各位的浏览以及关注!关注“Naturethink”公众号,了解更多相关内容。
点击了解:体外细胞机械加力实验仪





