EPAS1 通过内皮脂肪酸摄取减轻血流紊乱区域动脉粥样硬化的发生
EPAS1 Attenuates Atherosclerosis Initiation at Disturbed Flow Sites Through Endothelial Fatty Acid Uptake
Keywords: atherosclerosis; diet, high-fat; endothelial cells; obesity; plaque, atherosclerotic.
动脉粥样硬化斑块发展不稳定,在暴露于血流紊乱的动脉区域堆积。这些血流动力学条件产生低幅度和振荡方向的机械壁剪切应力,诱导局部内皮细胞(ECs)功能障碍,从而驱动斑块形成。全球流行的肥胖与代谢异常有关,包括血脂异常和高血糖,这些都是动脉粥样硬化的驱动因素。血流紊乱会增加 EC 对血脂异常和高血糖的敏感性,然而,这种联系背后的分子机制仍然知之甚少。
内皮稳态的维持依赖于调节代谢平衡的转录因子之间错综复杂的相互作用。值得注意的是,缺氧诱导因子(HIF)转录因子 HIF1A 和 HIF2A(EPAS1)在该调控网络中起着核心作用。EPAS1 在血管生物学中的功能研究较少。已知 EPAS1 通过稳定新生微血管网络和驱动动脉生成来促进血管形成。EPAS1 还调节其他几种生理过程,包括胚胎发生、红细胞生成、肿瘤发生和肝脏代谢。然而,EPAS1 在动脉稳态、 EC 机械反应和动脉粥样硬化中的潜在作用仍不清楚。
最近,英国谢菲尔德大学转化神经科学研究所、伦敦帝国理工学院国家心肺研究所及瑞士苏黎世大学医院临床化学研究所等联合团队研究了 EPAS1 在动脉粥样硬化发展中的作用,特别是在血流紊乱的区域。研究证明 EPAS1 在这些区域富集,通过促进脂肪酸代谢以增强内皮稳态来限制动脉粥样硬化,并将 EPAS1 确立为肥胖与内皮对剪切应力反应之间的关键中间环节,揭示了肥胖、血流紊乱和动脉粥样硬化联系的复杂分子机制。研究成果发表在 Circulation Research 期刊题为“EPAS1 Attenuates Atherosclerosis Initiation at Disturbed Flow Sites Through Endothelial Fatty Acid Uptake”。

首先,为了分析 EPAS1 是否对血流有响应,使用体外平行板系统将猪主动脉血管内皮细胞(PAEC)暴露于不同剪切应力条件培养72 h:高剪切应力(HSS,13 dynes/cm2)、低剪切应力(LSS,4 dynes/cm2)或低振荡剪切应力(LOSS,4 dynes/cm2,1 Hz,双向)。免疫印迹显示,与LSS或单向HSS 相比,暴露于 LOSS的 EPAS1 表达增加(图1 A)。然后,测量了小鼠主动脉弓 EC 中的 EPAS1 水平,与外曲率相比,内曲率暴露于相对较低的时间-平均 WSS 幅度和更多的振荡区(即 LOSS)(图1 B)。与体外研究结果一致,小鼠主动脉免疫荧光染色显示,与 HSS 区域相比,EPAS1 在 LOSS 区域(内曲率)显著富集(图1 C)。LOSS 位点的 EPAS1 一部分定位于细胞核,表明它是活跃的(图1 C)。因此,EPAS1 在体外被 LOSS 增强,并在暴露于 LOSS 的小鼠主动脉的动脉粥样硬化区域富集。
为了评估肥胖对主动脉内皮 EPAS1 水平的影响,将 WT 小鼠暴露于高脂或正常饮食条件 22 周。主动脉弓的表面染色显示,与正常喂养的对照小鼠相比,暴露于 HFD 的小鼠 LOSS 区域的 EPAS1 水平显著降低。因此,与肥胖相关的 HFD 喂养会降低 LOSS 动脉粥样硬化易感区域的 EPAS1 表达。
随后,研究人员试图确定肥胖下 EPAS1 降低的机制,并重点关注了肥胖中代谢变化对 EPAS1 表达的影响。通过给小鼠注射链脲佐菌素链(STZ)诱导糖尿病疾病模型,表面染色显示,在STZ处理的小鼠中,主动脉 LOSS 区域的 EPAS1 表达没有改变,表明高血糖不足以抑制 EPAS1。
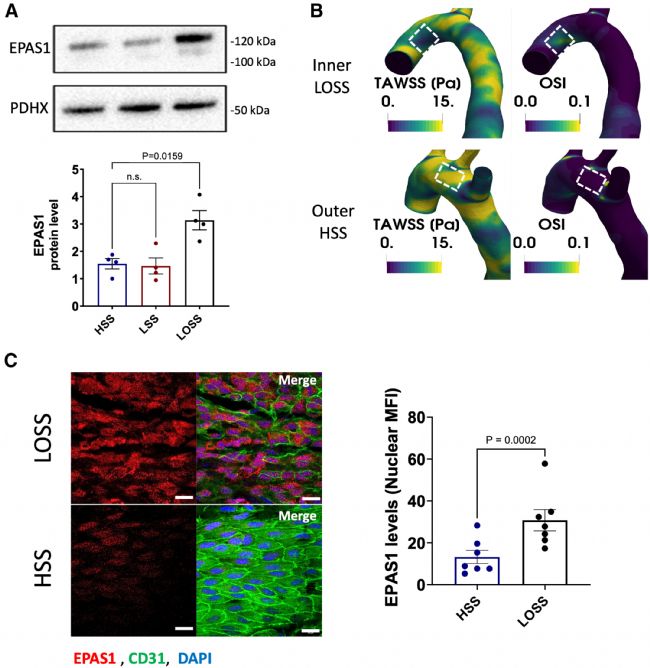 图1 EPAS1在暴露于低剪应力和振荡剪应力下的动脉粥样硬化易感性部位富集。
图1 EPAS1在暴露于低剪应力和振荡剪应力下的动脉粥样硬化易感性部位富集。
接下来,通过用萝卜硫素(Sulforaphane)处理肥胖小鼠来分析高脂血症在 EPAS1 抑制中的潜在作用。萝卜硫素已知可以改变脂质谱和保护内皮。结果表明,萝卜硫素显著降低了暴露于 HFD 肥胖小鼠血浆中甘油三酯(TGs)水平(图2 A),而血糖(图2 B)、体重和血浆总胆固醇水平、HDL(高密度脂蛋白)和 LDL/VLDL(低密度脂蛋白/极低密度脂蛋白)水平没有显著改变。萝卜硫素处理还恢复了 EPAS1 在 LOSS 区域的表达,并适度提高来其在 HSS 区域的表达(图2 C)。
在 SFN 处理的肥胖小鼠中,EPAS1 的恢复可能与血浆 TG 降低相关,因此,假设 TGs 可能参与肥胖中 EPAS1 的抑制,将在 LOSS 下培养的 PAEC 暴露于游离脂肪酸(FFAs)来进行验证。免疫印迹显示,暴露于油酸(OA)或棕榈酸(PA)后 EPAS1 水平显著降低。为了研究潜在机制,对靶向 EPAS1 的 PHD2 和 PHD3 蛋白进行降解。PA 或 OA 显著增加 PHD2 水平,表明 FFAs 可能通过诱导 PHD2 降低 EPAS1。通过主动脉表面染色得到进一步验证,与非肥胖小鼠相比,喂食 HFD 的肥胖小鼠在 LOSS 区域的 PHD2 表达增强。
萝卜硫素可以通过激活核因子 NRF2 和抑制活性氧对 EC 产生直接影响。因此,在存在或不存在萝卜硫素或抗氧化剂 NAC 的情况下用PA或 OA 处理 PAEC 来研究该通路在 EPAS1 挽救中的潜在参与。萝卜硫素和 NAC 增加了与 PA 或 OA 共处理的 PAEC 中的平均 EPAS1 水平,尽管没有达到统计学意义,但不能排除 SFN 通过减少活性氧来挽救 FFA 介导的 EPAS1 抑制的可能性。此外,该机制可能涉及抑制 PHD2,其被 SFN 和 NAC 降低。因此,萝卜硫素处理的肥胖小鼠中 EPAS1 的恢复可能涉及 SFN 对内皮的直接作用。这些观察结果表明,EPAS1 在肥胖中的降低可能是由于高甘油三酯血症-FFA 代谢与细胞氧化应激的局部改变相结合,导致内皮 PHD2 的诱导。
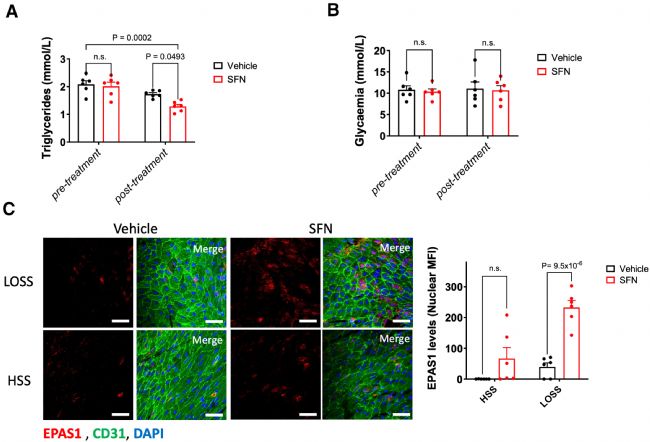 图2 萝卜硫素可挽救肥胖小鼠的 EPAS1水平。
图2 萝卜硫素可挽救肥胖小鼠的 EPAS1水平。
进一步地,还评估了是否可以在血清和外周微血管系统中观察到肥胖中的 EPAS1 抑制,发现小鼠肥胖导致微血管内皮细胞中 EPAS1 降低,同时循环血清 EPAS1 也减少。
通过比较肥胖和非肥胖个体的 PHD-EPAS1 通路来评估研究结果的临床相关性。ELISA 结果显示,EPAS1 在所有非肥胖对照的血清样本中均可检测到,但在肥胖个体中缺失或显著减少。然后,研究了临床肥胖患者血清 EPAS1 降低是否与循环脂质和 ROS 改变有关。与非肥胖个体相比,肥胖者的 FFAs 水平略有增加,但却没有达到统计学意义。肥胖组和非肥胖组之间血清的总抗氧化能力相似。肥胖患者和非肥胖对照组皮下脂肪中分离的微血管 EC 中 EPAS1、PHD2 和 PHD3 转录物的定量实时 PCR 显示,与对照组相比,肥胖个体的 PHD2 和 PHD3 水平显著增加,而 EPAS1 mRNA 表达没有改变。这些数据表明,EPAS1 在与血脂异常以及 EC 中 PHD2 和 PHD3 表达升高相关的肥胖个体中受到抑制,这一观察结果与在肥胖小鼠模型中的观察结果一致。
为了分析 Epas1 在动脉粥样硬化中的作用,建立 Epas1EC-KO 和 Epas1EC-WT对照小鼠,暴露于 HFD 以产生高胆固醇血症(图3 A)。内皮Epas1 缺失对血浆胆固醇水平没有影响(图3 B),然而,小鼠主动脉中的动脉粥样硬化斑块明显更大(图3 C)。在主动脉根部也测量了斑块的形成,证实了与对照组相比,Epas1EC-KO 小鼠存在更大的斑块(图3 D)。这些数据表明,内皮 EPAS1 可防止动脉粥样硬化。
为了了解内皮 EPAS1 的功能,对Epas1EC-KO和对照小鼠的主动脉中进行了单细胞RNAseq,鉴定了 6 个不同的细胞簇,发现Epas1 影响 EC 异质性。功能注释显示,Epas1 调控的簇富集了多种不同的基因本体术语,包括细胞内信号通路、转录/RNA 加工、细胞增殖和代谢。对Epas1EC-KO和Epas1EC-WT小鼠细胞进行进一步的功能注释,发现了多个富集的基因本体术语,包括与肌动蛋白、高尔基体和膜、翻译、转运、氧化磷酸化、线粒体和发育、MAP 激酶信号传导和糖蛋白。这些数据可有理由假设 EPAS1 可能在动脉内皮细胞其他功能中参与代谢调节。
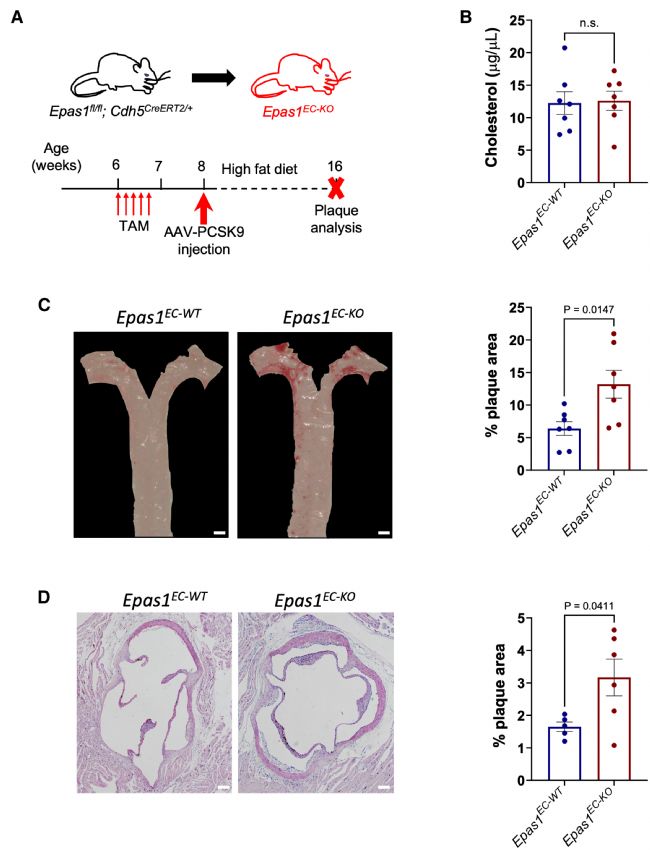 图3 内皮 Epas1 可防止动脉粥样硬化。
图3 内皮 Epas1 可防止动脉粥样硬化。
最后,在 LOSS 条件下培养的 PAEC 中敲低EPAS1,研究其调节脂肪酸代谢的潜在作用。据观察,EPAS1 沉默导致暴露于 LOSS 的 EC 的基础耗氧率降低约80%(图4 A),并且这种耗氧率强烈依赖于脂肪酸β氧化。这些数据表明,EPAS1 是脂肪酸β-氧化-依赖性呼吸的正调节因子。进一步研究 EPAS1 在呼吸中的作用,发现EPAS1 通过控制脂肪酸β氧化来调节呼吸,并且对线粒体活性本身的影响相对较小。
值得注意的是,EPAS1 沉默细胞中耗氧量的减少可以通过补充外源性 OA 来挽救(图4 A)。这表明 EPAS1 可能通过控制 EC 产生或处理 FFAs的能力来调节脂肪酸 β-氧化途径的启动。实时 PCR 分析显示,EPAS1 沉默显著在mRNA 水平上降低内皮脂肪酶(LIPG)和分化抗原簇36(CD36)的表达(图4 B、C)。
为了确认 Epas1 对 CD36 和 LIPG 的影响,对小鼠主动脉进行了表面染色。WT 小鼠显示,与 HSS 区域相比,CD36 和 LIPG 在 LOSS 区域显著富集(图4 D、E)。与对照组相比,Epas1EC-KO中LOSS区域CD36和LIPG的表达显著降低(图4 D、E),表明Epas1是LOSS区域这两种分子富集的必要条件。为了评估 LOSS 区域 CD36 和 LIPG 的局部富集是否与脂质代谢升高相关,通过口服橄榄油将小鼠暴露于急性高脂血症,发现血浆TG水平在90 分钟后显著增加。值得注意的是,与 HSS 区域相比,主动脉弓 LOSS 区域的脂滴积累增强,表明局部脂质摄取增强。这些数据表明,EPAS1 通过正向调节协调 FFA 处理的 CD36 和 LIPG 的表达,是动脉粥样硬化 LOSS 区域内皮脂肪酸β-氧化是必需的。
由于 HIF1A 调节 LOSS 区域的糖酵解,因此,评估了 EPAS1 对该通路的潜在贡献。EPAS1 的沉默使糖酵解和糖酵解能力降低。HK2 或 PFKFB3 是受 HIF1A 调节的关键糖酵解调节剂,免疫印迹显示,EPAS1 的沉默不会影响其表达。因此,EPAS1 通过一种不同于 HIF1A 的机制对糖酵解具有相对适度的影响。
内皮脂肪酸-β氧化与DNA 修复和细胞增殖密切相关,因此,实验假设 EPAS1 可能是通过脂肪酸代谢来支持内皮增殖。与对照组相比,Epas1EC-KO小鼠的EC增殖明显减少,这表明内皮细胞Epas1是EC增殖所必需的。同样,对暴露于 LOSS 的 PAEC 的分析表明,EPAS1 沉默后增殖显著减少。
为了调和 EPAS1 对脂肪酸β-氧化和增殖的影响,通过用外源性 OA 处理 EPAS1 沉默的 PAEC 来挽救脂肪酸代谢。恢复代谢显著增加了 EPAS1 沉默的 PAEC 中 EC 增殖的频率,表明 EPAS1 通过增强脂肪酸代谢来驱动增殖。这些数据显示,EPAS1 通过保持 EC 代谢稳态和增殖能力,在血流受到干扰的区域发挥动脉粥样硬化保护作用。
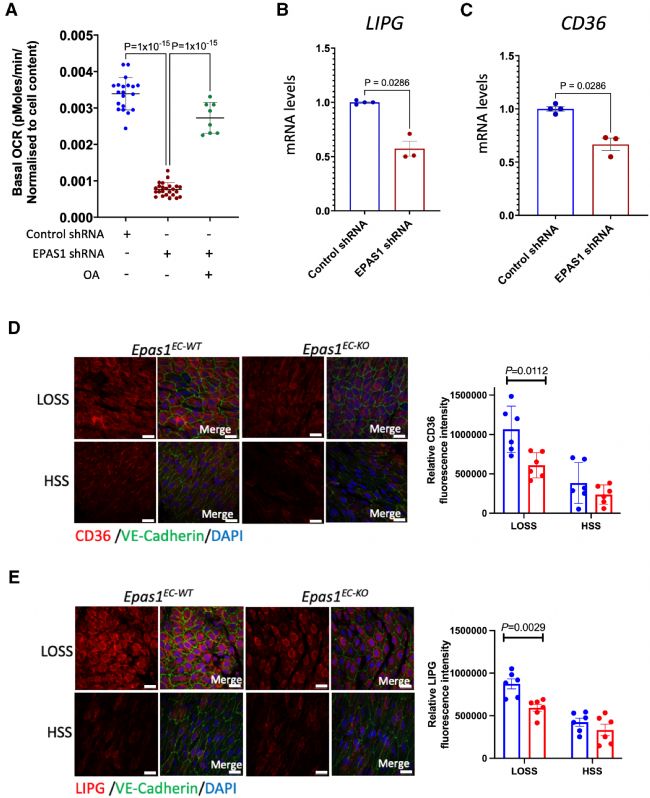 图4 内皮 EPAS1 通过 LIPG 和 CD36 表达控制脂肪酸代谢。
图4 内皮 EPAS1 通过 LIPG 和 CD36 表达控制脂肪酸代谢。
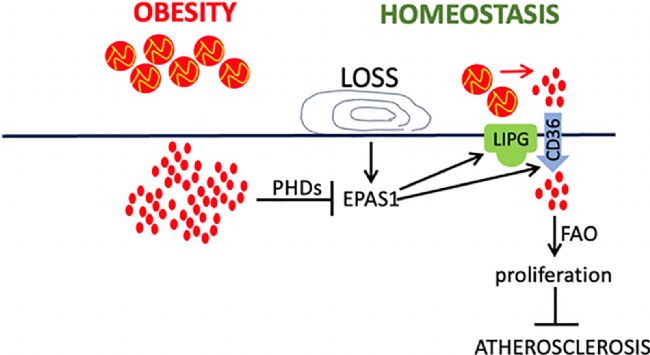 图5 图形概要
图5 图形概要
内皮细胞 EPAS1 通过脂肪酸摄取和代谢维持 EC 增殖,从而减轻血流紊乱区域的动脉粥样硬化。这种内皮修复途径在肥胖中受到抑制,表明一种新的甘油三酯-PHD2 调节途径抑制了 EPAS1 表达。
总之,该研究结果强调了 EPAS1 在动脉粥样硬化易感区域的优先表达,它通过促进脂肪酸代谢以支持内皮修复来减缓动脉粥样硬化。这种保护性途径受到肥胖的影响,揭示了一种将系统心血管风险与 EC 功能障碍联系起来的新型分子联系。这些发现对有心血管风险的肥胖个体的临床管理具有潜在意义。
参考文献:Pirri D, Tian S, Tardajos-Ayllon B, Irving SE, Donati F, Allen SP, Mammoto T, Vilahur G, Kabir L, Bennett J, Rasool Y, Pericleous C, Mazzei G, McAllan L, Scott WR, Koestler T, Zingg U, Birdsey GM, Miller CL, Schenkel T, Chambers EV, Dunning MJ, Serbanovic-Canic J, Botrè F, Mammoto A, Xu S, Osto E, Han W, Fragiadaki M, Evans PC. EPAS1 Attenuates Atherosclerosis Initiation at Disturbed Flow Sites Through Endothelial Fatty Acid Uptake. Circ Res. 2024 Sep 27;135(8):822-837. doi: 10.1161/CIRCRESAHA.123.324054. Epub 2024 Sep 5. PMID: 39234692; PMCID: PMC11424061.
原文链接:https://pubmed.ncbi.nlm.nih.gov/39234692/
IF:16.5
0009-7330 (Print-ISSN)
1524-4571(Online-ISSN)
图片来源: 所有图片均来源于参考文献
小编旨在分享、学习、交流生物科学等领域的研究进展。如有侵权或引文不当请联系小编修正。如有任何的想法以及建议,欢迎联系小编。感谢各位的浏览以及关注!进入官网www.naturethink.com或关注“Naturethink”公众号,了解更多相关内容。
点击了解:流体剪切力系统





