新生内膜肌成纤维细胞参与维持巨细胞动脉炎中Th1/Tc1和Th17/Tc17炎症
Neointimal myofibroblasts contribute to maintaining Th1/Tc1 and Th17/Tc17 inflammation in giant cell arteritis
Keywords: Giant cell arteritis; Interferon-gamma; Myofibroblasts; Vascular smooth muscle cells; Vasculitis.
巨细胞动脉炎(GCA)是一种肉芽肿性血管炎,由血管重塑导致血管狭窄或闭塞引起。这一过程是由表型转化触发的,血管平滑肌细胞(VSMCs)转化为肌成纤维细胞(MFs),肌成纤维细胞迁移到内膜,增殖并产生细胞外基质蛋白,如胶原蛋白-1、胶原蛋白-3 和纤连蛋白,导致内膜增生的形成并导致血管狭窄和闭塞。
VSMC 和 MF 标志物包括收缩蛋白α-SMA、肌球蛋白重链-11(MYH11)和结蛋白(Desmin)。MYH11是分化VSMCs最具特异性标志物;结蛋白由VSMCs表达,但不由成纤维细胞表达。CD90(Thy-1)是一种糖基磷脂酰肌醇锚定的细胞表面蛋白,参与黏着斑、细胞迁移、细胞间和细胞基质相互作用以及 T 细胞活化,它由成纤维细胞和MF表达,但不由VSMC表达。因此,VSMCs具有α-SMA+CD90−desmin+MYH11+ 表型、Mfs 具有α-SMA+CD90+desmin+MYH11+ 表型,成纤维细胞具有α-SMA+/−CD90+desmin−MYH11- 表型。
在GCA中,血管重塑与血管炎症密切相关。这种重塑主要发生在单核细胞产生内皮素-1(ET-1)和血小板衍生生长因子(PDGF)后,从而促进VSMCs分化为MFs及其迁移和/或增殖。其他分子也参与其中,包括MMP9和VEGF,前者有助于动脉壁的破坏,后者有助于血管生成,进一步放大血管炎症和重塑。除了在血管重塑过程中的直接作用外,VSMCs还被证明在干扰素-γ(IFN-γ)的刺激下产生趋化因子(CCL2、CXCL9、CXCL10、CXCL11),从而促进T细胞和单核细胞的募集。然而,虽然VSMC和MF在T细胞极化中的作用尚不清楚,但越来越多的证据表明,驻留细胞不仅是炎症反应的靶点,也是损伤组织持续炎症反应的主要原因之一。
基于此,法国勃艮第弗朗什孔德大学医院血管内科、风湿病科、眼科、病理科的工作人员联合西班牙巴塞罗那大学IDIBAPS生物实验室在一项研究中,假设 MFs,特别是在血管炎症的背景下被激活时,可能在 GCA 的 T 细胞极化中发挥作用。该研究为VSMCs和MFs参与GCA的发病机制提供了新的证据。具体研究成果发表在 Journal of Autoimmunity 期刊题为“Neointimal myofibroblasts contribute to maintaining Th1/Tc1 and Th17/Tc17 inflammation in giant cell arteritis”。

首先,来自 GCA 和健康颞动脉的颞动脉活检(TAB)的分析显示,VSMCs 存在于中膜,成纤维细胞在外膜。GCA动脉的特征在于外膜成纤维细胞数量增加,中膜受损,特别是存在由MFs组成的新内膜增生。与GCA患者的阳性TAB相比,健康TAB的免疫染色显示内膜正常或轻度的内膜增生。这些结果表明,在GCA患者的阳性TAB中观察到的异常是该病理特有的。
与未观察到白细胞(CD45+)的健康动脉不同(图1 A),GCA动脉壁的三层被CD45+细胞大量浸润(图1 B)。在GCA动脉的新生内膜中,MFs(α-SMA+)和单核细胞(CD45+)密切接触,表明这些细胞之间存在直接相互作用(图1 C)。
在GCA动脉中,HLA-DR抗原主要由CD45+ 细胞表达(图1 D、E),但在新生内膜的一些MFs中也有较小程度的表达(图1 F)。STAT3 主要在 CD45+ 白细胞中被磷酸化,但在新生内膜的 MFs 中也有较小程度被磷酸化(图1 G-I)。相比之下,在GCA动脉壁中观察到STAT1的强烈磷酸化,主要是CD45+ 细胞,但也包括中膜中的VSMCs和新生内膜中的MFs(图1 J-L),表明这些细胞中IFN-γ通路的强烈激活。值得注意的是,在健康动脉中未观察到 HLA-DR、pSTAT1 和 pSTAT3 的显著表达。总之,数据表明了IFN-γ/STAT1通路在GCA病理生理中的重要性,并且也影响VSMCs和MFs。
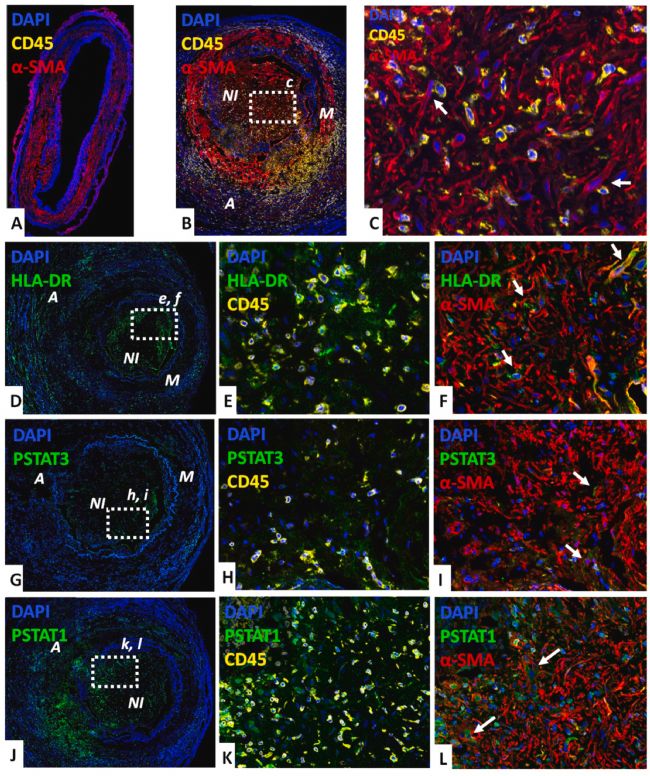
图1 通过共聚焦显微镜对 GCA 和健康动脉中的 CD45、HLA-DR、pSTAT1 和 pSTAT3 进行免疫荧光分析。
接下来,通过培养健康颞动脉获得与MF表型一致的血管细胞。在基础状态下,STAT1 未被磷酸化。当用 IFN-γ 和 TNF-α 培养时,MF 表达位于其细胞核中的磷酸化形式的 STAT1,这表明 IFN-γ 通路的激活,其表型类似于在 GCA 动脉新生内膜中观察到的表型。研究人员为了在体外重现外周血单个核细胞(PBMCs)与单核细胞的接触,进行了MF与异体PBMC的共培养,使用相同的 IFN-γ 和 TNF-α 刺激MFs 以诱导 STAT1 磷酸化,从而获得接近 GCA 动脉新生内膜中观察到的MFs 的激活状态。
由于 STAT3 磷酸化可能已被先前的 GC 处理和其他转录因子降低,因此还在随后的实验中探索了 Th17 和 Tc17 细胞。MFs对T细胞极化的影响如图2。在没有MFs的情况下,辅助性T细胞Th1和Th17百分比非常低,可能是因为没有添加PMA和离子霉素。相比之下,MFs的存在导致Th1、Th17以及细胞毒性T细胞Tc1和 Tc17 百分比的急剧上升。这种以牺牲Th2和Tc2细胞为代价的向Th1/Tc1和Th17/Tc17表型的倾斜导致了Th1/Th2比率的强烈偏差,有利于MFs存在时Th1的免疫应答反应(图2 B)。IFN-γ和TNF-α预先激活MFs后,MFs支持Th1和Tc1极化的能力进一步增强,从而表明,MF 与 Th1 和 Tc1 之间的相互作用可以在 GCA 期间启动炎症反应的扩增环路。相比之下,用 IFN-γ 和 TNF-α 预处理 MFs 对 T 细胞极化为 Th17 和 Tc17 谱系没有显著影响(图2 C)。
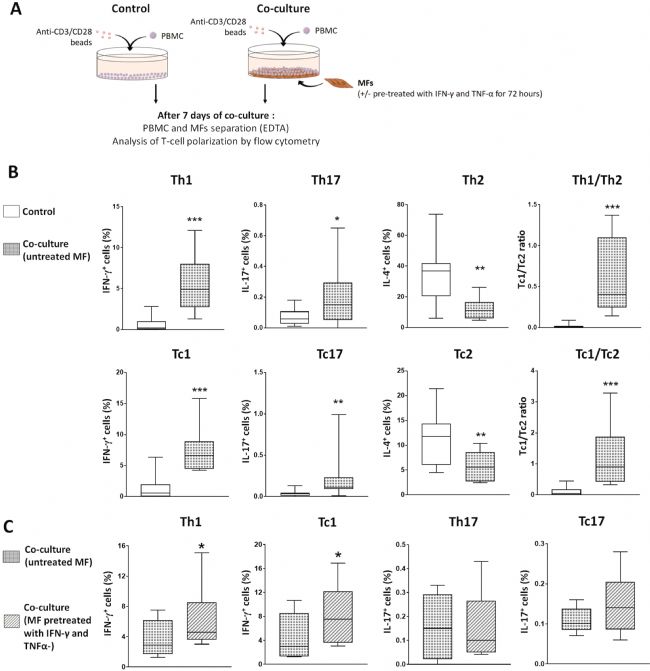
图2 新生内膜MFs支持Th1/Tc1和Th17/Tc17极化,IFN-γ和TNF-α刺激MFs对Th1/Tc1极化的作用增强。
最后,为了确认MFs在与PBMCs共培养时获得的体外结果,研究人员通过免疫荧光分析了GCA患者的3个阳性TABs。结果显示,在整个动脉壁中存在表达IFN-γ 和/或 IL-17的CD3+ T淋巴细胞,偏向于Th1、Tc1和Th17、Tc17表型。值得注意的是,许多 T 淋巴细胞在与 MFs 直接接触的新生内膜中共表达 IL-17 和 IFN-γ,支持这些细胞类型在动脉壁内的直接相互作用。
图3显示了单独培养的 MFs 或用同种异体 PBMC 共培养的 MFs,在有或没有 IFN-γ 和 TNF-α 预处理的情况下与 Th17 和 Th1 极化有关的基因的 mRNA 表达水平。数据表明,与PBMCs共培养可诱导MFs强烈活化,导致与 Th17 极化有关的基因(IL6、IL1B、IL23A 和 IL12B )的 mRNA 表达水平的急剧上升。用IFN-γ和TNF-α预处理MFs诱导IL6和IL1B的表达相似,但IL23A、IL12A和IL12B的表达增加更强(图3 B)。这表明MFs对Th1/Tc1极化的维持与MFs在共培养情况下合成极化细胞因子有关。
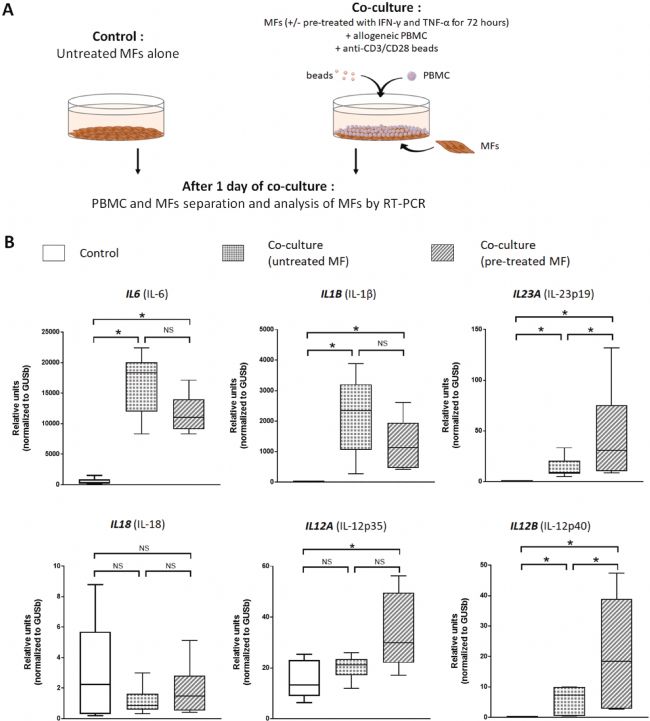
图3 MFs对Th1/Tc1极化的维持与MFs在共培养情况下合成极化细胞因子有关。
总之,该研究结果表明,MFs不仅参与血管重塑或单核细胞募集,而且还在支持Th1和Th17极化以及动脉炎症方面发挥作用。此外,由于其对IFN-y的敏感性,MFs可能在维持Th1炎症反应中发挥作用,Th1炎症反应被认为在GCA的发病机制中起重要作用。因此,这些细胞本身就应该被视为治疗靶点,该研究还表明,JAK抑制剂可以抵消它们在GCA发病机制中的一些重要功能。
参考文献:Greigert H, Ramon A, Genet C, Cladière C, Gerard C, Cuidad M, Corbera-Bellalta M, Alba-Rovira R, Arnould L, Creuzot-Garcher C, Martin L, Tarris G, Ghesquière T, Ouandji S, Audia S, Cid MC, Bonnotte B, Samson M. Neointimal myofibroblasts contribute to maintaining Th1/Tc1 and Th17/Tc17 inflammation in giant cell arteritis. J Autoimmun. 2024 Jan;142:103151. doi: 10.1016/j.jaut.2023.103151. Epub 2023 Dec 1. PMID: 38039746.
原文链接:https://pubmed.ncbi.nlm.nih.gov/38039746/
Impact Factor 7.9
Online ISSN: 1095-9157
Print ISSN: 0896-8411
图片来源:所有图片均来源于参考文献
小编旨在分享、学习、交流生物科学等领域的研究进展。如有侵权或引文不当请联系小编修正。如有任何的想法以及建议,欢迎联系小编。感谢各位的浏览以及关注!进入官网www.naturethink.com或关注"Naturethink"公众号,了解更多相关内容。
点击了解:动脉壁面剪切力多细胞共培养装置





