下丘脑小胶质细胞促进高血压交感神经过度兴奋机制详解
2024年8月7日Immunity杂志在线发表浙江大学史鹏教授团队的研究成果:下丘脑小胶质细胞ATP-P2Y12-C/EBPβ信号介导高血压的发生。

1、高血压模型小胶质细胞反应性激活发生在交感神经元过度兴奋之前
在注射硝基左旋精氨酸甲酯(L-NAME,引起高血压)3天后PVN脑区小胶质细胞数量增多,但在调节交感神经的躯体感觉桶状皮层(S1BF)和外侧下丘脑区域并未检测到这种增加。此外,注射血管紧张素II(Ang II)3天后也能增加小胶质细胞数量。
电生理实验和免疫荧光实验发现在L-NAME注射后第5天PVN脑区前交感神经元放电活动增强,血液中去甲肾上腺素浓度升高,表明交感神经元兴奋。单细胞测序发现在L-NAME注射后第3天PVN脑区小胶质细胞差异性富集表达基因主要与细胞迁移、活性氧、炎症反应信号通路有关,这些结果表明PVN脑区小胶质细胞反应性激活发生在交感神经元过度兴奋之前。
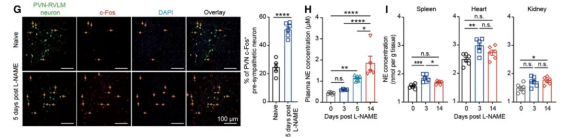
图1、高血压模型小胶质细胞反应性激活发生在交感神经元过度兴奋之前
2、独特的血管拓扑结构使外周ATP更容易通过血脑屏障进入PVN
已有研究表明血压升高后血液中红细胞释放ATP,后者通过嘌呤能受体可促进小胶质细胞迁移。免疫荧光实验发现L-NAME注射后第3天PVN脑区小胶质细胞增殖并不多,表明增多的小胶质细胞可能是迁移形成的。侧脑室内注射ATP水解酶可阻断高血压模型早期的小胶质细胞增多。光纤成像记录系统结合ATP荧光探针发现在Ang II诱发的高血压模型中PVN脑区ATP释放增多。
静脉注射外源性罗丹明B(分子大小接近于ATP)后主要聚集在下丘脑。进一步形态学分析发现相比于其他脑区,PVN脑区毛细血管密度更大,血管直径更小,分支更多。这些结果表明PVN脑区独特的血管形态学特点使其更容易募集外周的ATP。
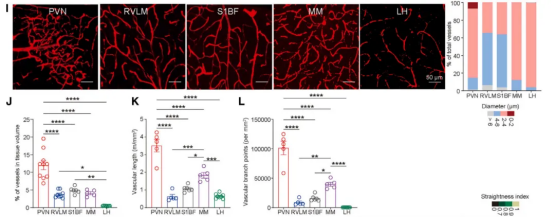
图2、PVN脑区独特的血管拓扑结构
3、C/EBPβ-P2Y12信号调控高血压模型中小胶质细胞激活
表达在小胶质细胞的嘌呤能受体P2Y12在血脑屏障损伤时可促进小胶质细胞迁移。高血压模型小鼠侧脑室注射P2Y12拮抗剂后可减少PVN脑区小胶质细胞聚集,并能降低血压。P2Y12激动剂注射3天后可特异性增加PVN脑区小胶质细胞密度。通过基因工具小鼠特异性敲除小胶质细胞P2Y12也可以减少高血压模型早期小胶质细胞聚集,也能够有效降低血压。
在L-NAME和Ang II引起PVN脑区小胶质细胞33个差异性表达基因中均出现转录因子CCAAT增强子结合蛋白β(C/EBPβ)。立体细胞实验发现ATP可增加小胶质细胞C/EBPβ表达,这种变化可被P2Y12拮抗剂阻断。高血压模型早期PVN脑区小胶质细胞C/EBPβ磷酸化水平升高,敲除P2Y12可阻断这种升高。通过病毒工具特异性敲除小胶质细胞C/EBPβ后可减少高血压模型小鼠PVN脑区小胶质细胞聚集,降低血压。
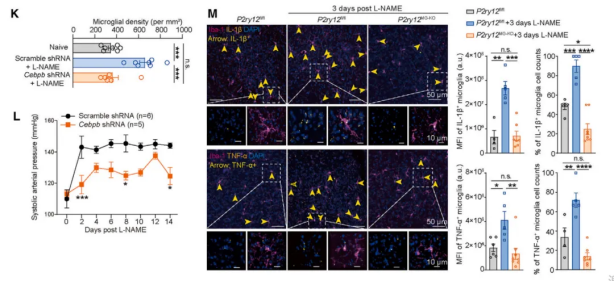
图3、C/EBPβ-P2Y12信号调控高血压模型中小胶质细胞激活
总结
本文发现高血压模型小鼠早期外周ATP通过独特的血管形态学特征募集到下丘脑PVN脑区,并通过P2Y12促进小胶质细胞聚集,引起神经免疫反应,引起交感神经过度兴奋,最终增加血压。
声明:本文是在原英文文献基础上进行解读,存在观点偏向性,仅作分享,请参考原文深入学习。
参考文献:https://doi.org/10.1016/j.immuni.2024.07.011





