力诱导的 Caspase-1 依赖性焦亡调控正畸牙齿移动
Force-induced Caspase-1-dependent pyroptosis regulates orthodontic tooth movement
Subject terms: Cell death, Mesenchymal stem cells, Bone remodelling
细胞焦亡是一种裂解性程序性细胞死亡,由炎性半胱天冬酶(Caspases)启动,其特征是gasdermin(GSDM)介导的细胞膜穿孔和细胞内容物的释放。细胞外或细胞内刺激可激活细胞焦亡,包括病原体感染、炎症、肿瘤和机械力。根据不同的环境刺激和炎性半胱天冬酶,焦亡可分为典型途径和非典型途径。在典型细胞焦亡中,Nod样受体蛋白3(NLRP3)等炎症小体激活Caspase-1以裂解gasdermin D(GSDMD)并将pro-IL-1β加工成成熟的IL-1β。在非典型焦亡中,Caspase-11/4/5 在识别细胞溶质脂多糖时被激活以裂解 GSDMD,其独立于炎症小体和 Caspase-1。
正畸牙齿移动(OTM)是一种由机械力刺激诱导的无菌炎症性骨重塑过程。牙周膜(PDL)干细胞/祖细胞是牙周组织中的主要细胞成分,在OTM过程中不断受到力刺激,参与炎症反应和骨重塑过程。研究报道了炎症因子、趋化因子和气体分子(如硫化氢)的表达在力刺激的 PDL 干细胞/祖细胞中增加。此外,体外循环拉伸可以通过 Caspase-1 相关机制激活PDL 细胞的 NLRP 炎症小体并诱导 IL-1β 的释放。然而,机械力是否以及如何诱导 PDL 干细胞/祖细胞焦亡,从而影响 OTM 和牙槽骨重塑仍然未知。
瞬时感受器电位离子通道香草素受体4(TRPV4)可以调节机械转导、炎症激活和机械力诱导的牙槽骨重塑。此前,体内和体外的研究发现TRPV4 参与OTM 期间 PDL 干细胞功能的调节,TRPV4还可以介导慢性阻塞性肺疾病中的气道上皮细胞焦亡。因此,有理由假设 TRPV4 参与 PDL 祖细胞中力诱导的焦亡。
最近,北京大学口腔医院正畸科研究团队在International Journal of Oral Science 上发表了题为“Force-induced Caspase-1-dependent pyroptosis regulates orthodontic tooth movement”的文章。该研究旨在说明机械力是否以及如何诱导牙周膜祖细胞(PDLPs)焦亡并影响 OTM 和牙槽骨重塑,通过使用 OTM 动物模型、力诱导的离体人 PDL 祖细胞和体外压缩力负荷模型,发现机械力诱导 PDL 祖细胞 Caspase-1 依赖性焦亡,促进了 OTM 和牙槽骨重塑。这项研究揭示了 OTM 的新机制,并表明靶向 Caspase-1 可能是加速 OTM 的一种有前途的方法。

首先,为了研究机械力诱导的焦亡是否调节体内牙槽骨重塑,建立了力诱导OTM和牙槽骨重塑模型。在3 d、7 d和14 d的力负荷(50-60g)下,大鼠的OTM距离逐渐增加。CD90 是大鼠PDLPs的标志物,免疫荧光显示,经力负荷3 d后,牙周组织压力侧Caspase-1+CD90+ 细胞、GSDMD+CD90+ 细胞、IL-1β+CD90+ 细胞数量均增加。然而,在张力侧,与对照组相比,焦亡相关标志物的表达没有变化。此外,在力刺激7 d后,牙周组织中Caspase-1、Gsdmd和IL-1β等焦亡相关基因的表达显著上调。这说明,机械力在体内 OTM 和牙槽骨重塑过程中诱导PDLPs焦亡。
为进一步探讨焦亡水平对OTM的影响,使用焦亡激活剂PPVI或抑制剂MCC950来增强或阻断焦亡水平,发现PPVI注射后OTM距离增加,MCC950注射后OTM距离减小。同时,PPVI注射后,牙周组织中力诱导的Caspase-1、GSDMD和IL-1β表达进一步升高,而MCC950部分逆转了焦亡相关标志物的表达。
Caspase-1 是典型焦亡途径中裂解 GSDMD 的关键因素,因此进一步确认力诱导的焦亡是否需要 Caspase-1 的激活。力负荷7d后,Caspase-1−/− 小鼠的OTM距离显著缩短(图1 a)。相应地,Caspase-1−/− 小鼠牙周组织中Caspase-1、GSDMD、IL-1β的表达显著降低(图1 b)。这些数据表明,机械力可以诱导Caspase-1-依赖性细胞焦亡,从而进一步促进OTM和牙槽骨重塑。
此外,在力诱导的牙齿移动过程中,每隔一天将Caspase-1抑制剂Belnacasan(VX765)注射到小鼠体内,发现牙齿移动距离明显减小(图1 c)。且力诱导的Caspase-1、GSDMD和IL-1β表达的上调被部分逆转(图1 d)。
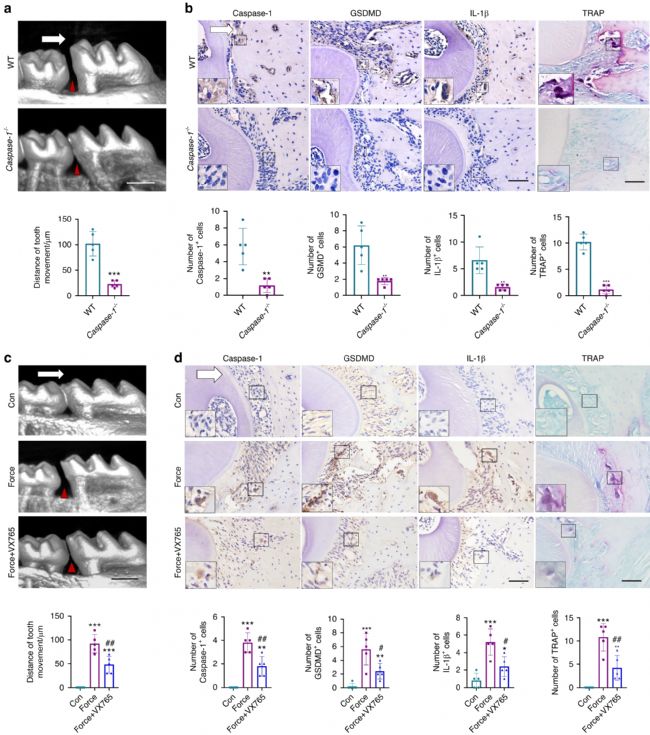
图1 机械力诱导的焦亡以 Caspase-1 依赖性方式调节 OTM 和牙槽骨重塑。
PDL干细胞/祖细胞是响应机械力并促进OTM的主要细胞,因此实验接下来检测机械力是否在力刺激下诱导PDL祖细胞焦亡。在有或没有力负荷的离体h-PDLPs中检测焦亡相关标志物的表达(图2 a),发现力负荷7 d后,在NLRP3炎症小体、裂解的Caspase-1(Cl-Casp-1)、GSDMD、裂解的GSDMD(N-GSDMD)以及IL-1β和裂解的IL-1β(Cl-IL-1β)等焦亡相关标志物的蛋白和mRNA表达均显著增加(图2 b)。
然后验证了PDLPs焦亡与破骨细胞活性之间的关系,将离体h-PDLPs与外周血单核细胞(PBMCs)共培养,进行或不进行正畸力预处理。hF7d(正畸力)组RANKL蛋白表达显著增强,而OPG表达保持不变(图2 c),RANKL/OPG比值上调(图2 d),RANKL分泌也增加(图2 e)。此外,hF7d组的TRAP+ 破骨细胞数量显著增加(图2 f),破骨细胞中组织蛋白酶K(CTSK)和TRAP的mRNA表达也显著增加(图2 g)。这些数据表明,机械力诱导人离体PDLPs焦亡并影响破骨细胞活性。
在体外进一步对PDLPs施加压缩力。蛋白质印迹显示低于 1.5 g/cm2的力刺激下,焦亡相关蛋白的表达从3 h开始增加持续24 h,在6 h达到峰值(图2 h)。此外,在6 h不同强度力刺激下(0.5 g/cm2、1.5 g/cm2、2.0 g/cm2),焦亡相关标志物的蛋白表达持续增加(图2 i)。
OM图像中观察到细胞轮廓模糊,肿胀膨大,并且有许多气泡状突出物的焦亡形态。此外,PDLPs细胞膜在1.0 g/cm2的压缩力刺激下形成孔隙,1.5 g/cm2下出现更明显的膜破裂、细胞肿胀和溶解(图2 j)。这些发现表明,机械力在体内和体外诱导PDLPs的焦亡。
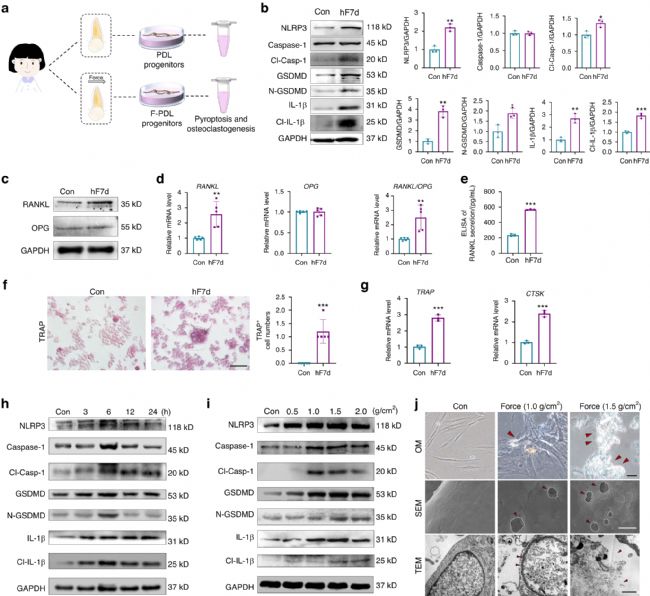
图2 机械力诱导人PDL祖细胞焦亡并影响破骨细胞活性。
进一步地,利用PPVI 和MCC950 在体外处理力负荷的 PDLPs。蛋白质印迹分析显示,力负荷能提高细胞焦亡相关蛋白的表达水平,PPVI 应用后进一步增强,MCC950 应用后部分抑制。此外,应用PPVI后GSDMD+CD90+ 细胞、Caspase-1+CD90+ 细胞和IL-1β+CD90+ 细胞的数量均增加,MCC950处理后减少。此外,PPVI处理后RANKL/OPG比率上调,RANKL分泌增加,MCC950处理则相反。
此外,Belnacasan(VX765)也被用于体外处理力负荷PDLPs,发现力诱导的焦亡相关蛋白表达降低(图3 a)。此外,应用VX765后Caspase-1+CD90+ 细胞、GSDMD+CD90+ 细胞和IL-1β+CD90+ 细胞的数量均减少(图3 b),但VX765显著逆转了RANKL蛋白和RANKL/OPG比值的上调(图3 c),基因表达水平上也类似(图3 d),RANKL的分泌也减少(图3 e)。这些数据表明,PDLPs中力诱导的焦亡需要Caspase-1的激活,这进一步促进了破骨细胞生成。
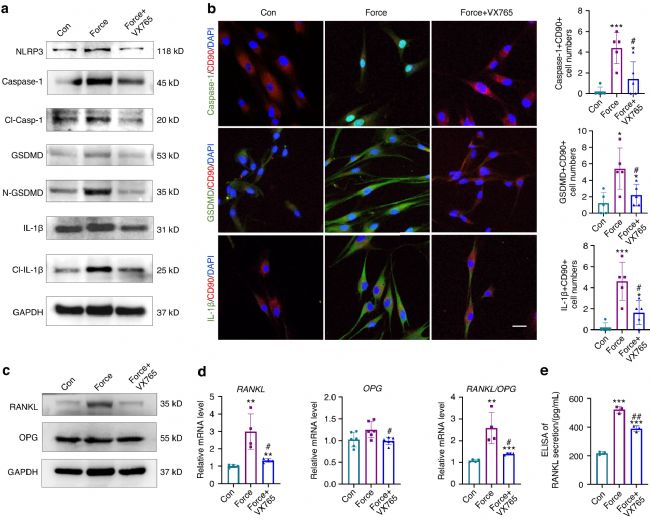
图3 体外调控Caspase-1影响PDL祖细胞中RANKL/OPG的表达。
蛋白质印迹和免疫荧光染色显示,hF7d组离体h-PDLPs中TRPV4的表达增强(图4 b)。在大鼠OTM模型中,Caspase-1+TRPV4+ 细胞和GSDMD+TRPV4+ 细胞的数量呈时间依赖性增加(图4 c)。此外,应用TRPV4抑制剂GSK2193874(GSK219)后,力诱导的焦亡相关标志物表达的增加被部分抑制(图4 d)。
TRPV4 通过介导细胞内 Ca 2+ 内流调节多种细胞功能。最后,实验假设 TRPV4 通过 Ca2+ 内流调控 PDLPs焦亡,进而诱导活性氧(ROS)升高和线粒体损伤。结果表明,力负荷增加PDLPs中 Ca2+ 内流和ROS水平,这可被GSK219阻断(图4 e)。此外,线粒体在力处理的PDLPs中肿胀和破裂,GSK219处理后形态趋于正常,线粒体膜电位的下降和ATP生成受损也被逆转(图4 e)。这些发现表明,TRPV4信号在调节PDLPs中力诱导的Caspase-1-依赖性焦亡中起着重要作用(图4 a)。
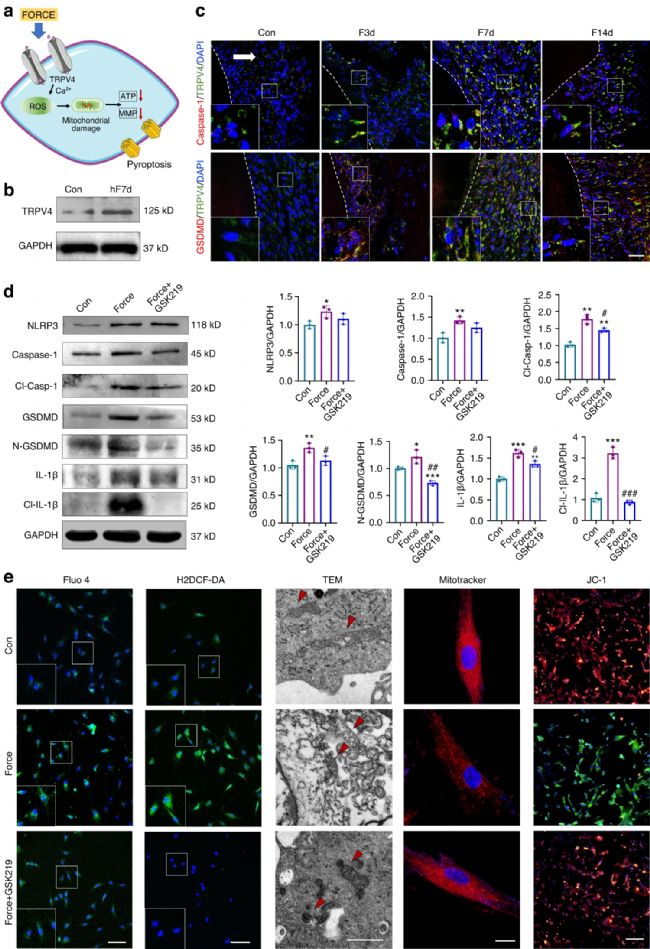
图4 TRPV4信号参与了PDL祖细胞的焦亡。
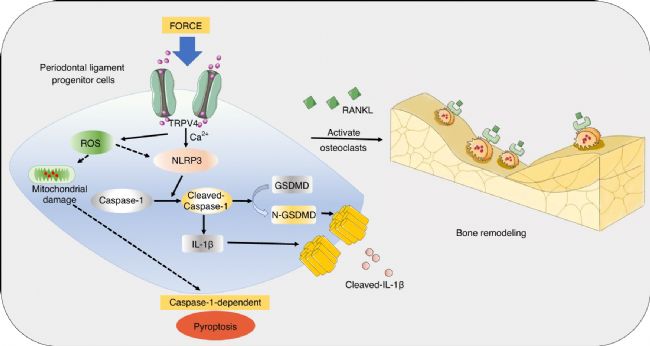
图5 示意图显示PDL 祖细胞中力诱导的 Caspase-1-依赖性焦亡需要通过 TRPV4 信号转导,最终促进激活破骨细胞生成和牙槽骨重塑
总之,该研究表明,机械力在大鼠、小鼠和人类模型的 PDL 祖细胞中诱导 Caspase-1-依赖性焦亡。这种 Caspase-1-依赖性焦亡有助于 OTM 和牙槽骨重塑。这项研究为机械刺激下破骨细胞生成的调控提供了新的见解,表明靶向 Caspase-1-依赖性焦亡可能是加速 OTM 的一种有前途的策略。
参考文献:Chen L, Yu H, Li Z, Wang Y, Jin S, Yu M, Zhu L, Ding C, Wu X, Wu T, Xun C, Zhou Y, He D, Liu Y. Force-induced Caspase-1-dependent pyroptosis regulates orthodontic tooth movement. Int J Oral Sci. 2024 Jan 15;16(1):3. doi: 10.1038/s41368-023-00268-7. PMID: 38221531; PMCID: PMC10788340.
原文链接:https://pubmed.ncbi.nlm.nih.gov/38221531/
2-year Impact Factor*: 14.9
ISSN:1674-2818, eISSN:2049-3169
图片来源:所有图片均来源于参考文献
小编旨在分享、学习、交流生物科学等领域的研究进展。如有侵权或引文不当请联系小编修正。如有任何的想法以及建议,欢迎联系小编。感谢各位的浏览以及关注!进入官网www.naturethink.com或关注"Naturethink"公众号,了解更多相关内容。
点击了解:细胞牵张力装置





