O2k在气体信号分子H2S诱导氧化代谢长期多效性影响机制研究的应用
摘要:
中等剂量的H2S暴露会导致哺乳动物出现严重但可逆的低代谢。在细胞水平上,H2S通过还原羧化抑制电子传输链(ETC),增强有氧糖酵解和谷氨酰胺代谢;然而,这些变化的持久性是未知的。作者研究表明,尽管H2S预处理具有挥发性,但它会增加P50(O2),即半饱和氧分压,并对氧化代谢具有多效性影响,这种影响会持续24小时以上。H2S诱导的低代谢在血液供应不足或中断引起的创伤或疾病临床中是有益的,作者的研究对减轻缺血再灌注损伤和/或延长血小板等生物制品的保质期具有重要意义。
结果:
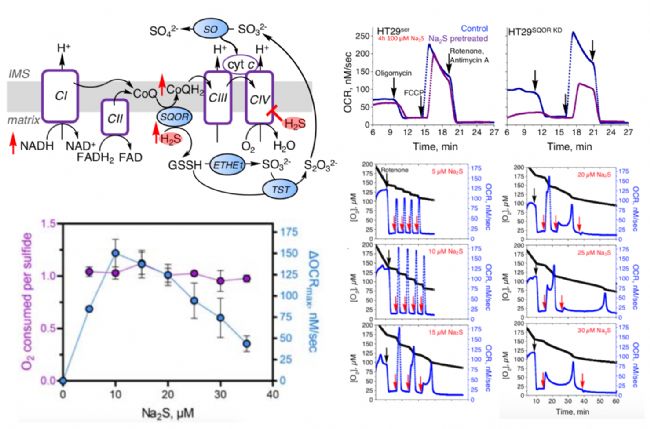
H2S氧化途径通过一系列氧化和硫转移酶步骤将H2S转化为硫代硫酸盐和硫酸盐。硫醌氧化还原酶(SQOR)使H2S分解代谢产生电子,利用辅酶Q(CoQ)作为电子受体,促进CoQ还原态增加,因此存在于H2S氧化和电子传输链(ETC)的交叉点。SQOR依赖的H2S氧化增强了电子传递,促进了ATP的合成。然而,当H2S浓度超过SQOR分解代谢能力时,H2S抑制复合体IV,表现为细胞耗氧率(OCR)降低。
为了进一步验证不同剂量的H2S暴露对OCR的影响,作者利用奥地利Ororboros O2k多维度线粒体能量代谢分析系统具有无加药数量限制及完全封闭环境下检测的特点,添加了复合体I抑制剂鱼藤酮(Rotenone),减少了CoQ氧化还原态变化的干扰;然后重复添加硫化钠(Na2S,产生H2S),Na2S低浓度(<15 μM)引发OCR最大值急剧增加, Na2S高浓度(>20 μM)引发OCR最大值逐渐降低,由此,OCR最大值变化表现出对H2S浓度的钟形依赖性。
为了进一步验证H2S诱导线粒体功能的长期性变化,将HT29Scr、HT29SQOR KD细胞预处理暴露于Na2S(100 μM,4小时),HT29Scr基础代谢率和最大呼吸率相对于Control组,都有降低;而HT29SQOR KD基础代谢率和最大呼吸率相对于Control组,都有显著性降低;同时也进一步说明硫醌氧化还原酶(SQOR)使H2S分解代谢产生电子,增加了电子传递,增强了线粒体功能。
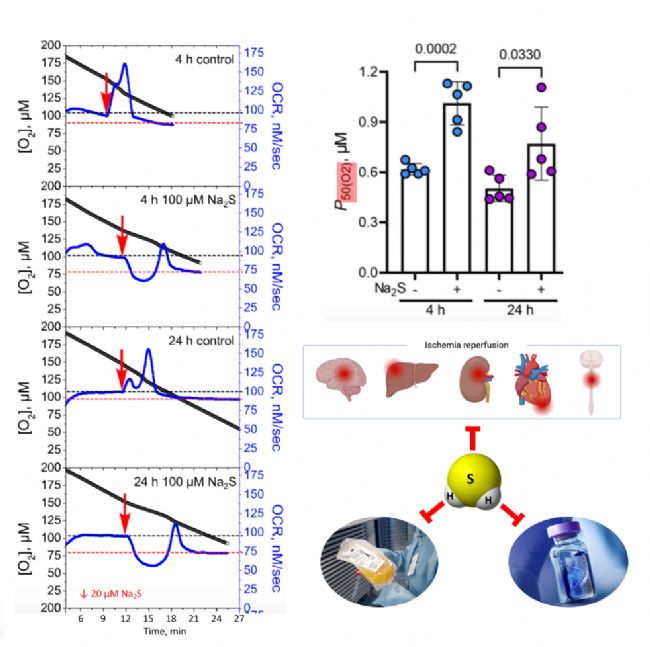
单次急性H2S暴露对氧化代谢产生长期影响:作者检查了4小时、24小时单次急性暴露于Na2S(100 μM)后代谢效应的持久性;在单次暴露于Na2S(100 μM)后4小时和24小时,P50(O2)值出现了显著性增加,表明耗氧能力显著降低。
讨论:实验结果显示细胞对H2S的反应范围从低浓度H2S的O2消耗急速增加到高浓度H2S的O2消耗抑制,反映了H2S对氧化代谢的多效性;并且细胞暴露于H2S后,其氧化代谢水平持续性降低超过24小时。所以作者还提出既然H2S预处理可以维持低代谢时间窗口,防止进一步的氧化损伤,那么对严重创伤(如中重度烧伤)的高代谢反应、缺血再灌注损伤以及失控性炎症等临床病症就具有潜在的治疗作用;也会具有对延长生物制品保质期的潜在作用。
参考文献:David A. Hanna , et al. H2S preconditioning induces long-lived perturbations in O2 metabolism. PNAS. 2024 March 13;121(12)e2319473121. https://doi.org/10.1073/pnas.2319473121.





