BPIFB1 通过诱导 M2 型巨噬细胞极化促进激素受体阳性乳腺癌的转移
乳腺癌(BC)是全球女性癌症相关死亡的主要原因之一,在所有 BC 亚型中,激素受体阳性乳腺癌(HR+ BRCA)是最多的。骨髓是乳腺癌最易发生转移的部位,肿瘤细胞的骨髓微转移(BMM)是预后不良的恶性肿瘤的显著特征。淋巴结状态与 BMM 显著相关,并可能作为后续转移的“孵化器”。因此,探索淋巴结转移的潜在分子机制对于确定有效和新颖的 BC 治疗策略至关重要。
BPIFB1(杀菌/渗透增强折叠家族蛋白B1),也称为 LPLUNC1,是 BPI/PLUNC 超家族的成员,可特异性结合革兰氏阴性菌细胞壁中的 LPS。BPIFB1 在鼻咽癌、肺癌、胃癌等肿瘤组织中异常表达,调节慢性感染和炎症,表明其可能在肿瘤发展中发挥重要作用。
肿瘤相关巨噬细胞(TAMs)是主要的肿瘤浸润免疫细胞类型之一,其中,M2型巨噬细胞具有促进血管生成、淋巴管生成以及促进肿瘤发生和发展的功能。研究表明,TLR4 信号通路的抑制促进了 M2巨噬细胞极化,而 BPIFB1 对该通路表现出抑制作用。因此,探索 BPIFB1 是否通过调节巨噬细胞极化来影响 BC 具有重要意义。
鉴于此,哈尔滨医科大学附属第二医院普外科及大庆油田总医院普外科课题组的一项联合研究曾探讨发现,BPIFB1 在 HR+ BRCA 中异常高表达,尤其是在淋巴结转移的患者中。此外,其高表达与 BC 的不良预后显著相关,尤其是在管腔A 亚型中。从机制上讲,BPIFB1 在体外和体内均作为 M2巨噬细胞极化的激活剂并促进肿瘤转移。研究成果发表在 Cancer Science 期刊题为“BPIFB1 promotes metastasis of hormone receptor-positive breast cancer via inducing macrophage M2-like polarization”。

首先,研究人员收集了癌症基因组图谱(TCGA)的 RNA 测序表达谱和临床信息,并将样本分为无局部淋巴结(N0)转移(NMT)患者样本和N1-3淋巴结状态(LMT)患者样本两组进行基因差异分析,其中,BPIFB1,尚未在 BC 中报道,被选为进一步调查的候选靶点。
然后评估了 BPIFB1 在临床乳腺肿瘤样本中表达的临床意义。数据显示,在 HR+ BRCA 中,LMT 组的 BPIFB1 的表达明显高于 NMT 组。此外,发现与正常组织相比,BPIFB1 在癌症组织中,特别是在管腔A型乳腺癌中显著升高。将培养的人乳腺癌 MCF-7 细胞使用雌激素进行刺激,发现雌激素暴露的肿瘤细胞 BPIFB1 表达增加,研究人员推测 BC 中 BPIFB1 的表达可能受雌激素信号通路的调节。同时,与 BPIFB1 阴性组相比,BPIFB1 阳性组的患者趋向于更高的N期(20/33),验证了 BPIFB1 表达与淋巴结转移之间的相关性。总的来说,这些数据表明,BPIFB1 在 HR+ BRCA 中上调,这与淋巴结转移趋势呈正相关。
进一步地,通过生存数据以及 TCGA 和 METABRIC 提供的临床注释进行 KM 分析,结果显示,BPIFB1 的高表达与管腔A型乳腺癌的不良预后显著相关,但在管腔B、HER2 阳性或三阴性亚型中则不相关。
接下来,研究人员进行了富集分析,以探索 BPIFB1 在 HR+ BRCA 中的潜在作用。通过 GSEA 鉴定富集通路,结果表明,BPIFB1 可能与内分泌抵抗和上皮-间充质转化相关,这与 BC 转移关系密切。
此外,对生物过程(GO-BP)、分子功能(GO-MF)和细胞成分(GO-CC)进行了独立测试,表明 BPIFB1 相关基因集在多种免疫相关通路中显著富集(图1 A)。KEGG 通路富集分析结果表明,BPIFB1 相关基因在雌激素信号通路中显著富集(图1 B),这再次证实了上述结果。基于此,研究人员假设 BPIFB1 可能在肿瘤免疫中发挥重要作用。
为了进一步研究 BPIFB1 是否能够调节TME中的免疫细胞,研究人员将 HR+ BRCA 样本根据 BPIFB1 的中位表达分为 BHE 组(BPIFB1高表达)和 BLE 组(BPIFB1低表达)分析了其与免疫细胞浸润之间的关系。结果发现,M2巨噬细胞、初始B细胞、活化的肥大细胞、浆细胞、记忆B细胞和活化的NK细胞在 BHE 亚组中更丰富,而静息NK细胞在 BLE 亚组中更丰富。然而,BPIFB1 与四个已知的 M2 极化调节因子相关基因的 Spearman 相关性没有统计学意义。总的来说,从数据比较中得出的观察结果是,BPIFB1 可能对调节肿瘤微环境中巨噬细胞的极化发挥独立作用。
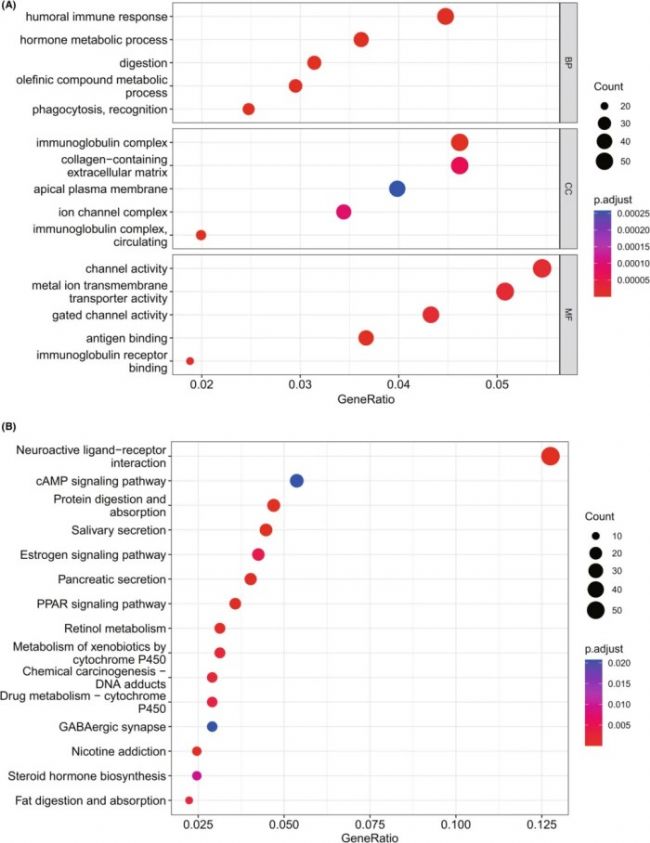 图1 预测BPIFB1在激素受体阳性乳腺癌中的潜在功能和机制。(A、B)BPIFB1 相关基因的 GO 和 KEGG 富集。
图1 预测BPIFB1在激素受体阳性乳腺癌中的潜在功能和机制。(A、B)BPIFB1 相关基因的 GO 和 KEGG 富集。
众所周知,肿瘤微环境中的巨噬细胞可以被癌细胞影响。BPIFB1 水平在 T47D 和 MCF-7 细胞中过表达,研究人员还使用 qPCR 分析来证实其有效性(图2 A)。最后,为了探索癌细胞来源的 BPIFB1 是否可以调节巨噬细胞 M2 活化,实验构建了 BC 肿瘤细胞/THP1 共培养系统,检测了 THP-1 细胞的 M2 巨噬细胞标志物(CD206、CD163)。ELISA 测定法证实,与对照组相比,共培养系统上清液中的可溶性 BPIFB1 显著增加(图2 B)。共培养后,通过刺激 THP-1 中的 BPIFB1,CD206 和 CD163 的表达显著增加 (图2 C)。与上述分析结果一致,研究认为,癌细胞衍生的 BPIFB1 可能会促进 M2巨噬细胞极化。
然后,为了研究 BPIFB1 对 THP1 细胞的肿瘤调节作用,在体外进行了功能研究。与对照组相比,BPIFB1 的过表达显著增加了与 THP1 共培养的肿瘤细胞的迁移和侵袭能力(图2 D)。有趣的是,共培养系统中 THP-1 的缺失抑制了 BPIFB1 过表达对 MCF-7 细胞迁移和侵袭的影响,这表明巨噬细胞在 BPIFB1 对 BC 的表型调控中具有重要意义。
为了进一步证实上述在体内的发现,建立了异种移植小鼠模型(图2 E),观察到 BPIFB1 在 BC 肿瘤细胞中的过表达显著增加了肺转移模型中的异种移植肿瘤大小(图2 F)。与体外细胞实验的结果相似,注射 BPIFB1 过表达 BC 细胞的小鼠表现出更多的肺转移性结节(图2 G)。
此外,为了进一步验证 BPIFB1 是否也通过刺激 M2巨噬细胞极化促进体内肿瘤进展,采用 IHC 染色检测组织中 CD206 和 CD163 的表达,发现 M2巨噬细胞标志物在注射 BPIFB1 过表达 BC 细胞的小鼠模型的组织中表达水平较高(图2 H)。一致地,体外细胞实验还证实,BPIFB1 也能调节小鼠巨噬细胞 RAW264.7 的极化,从而影响肿瘤细胞的表型。这些数据共同证实了,BPIFB1 在体外和体内促进肿瘤细胞的增殖和迁移,并可能在增强 M2巨噬细胞极化方面发挥作用。
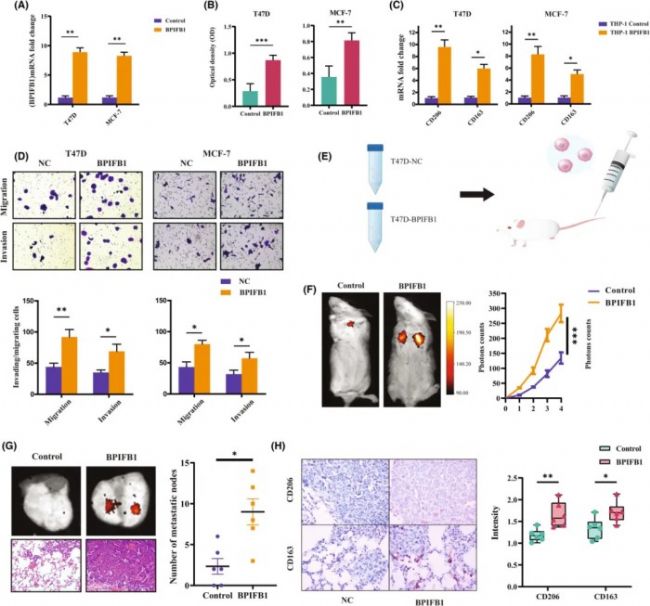 图2 BPIFB1 通过在体外和体内刺激 M2 巨噬细胞极化来促进激素受体阳性乳腺癌的进展。
图2 BPIFB1 通过在体外和体内刺激 M2 巨噬细胞极化来促进激素受体阳性乳腺癌的进展。
(A)qPCR分析测定BPIFB1 mRNA表达。(B)ELISA测定培养上清液中可溶性BPIFB1蛋白表达水平。(C)qPCR检测THP1中CD206和CD163的表达。(D)Transwell迁移和侵袭测定。(E)尾静脉注射T47D肿瘤细胞构建小鼠肺转移模型。(F)小鼠模型用于分析肿瘤的生长。(G)转移性肺结节的定量用于表征肿瘤转移。(H)移植肿瘤中CD206 和 CD163的表达。
综上所述,该研究通过生物信息学分析确定了与 HR+ BRCA 淋巴结转移显著相关的新靶点 BPIFB1。BPIFB1 与各种转移相关的临床特征相关,并预示 HR+ BRCA 的不良预后。从机制上讲,它促进了 M2巨噬细胞极化,从而增强了肿瘤细胞的迁移和侵袭能力。动物实验进一步证实 BPIFB1 在体内促进了激素受体阳性 BC 的转移。研究结果为肿瘤免疫和 BPIFB1 的机制提供了新的见解。
参考文献:Hu A, Liu Y, Zhang H, Wang T, Zhang J, Cheng W, Yu T, Duan Y, Feng J, Chen Z, Ding Y, Li Y, Li M, Rong Z, Shang Y, Shakila SS, Zou Y, Ma F, Guo B. BPIFB1 promotes metastasis of hormone receptor-positive breast cancer via inducing macrophage M2-like polarization. Cancer Sci. 2023 Nov;114(11):4157-4171. doi: 10.1111/cas.15957. Epub 2023 Sep 13. PMID: 37702269; PMCID: PMC10637056.
原文链接:https://pubmed.ncbi.nlm.nih.gov/37702269/
图片来源:所有图片均来源于参考文献
小编旨在分享、学习、交流生物科学等领域的研究进展。如有侵权或引文不当请联系小编修正。如有任何的想法以及建议,欢迎联系小编。感谢各位的浏览以及关注!进入官网www.naturethink.com或关注"Naturethink"公众号,了解更多相关内容。
点击了解:细胞共培养
BPIFB1(杀菌/渗透增强折叠家族蛋白B1),也称为 LPLUNC1,是 BPI/PLUNC 超家族的成员,可特异性结合革兰氏阴性菌细胞壁中的 LPS。BPIFB1 在鼻咽癌、肺癌、胃癌等肿瘤组织中异常表达,调节慢性感染和炎症,表明其可能在肿瘤发展中发挥重要作用。
肿瘤相关巨噬细胞(TAMs)是主要的肿瘤浸润免疫细胞类型之一,其中,M2型巨噬细胞具有促进血管生成、淋巴管生成以及促进肿瘤发生和发展的功能。研究表明,TLR4 信号通路的抑制促进了 M2巨噬细胞极化,而 BPIFB1 对该通路表现出抑制作用。因此,探索 BPIFB1 是否通过调节巨噬细胞极化来影响 BC 具有重要意义。
鉴于此,哈尔滨医科大学附属第二医院普外科及大庆油田总医院普外科课题组的一项联合研究曾探讨发现,BPIFB1 在 HR+ BRCA 中异常高表达,尤其是在淋巴结转移的患者中。此外,其高表达与 BC 的不良预后显著相关,尤其是在管腔A 亚型中。从机制上讲,BPIFB1 在体外和体内均作为 M2巨噬细胞极化的激活剂并促进肿瘤转移。研究成果发表在 Cancer Science 期刊题为“BPIFB1 promotes metastasis of hormone receptor-positive breast cancer via inducing macrophage M2-like polarization”。

首先,研究人员收集了癌症基因组图谱(TCGA)的 RNA 测序表达谱和临床信息,并将样本分为无局部淋巴结(N0)转移(NMT)患者样本和N1-3淋巴结状态(LMT)患者样本两组进行基因差异分析,其中,BPIFB1,尚未在 BC 中报道,被选为进一步调查的候选靶点。
然后评估了 BPIFB1 在临床乳腺肿瘤样本中表达的临床意义。数据显示,在 HR+ BRCA 中,LMT 组的 BPIFB1 的表达明显高于 NMT 组。此外,发现与正常组织相比,BPIFB1 在癌症组织中,特别是在管腔A型乳腺癌中显著升高。将培养的人乳腺癌 MCF-7 细胞使用雌激素进行刺激,发现雌激素暴露的肿瘤细胞 BPIFB1 表达增加,研究人员推测 BC 中 BPIFB1 的表达可能受雌激素信号通路的调节。同时,与 BPIFB1 阴性组相比,BPIFB1 阳性组的患者趋向于更高的N期(20/33),验证了 BPIFB1 表达与淋巴结转移之间的相关性。总的来说,这些数据表明,BPIFB1 在 HR+ BRCA 中上调,这与淋巴结转移趋势呈正相关。
进一步地,通过生存数据以及 TCGA 和 METABRIC 提供的临床注释进行 KM 分析,结果显示,BPIFB1 的高表达与管腔A型乳腺癌的不良预后显著相关,但在管腔B、HER2 阳性或三阴性亚型中则不相关。
接下来,研究人员进行了富集分析,以探索 BPIFB1 在 HR+ BRCA 中的潜在作用。通过 GSEA 鉴定富集通路,结果表明,BPIFB1 可能与内分泌抵抗和上皮-间充质转化相关,这与 BC 转移关系密切。
此外,对生物过程(GO-BP)、分子功能(GO-MF)和细胞成分(GO-CC)进行了独立测试,表明 BPIFB1 相关基因集在多种免疫相关通路中显著富集(图1 A)。KEGG 通路富集分析结果表明,BPIFB1 相关基因在雌激素信号通路中显著富集(图1 B),这再次证实了上述结果。基于此,研究人员假设 BPIFB1 可能在肿瘤免疫中发挥重要作用。
为了进一步研究 BPIFB1 是否能够调节TME中的免疫细胞,研究人员将 HR+ BRCA 样本根据 BPIFB1 的中位表达分为 BHE 组(BPIFB1高表达)和 BLE 组(BPIFB1低表达)分析了其与免疫细胞浸润之间的关系。结果发现,M2巨噬细胞、初始B细胞、活化的肥大细胞、浆细胞、记忆B细胞和活化的NK细胞在 BHE 亚组中更丰富,而静息NK细胞在 BLE 亚组中更丰富。然而,BPIFB1 与四个已知的 M2 极化调节因子相关基因的 Spearman 相关性没有统计学意义。总的来说,从数据比较中得出的观察结果是,BPIFB1 可能对调节肿瘤微环境中巨噬细胞的极化发挥独立作用。

众所周知,肿瘤微环境中的巨噬细胞可以被癌细胞影响。BPIFB1 水平在 T47D 和 MCF-7 细胞中过表达,研究人员还使用 qPCR 分析来证实其有效性(图2 A)。最后,为了探索癌细胞来源的 BPIFB1 是否可以调节巨噬细胞 M2 活化,实验构建了 BC 肿瘤细胞/THP1 共培养系统,检测了 THP-1 细胞的 M2 巨噬细胞标志物(CD206、CD163)。ELISA 测定法证实,与对照组相比,共培养系统上清液中的可溶性 BPIFB1 显著增加(图2 B)。共培养后,通过刺激 THP-1 中的 BPIFB1,CD206 和 CD163 的表达显著增加 (图2 C)。与上述分析结果一致,研究认为,癌细胞衍生的 BPIFB1 可能会促进 M2巨噬细胞极化。
然后,为了研究 BPIFB1 对 THP1 细胞的肿瘤调节作用,在体外进行了功能研究。与对照组相比,BPIFB1 的过表达显著增加了与 THP1 共培养的肿瘤细胞的迁移和侵袭能力(图2 D)。有趣的是,共培养系统中 THP-1 的缺失抑制了 BPIFB1 过表达对 MCF-7 细胞迁移和侵袭的影响,这表明巨噬细胞在 BPIFB1 对 BC 的表型调控中具有重要意义。
为了进一步证实上述在体内的发现,建立了异种移植小鼠模型(图2 E),观察到 BPIFB1 在 BC 肿瘤细胞中的过表达显著增加了肺转移模型中的异种移植肿瘤大小(图2 F)。与体外细胞实验的结果相似,注射 BPIFB1 过表达 BC 细胞的小鼠表现出更多的肺转移性结节(图2 G)。
此外,为了进一步验证 BPIFB1 是否也通过刺激 M2巨噬细胞极化促进体内肿瘤进展,采用 IHC 染色检测组织中 CD206 和 CD163 的表达,发现 M2巨噬细胞标志物在注射 BPIFB1 过表达 BC 细胞的小鼠模型的组织中表达水平较高(图2 H)。一致地,体外细胞实验还证实,BPIFB1 也能调节小鼠巨噬细胞 RAW264.7 的极化,从而影响肿瘤细胞的表型。这些数据共同证实了,BPIFB1 在体外和体内促进肿瘤细胞的增殖和迁移,并可能在增强 M2巨噬细胞极化方面发挥作用。

(A)qPCR分析测定BPIFB1 mRNA表达。(B)ELISA测定培养上清液中可溶性BPIFB1蛋白表达水平。(C)qPCR检测THP1中CD206和CD163的表达。(D)Transwell迁移和侵袭测定。(E)尾静脉注射T47D肿瘤细胞构建小鼠肺转移模型。(F)小鼠模型用于分析肿瘤的生长。(G)转移性肺结节的定量用于表征肿瘤转移。(H)移植肿瘤中CD206 和 CD163的表达。
综上所述,该研究通过生物信息学分析确定了与 HR+ BRCA 淋巴结转移显著相关的新靶点 BPIFB1。BPIFB1 与各种转移相关的临床特征相关,并预示 HR+ BRCA 的不良预后。从机制上讲,它促进了 M2巨噬细胞极化,从而增强了肿瘤细胞的迁移和侵袭能力。动物实验进一步证实 BPIFB1 在体内促进了激素受体阳性 BC 的转移。研究结果为肿瘤免疫和 BPIFB1 的机制提供了新的见解。
参考文献:Hu A, Liu Y, Zhang H, Wang T, Zhang J, Cheng W, Yu T, Duan Y, Feng J, Chen Z, Ding Y, Li Y, Li M, Rong Z, Shang Y, Shakila SS, Zou Y, Ma F, Guo B. BPIFB1 promotes metastasis of hormone receptor-positive breast cancer via inducing macrophage M2-like polarization. Cancer Sci. 2023 Nov;114(11):4157-4171. doi: 10.1111/cas.15957. Epub 2023 Sep 13. PMID: 37702269; PMCID: PMC10637056.
原文链接:https://pubmed.ncbi.nlm.nih.gov/37702269/
图片来源:所有图片均来源于参考文献
小编旨在分享、学习、交流生物科学等领域的研究进展。如有侵权或引文不当请联系小编修正。如有任何的想法以及建议,欢迎联系小编。感谢各位的浏览以及关注!进入官网www.naturethink.com或关注"Naturethink"公众号,了解更多相关内容。
点击了解:细胞共培养





