运动通过 FUNDC1-依赖性线粒体自噬保护老龄小鼠免受冠状动脉内皮衰老
椎间盘疾病(IVDD)是最普遍的脊柱退行性疾病之一。由于长时间站立和肥胖导致的椎间盘(IVD)机械超负荷已被广泛认为是 IVDD 的重要原因,而髓核(NP)承担了 75% 的压力。然而,机械超负荷诱导 IVDD 的具体机制尚未阐明。
谷胱甘肽过氧化酶4(GPX4)是主要的脂质过氧化物清除剂,在铁死亡中起着关键的调节作用。据报道,由机械超负荷激活的 Piezo1 离子通道导致的钙内流增强诱导 GPX4-调控的铁死亡。已发现位于内质网膜(ER)的 Piezo1 的激活通过诱导ER的钙离子释放来增加细胞内游离钙。然而,机械超负荷是否会同时激活位于质膜和内质网膜上的 Piezo1 离子通道以升高 NP 细胞内游离 Ca2+ 的水平,从而导致 GPX4 调控的铁死亡仍有待确定。
硒蛋白K(SelK)是一种ER蛋白,已被证明与内质网应激和细胞抗氧化性有关。硒(Selenium)是一种必需的微量营养素,参与了抗氧化应激的保护。补充硒可以上调各种硒蛋白的表达,并且在滤泡辅助性T细胞中证明了 Selenium-GPX4 轴对铁死亡的保护作用。然而,目前还没有关于补硒是否可以通过上调 NP 细胞中的 SelK 和 GPX4 来减轻铁死亡的报道。
最近,在山东大学齐鲁医院骨科、病理科及美国布莱根妇女医院骨科的一项联合研究中,计划探索机械超负荷是否通过激活位于质膜和内质网膜上的 Piezo1 离子通道来阻碍 GPX4 的产生,从而导致 NP 细胞中的铁死亡。在上述过程中,研究员将确定促进 ER 应激的因素以及ER应激在铁死亡中的具体作用,此外,将验证补充硒是否可以通过上调 GPX4 和 SelK 来减轻机械超负荷诱导的 NP 细胞铁死亡。研究成果发表在 Cellular and Molecular Life Sciences 期刊题为“Selenium-SelK-GPX4 axis protects nucleus pulposus cells against mechanical overloading-induced ferroptosis and attenuates senescence of intervertebral disc”。

首先,实验评估了自然增龄和衰老条件下 FUNDC1 表达的变化。8周龄幼鼠冠状动脉组织中的 FUNDC1 蛋白水平随着年龄的增长逐渐降低。18 月龄的老年小鼠 FUNDC1 水平显著降低(图1 A、B),促衰老的炎症因子 IL-6 和 TNF-α 的 mRNA 水平显著增强(图1 C)。同样,在衰老的内皮细胞中也观察到 FUNDC1 的表达降低,IL-6 和 TNF-α 水平较高(图1 F)。
进一步构建 FUNDC1 内皮特异性敲除(Fundc1fl/Y/Tek-Cre)小鼠。ECs 中的 FUNDC1 缺失损害了 ACh 诱导的血管舒张,但不损害 SNP,表明 FUNDC1 负责维持冠状动脉中正常的内皮依赖性血管舒张功能(图1 G)。MI/R 之后,FUNDC1 基因敲除小鼠中积累的 Gr-1+ 中性粒细胞明显增加(图1 H),表明在 MI/R 损伤后中性粒细胞迁移和内皮通透性增加。eNOS 磷酸化和 VEGF 表达降低以及 ET-1 上调也表明 FUNDC1 敲除小鼠的内皮功能障碍(图1 I、J)。重要的是,EC 特异性 FUNDC1 敲除加重了 MI/R 后心脏收缩功能降低(图1 K)。这些数据表明,低 FUNDC1 表达导致冠状动脉功能障碍和 MI/R 损伤恶化。

接下来,为了阐明运动对年龄相关的 FUNDC1 下调和冠状动脉功能的影响,研究者对比了接受4 周规律运动和久坐不运动的老年小鼠。结果表明,FUNDC1 蛋白在运动小鼠的冠状动脉组织中显著上调,且 ACh 诱导的冠状动脉扩张显著增强,表明运动诱导的内皮依赖性血管舒张得到改善。在进行 MI/R 后,运动的老年小鼠的 Gr-1+ 中性粒细胞迁移减少,且炎症标志物(如IL-6、IL-8和TNF-α)和粘附分子(如VCAM-1、ICAM-1)等均显著降低,表明运动保护 MI/R 在衰老中诱发的微血管高通透性。此外,老年运动小鼠的 eNOS 磷酸化恢复,ET-1 水平降低,且缺血危险区的血管生成显著增加,左室收缩功能有所增强,也减轻了 MI/R 后的心脏损伤。这些数据表明,运动可防止随着年龄增长而下调的 FUNDC1 和冠状动脉功能障碍,并减少衰老心脏 MI/R 损伤的恶化。
为了检查运动对内皮衰老和功能的作用,对运动或久坐的老龄小鼠原代心脏微血管内皮细胞(CMECs)进行 SA-β-gal 染色。结果表明,老年小鼠 SA-β-gal 活性明显上升,而运动显著降低了这些水平,且逆转了衰老标志物 p21 和 p53 在老年 CMECs 中的水平。在老年小鼠 CMECs 中观察到相当高的衰老程度,但运动显著逆转了 CMECs 的衰老,改善了 CMECs 的血管生成能力。这表明,运动缓解了内皮衰老和功能障碍。
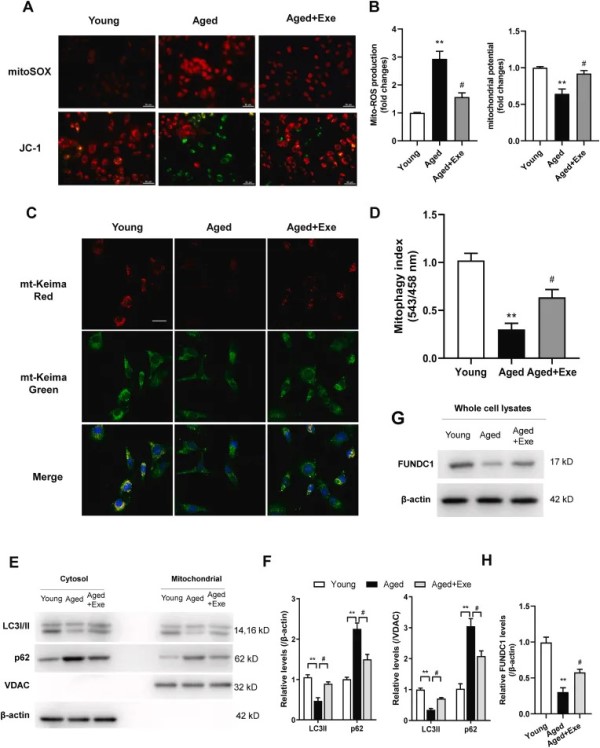
进一步地,实验探讨了线粒体损伤是否与衰老相关的内皮功能障碍有关。在老龄小鼠 CMECs 中观察到堆积的线粒体 ROS 和异常的线粒体膜电位,与久坐的小鼠相比,在运动老龄小鼠的 CMECs 中这些效应被减轻(图2 A、B)。老龄小鼠的 CMECs 在用 FCCP(一种线粒体自噬诱导剂)处理时表现出线粒体自噬受损。衰老导致整体红色 mt-Keima 荧光显著降低(图2 C、D),线粒体 LC3-II 水平降低,p62 水平升高,但这些效应通过运动逆转(图2 E、F)。重要的是,衰老 CMECs 中受损的线粒体自噬是被运动保留(图2 C-F)。老龄小鼠 CMECs 中线粒体自噬受体 FUNDC1 的水平也被证实较低,并且在运动老龄小鼠中恢复其表达(图2 G、H)。这些数据表明,运动减少了衰老 CMECs 的线粒体损伤并恢复了线粒体自噬。
为了验证 FUNDC1 在运动诱导的冠状动脉保护中的作用,实验对 Fundc1fl/Y 和 Fundc1fl/Y/Tek-Cre 小鼠进行为期4周的定期运动训练。结果发现,运动改善 Fundc1fl/Y 小鼠 MI/R 后内皮细胞屏障功能、增强血管新生,改善心脏功能。然后在内皮细胞中过表达 FUNDC1,观察到 FUNDC1 过表达显著降低了 CMECs 中 SA-β-gal 活性,表明过表达的线粒体自噬受体 FUNDC1 逆转了内皮细胞衰老。因此,FUNDC1 过表达改善了 EC 功能,如管形成、迁移和增殖能力。此外,与运动的保护作用一致,FUNDC1 过表达增强了 ACh 刺激的冠状动脉舒张、保护内皮屏障的完整性,恢复了老龄小鼠的 eNOS 磷酸化和 VEGF 表达,并降低了 ET-1 水平。重要的是,AAV-FUNDC1 治疗显著改善了 MI/R 后的心脏收缩功能。这说明,FUNDC1 过表达逆转了内皮衰老和功能障碍。
层流诱导的层流剪切应力(LSS)增加是运动诱导的内皮适应的重要机制。研究者利用层流装置来评估运动过程中 FUNDC1 基因表达的调控机制,并潜在鉴定启动 FUNDC1 转录的转录因子。生物信息学预测表明,FUNDC1 含有 PPARγ 反应元件 (PPRE)(图3 A)。先前的研究表明,层流激活了 ECs 中的 PPARγ。因此,实验评估了层流是否以 PPARγ 依赖性方式增强了 CMECs 中 FUNDC1 基因的表达。ChIP 检测表明,PPARγ 与 CMECs 中的 FUNDC1 启动子区域相互作用(图3 B)。为了验证这一发现,用 PPARγ 特异性拮抗剂 GW9662 预处理 CMECs,并暴露于 20 dyne/cm2 的层流剪切力中持续6小时。在 GW9662 处理下,层流诱导的 LSS 增加了 CMECs PPARγ DNA-结合活性,抑制了流动诱导的 PPARγ 活性(图3 C)。此外,GW9662 显著减弱了 FUNDC1 的表达,但在静态条件下没有,表明 PPARγ 参与剪切力诱导的 FUNDC1 基因表达(图3 D)。此外,与久坐小鼠相比,运动的老年小鼠血管组织中的 PPARγ 表达和活性增强(图3 E、F)。这些数据表明,PPARγ 在 CMECs 中负责层流调控的 FUNDC1 表达。
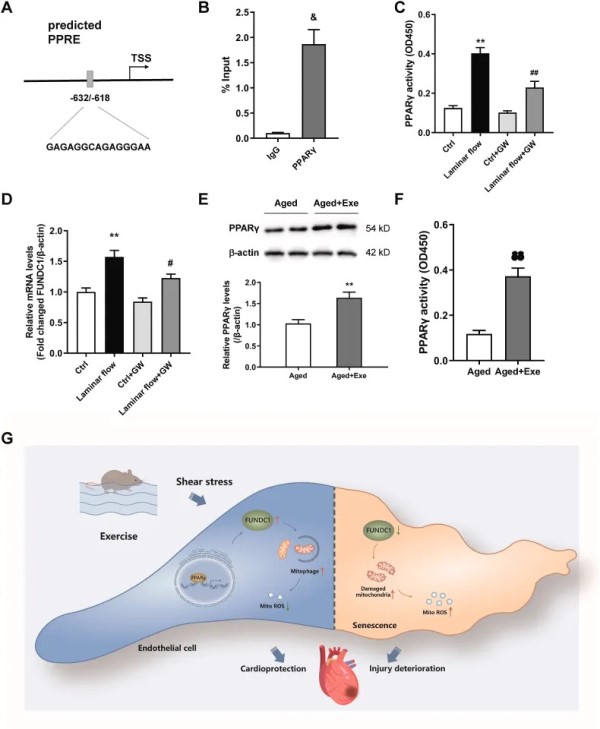
总之,该研究表明,上调的 FUNDC1 和恢复的线粒体自噬有助于减少衰老过程中运动诱导的内皮衰老和 MI/R 损伤,运动过程中 PPARγ 在调节 FUNDC1 表达中起重要作用。抑制 FUNDC1 本身会导致内皮衰老,并消除运动对内皮细胞和 MI/R 损伤的保护作用。鉴于这些发现,FUNDC1 可能是一个有希望的靶点,用于维持内皮线粒体稳态、防止内皮衰老,并可能通过血管内皮与心脏组织机制的“串扰”减少 MI/R 损伤(图3 G)。
参考文献:Ma L, Li K, Wei W, Zhou J, Li Z, Zhang T, Wangsun Y, Tian F, Dong Q, Zhang H, Xing W. Exercise protects aged mice against coronary endothelial senescence via FUNDC1-dependent mitophagy. Redox Biol. 2023 Jun;62:102693. doi: 10.1016/j.redox.2023.102693. Epub 2023 Apr 1. PMID: 37030149; PMCID: PMC10113862.
原文链接:https://pubmed.ncbi.nlm.nih.gov/37030149/
图片来源:所有图片均来源于参考文献
小编旨在分享、学习、交流生物科学等领域的研究进展。如有侵权或引文不当请联系小编修正。如有任何的想法以及建议,欢迎联系小编。感谢各位的浏览以及关注!进入官网www.naturethink.com或关注"Naturethink"公众号,了解更多相关内容。
点击了解:仿血流剪切应力仪
谷胱甘肽过氧化酶4(GPX4)是主要的脂质过氧化物清除剂,在铁死亡中起着关键的调节作用。据报道,由机械超负荷激活的 Piezo1 离子通道导致的钙内流增强诱导 GPX4-调控的铁死亡。已发现位于内质网膜(ER)的 Piezo1 的激活通过诱导ER的钙离子释放来增加细胞内游离钙。然而,机械超负荷是否会同时激活位于质膜和内质网膜上的 Piezo1 离子通道以升高 NP 细胞内游离 Ca2+ 的水平,从而导致 GPX4 调控的铁死亡仍有待确定。
硒蛋白K(SelK)是一种ER蛋白,已被证明与内质网应激和细胞抗氧化性有关。硒(Selenium)是一种必需的微量营养素,参与了抗氧化应激的保护。补充硒可以上调各种硒蛋白的表达,并且在滤泡辅助性T细胞中证明了 Selenium-GPX4 轴对铁死亡的保护作用。然而,目前还没有关于补硒是否可以通过上调 NP 细胞中的 SelK 和 GPX4 来减轻铁死亡的报道。
最近,在山东大学齐鲁医院骨科、病理科及美国布莱根妇女医院骨科的一项联合研究中,计划探索机械超负荷是否通过激活位于质膜和内质网膜上的 Piezo1 离子通道来阻碍 GPX4 的产生,从而导致 NP 细胞中的铁死亡。在上述过程中,研究员将确定促进 ER 应激的因素以及ER应激在铁死亡中的具体作用,此外,将验证补充硒是否可以通过上调 GPX4 和 SelK 来减轻机械超负荷诱导的 NP 细胞铁死亡。研究成果发表在 Cellular and Molecular Life Sciences 期刊题为“Selenium-SelK-GPX4 axis protects nucleus pulposus cells against mechanical overloading-induced ferroptosis and attenuates senescence of intervertebral disc”。

首先,实验评估了自然增龄和衰老条件下 FUNDC1 表达的变化。8周龄幼鼠冠状动脉组织中的 FUNDC1 蛋白水平随着年龄的增长逐渐降低。18 月龄的老年小鼠 FUNDC1 水平显著降低(图1 A、B),促衰老的炎症因子 IL-6 和 TNF-α 的 mRNA 水平显著增强(图1 C)。同样,在衰老的内皮细胞中也观察到 FUNDC1 的表达降低,IL-6 和 TNF-α 水平较高(图1 F)。
进一步构建 FUNDC1 内皮特异性敲除(Fundc1fl/Y/Tek-Cre)小鼠。ECs 中的 FUNDC1 缺失损害了 ACh 诱导的血管舒张,但不损害 SNP,表明 FUNDC1 负责维持冠状动脉中正常的内皮依赖性血管舒张功能(图1 G)。MI/R 之后,FUNDC1 基因敲除小鼠中积累的 Gr-1+ 中性粒细胞明显增加(图1 H),表明在 MI/R 损伤后中性粒细胞迁移和内皮通透性增加。eNOS 磷酸化和 VEGF 表达降低以及 ET-1 上调也表明 FUNDC1 敲除小鼠的内皮功能障碍(图1 I、J)。重要的是,EC 特异性 FUNDC1 敲除加重了 MI/R 后心脏收缩功能降低(图1 K)。这些数据表明,低 FUNDC1 表达导致冠状动脉功能障碍和 MI/R 损伤恶化。

图1 随着年龄的增长,FUNDC1水平降低。
接下来,为了阐明运动对年龄相关的 FUNDC1 下调和冠状动脉功能的影响,研究者对比了接受4 周规律运动和久坐不运动的老年小鼠。结果表明,FUNDC1 蛋白在运动小鼠的冠状动脉组织中显著上调,且 ACh 诱导的冠状动脉扩张显著增强,表明运动诱导的内皮依赖性血管舒张得到改善。在进行 MI/R 后,运动的老年小鼠的 Gr-1+ 中性粒细胞迁移减少,且炎症标志物(如IL-6、IL-8和TNF-α)和粘附分子(如VCAM-1、ICAM-1)等均显著降低,表明运动保护 MI/R 在衰老中诱发的微血管高通透性。此外,老年运动小鼠的 eNOS 磷酸化恢复,ET-1 水平降低,且缺血危险区的血管生成显著增加,左室收缩功能有所增强,也减轻了 MI/R 后的心脏损伤。这些数据表明,运动可防止随着年龄增长而下调的 FUNDC1 和冠状动脉功能障碍,并减少衰老心脏 MI/R 损伤的恶化。
为了检查运动对内皮衰老和功能的作用,对运动或久坐的老龄小鼠原代心脏微血管内皮细胞(CMECs)进行 SA-β-gal 染色。结果表明,老年小鼠 SA-β-gal 活性明显上升,而运动显著降低了这些水平,且逆转了衰老标志物 p21 和 p53 在老年 CMECs 中的水平。在老年小鼠 CMECs 中观察到相当高的衰老程度,但运动显著逆转了 CMECs 的衰老,改善了 CMECs 的血管生成能力。这表明,运动缓解了内皮衰老和功能障碍。
进一步地,实验探讨了线粒体损伤是否与衰老相关的内皮功能障碍有关。在老龄小鼠 CMECs 中观察到堆积的线粒体 ROS 和异常的线粒体膜电位,与久坐的小鼠相比,在运动老龄小鼠的 CMECs 中这些效应被减轻(图2 A、B)。老龄小鼠的 CMECs 在用 FCCP(一种线粒体自噬诱导剂)处理时表现出线粒体自噬受损。衰老导致整体红色 mt-Keima 荧光显著降低(图2 C、D),线粒体 LC3-II 水平降低,p62 水平升高,但这些效应通过运动逆转(图2 E、F)。重要的是,衰老 CMECs 中受损的线粒体自噬是被运动保留(图2 C-F)。老龄小鼠 CMECs 中线粒体自噬受体 FUNDC1 的水平也被证实较低,并且在运动老龄小鼠中恢复其表达(图2 G、H)。这些数据表明,运动减少了衰老 CMECs 的线粒体损伤并恢复了线粒体自噬。

图2 运动可减少衰老CMECs的线粒体损伤并恢复线粒体自噬。
为了验证 FUNDC1 在运动诱导的冠状动脉保护中的作用,实验对 Fundc1fl/Y 和 Fundc1fl/Y/Tek-Cre 小鼠进行为期4周的定期运动训练。结果发现,运动改善 Fundc1fl/Y 小鼠 MI/R 后内皮细胞屏障功能、增强血管新生,改善心脏功能。然后在内皮细胞中过表达 FUNDC1,观察到 FUNDC1 过表达显著降低了 CMECs 中 SA-β-gal 活性,表明过表达的线粒体自噬受体 FUNDC1 逆转了内皮细胞衰老。因此,FUNDC1 过表达改善了 EC 功能,如管形成、迁移和增殖能力。此外,与运动的保护作用一致,FUNDC1 过表达增强了 ACh 刺激的冠状动脉舒张、保护内皮屏障的完整性,恢复了老龄小鼠的 eNOS 磷酸化和 VEGF 表达,并降低了 ET-1 水平。重要的是,AAV-FUNDC1 治疗显著改善了 MI/R 后的心脏收缩功能。这说明,FUNDC1 过表达逆转了内皮衰老和功能障碍。
层流诱导的层流剪切应力(LSS)增加是运动诱导的内皮适应的重要机制。研究者利用层流装置来评估运动过程中 FUNDC1 基因表达的调控机制,并潜在鉴定启动 FUNDC1 转录的转录因子。生物信息学预测表明,FUNDC1 含有 PPARγ 反应元件 (PPRE)(图3 A)。先前的研究表明,层流激活了 ECs 中的 PPARγ。因此,实验评估了层流是否以 PPARγ 依赖性方式增强了 CMECs 中 FUNDC1 基因的表达。ChIP 检测表明,PPARγ 与 CMECs 中的 FUNDC1 启动子区域相互作用(图3 B)。为了验证这一发现,用 PPARγ 特异性拮抗剂 GW9662 预处理 CMECs,并暴露于 20 dyne/cm2 的层流剪切力中持续6小时。在 GW9662 处理下,层流诱导的 LSS 增加了 CMECs PPARγ DNA-结合活性,抑制了流动诱导的 PPARγ 活性(图3 C)。此外,GW9662 显著减弱了 FUNDC1 的表达,但在静态条件下没有,表明 PPARγ 参与剪切力诱导的 FUNDC1 基因表达(图3 D)。此外,与久坐小鼠相比,运动的老年小鼠血管组织中的 PPARγ 表达和活性增强(图3 E、F)。这些数据表明,PPARγ 在 CMECs 中负责层流调控的 FUNDC1 表达。

图3 CMECs中PPARγ与层流增强的FUNDC1基因表达有关。
总之,该研究表明,上调的 FUNDC1 和恢复的线粒体自噬有助于减少衰老过程中运动诱导的内皮衰老和 MI/R 损伤,运动过程中 PPARγ 在调节 FUNDC1 表达中起重要作用。抑制 FUNDC1 本身会导致内皮衰老,并消除运动对内皮细胞和 MI/R 损伤的保护作用。鉴于这些发现,FUNDC1 可能是一个有希望的靶点,用于维持内皮线粒体稳态、防止内皮衰老,并可能通过血管内皮与心脏组织机制的“串扰”减少 MI/R 损伤(图3 G)。
参考文献:Ma L, Li K, Wei W, Zhou J, Li Z, Zhang T, Wangsun Y, Tian F, Dong Q, Zhang H, Xing W. Exercise protects aged mice against coronary endothelial senescence via FUNDC1-dependent mitophagy. Redox Biol. 2023 Jun;62:102693. doi: 10.1016/j.redox.2023.102693. Epub 2023 Apr 1. PMID: 37030149; PMCID: PMC10113862.
原文链接:https://pubmed.ncbi.nlm.nih.gov/37030149/
图片来源:所有图片均来源于参考文献
小编旨在分享、学习、交流生物科学等领域的研究进展。如有侵权或引文不当请联系小编修正。如有任何的想法以及建议,欢迎联系小编。感谢各位的浏览以及关注!进入官网www.naturethink.com或关注"Naturethink"公众号,了解更多相关内容。
点击了解:仿血流剪切应力仪





