单细胞转录组学在揭示肺部微浸润性腺癌的分子特征与恶性潜能中的应用

影响因子17.52
研究背景
肺腺癌(LUAD)的发展被认为是从原位腺癌进展到微创腺癌(MIA),最终发展到完全浸润性腺癌(IA)的。由于MIA的惰性生长模式和良好预后,手术切除被认为是治疗MIA的首选。随着靶向治疗和免疫疗法的发展,使癌症死亡率进一步降低成为可能。然而,这些疗法对MIA的疗效尚不确定,目前它们不是治疗MIA的首选。这突显了解码MIA分子性质的紧迫性,为这些治疗提供合理的支持。
同时,有研究指出肿瘤细胞和肿瘤微环境(TME)的异质性在塑造肿瘤行为中起着至关重要的作用。因此,解码MIA中肿瘤细胞与TME之间复杂的相互作用对于更好地了解维持MIA惰性本质和促进肿瘤进展的机制至关重要。
研究目的
随着单细胞RNA测序(scRNA-seq)的出现,已有研究已经揭示了MIA和IA之间癌细胞和肿瘤微环境(TME)转录组的显著差异,但由于患者之间的巨大差异,研究结果仍然存在不一致。这种现象的主要原因在于LUAD的进展受到多种因素的影响,包括遗传和表观遗传特征、环境暴露、生活方式习惯、整体健康状况等等。因此,本研究旨在消除这些混淆变量,探索 MIA肿瘤细胞性质,揭示TEM在其中的影响,从而为MIA和LUAD的治疗发展提供新的生物学基础。
研究结果
1. 对MIA和IA的肿瘤和免疫生态系统的scRNA-seq分析
本研究收集了三名未经治疗的原发性LUAD患者的MIA和IA标本以及非肿瘤组织(N)和PBMC样本,用于scRNA-seq。通过Seurat进行细胞分类和标记基因鉴定,并用UMAP方法进行了可视化,研究者将这些组织中的细胞簇归类到了10个主要的已知细胞谱系中,包括单核细胞/巨噬细胞、自然杀伤(NK)细胞、T细胞、上皮细胞、内皮细胞、成纤维细胞、B细胞、树突状细胞(DC)、中性粒细胞和肥大细胞。从中发现,非免疫细胞的比例,主要包括上皮细胞粘附分子+ (EpCAM+)上皮细胞、内皮细胞和成纤维细胞,从N到MIA和IA样本逐渐增加。其中,MIA中的非免疫细胞主要是内皮细胞(76%),而在IA中,它们大多是恶性上皮细胞(97%)。而免疫细胞的比例,MIA和N中分布相当,主要包括单核细胞/巨噬细胞、NK细胞和T细胞。但在IA内部,单核细胞/巨噬细胞的比率超过了前者两个,而NK细胞的比率有所下降。此外,与前三种组织相比,PBMC显示出免疫细胞组成很独特,主要是由T细胞组成。
为了深入了解不同阶段LUAD之间的分子变异,研究还对N、MIA和IA组织之间的基因表达谱进行了比较。结果发现,MIA与N之间差异表达基因(DEG)的数量与IA与MIA之间以及IA与N之间DEG的数量相比显著减少。这表明MIA的基因表达谱更像N,而不是IA。此外,与N相比,在IA中上调的DEG主要存在于上皮细胞和内皮细胞中,而在MIA中上调的DEG主要存在于成纤维细胞中。以上结果表明,MIA和非肿瘤组织(N)具有相似的免疫生态系统,但与IA有着明显的区别。
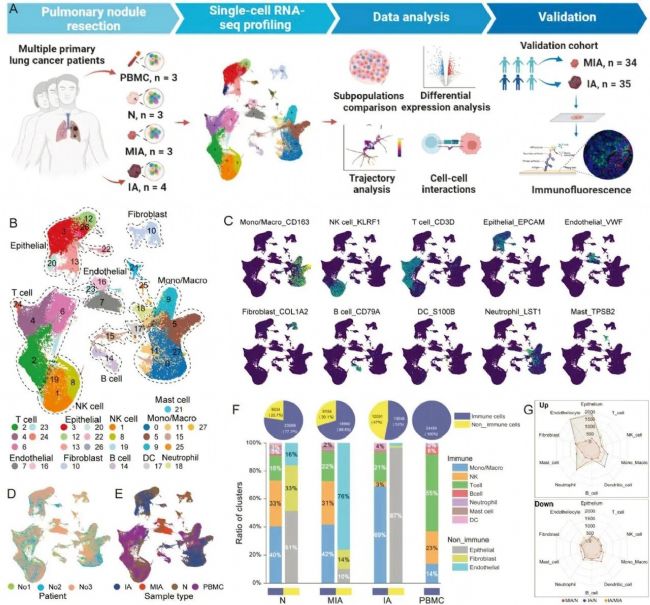
2. MIA恶性细胞的标志性特征的探索
接下来,研究者重点关注了N、MIA和IA组织中上皮细胞的转录组特征。通过比较它们的拷贝数变异(CNVs),可以发现MIA组织的CNV较低,表明MIA组织尚未完全表现出恶性特征。另外,又根据它们的主要标记基因将正常细胞簇分为5种不同的正常细胞类型:肺泡I型细胞(AT1)、Club/Clara细胞、肺泡II型细胞(AT2)、纤毛气道上皮细胞(Ciliated)和基底细胞(Basal)。从中可以发现,正常细胞簇在患者之间是共享的,而恶性细胞簇则随着患者的不同而变化,这突显了恶性细胞特有的跨患者异质性。同时也可看出,源于MIA的细胞的转录组特征与源于正常组织的细胞更相似,而和源于IA的细胞差别较大。MIA的恶性细胞数量相对有限,主要由两个细胞簇组成:乙醛脱氢酶3家族成员A1+(ALDH3A1+,C3)和补体C1q A链+(C1QA+,C15)细胞,这些细胞簇参与抗原处理和呈递。相比之下,在IA中没有出现主要的恶性细胞簇。此外,这些不同恶性细胞簇的生物过程和信号通路表现出显著的差异。
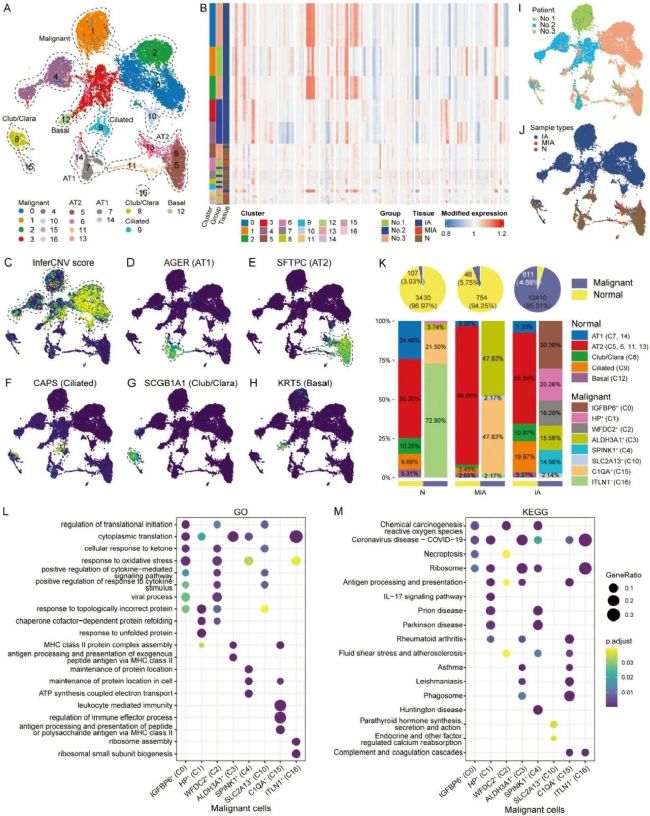
接下来,研究者利用Monocle3的分析发现恶性细胞可能来自AT1、AT2和基底细胞。这三种细胞类型虽然起源不同,但在恶性肿瘤的后期过程中却有着相似的演变路径。同时,从中也发现了一个介于基底细胞和恶性细胞之间的中间细胞状态,它仅由来自MIA的细胞组成。这个亚簇包括来自不同患者的细胞,因此可以排除潜在的跨患者异质性对演变路径的影响。根据它们的拟时序,这些上皮细胞被分为九个阶段,其中与MIA特异阶段相关(第2阶段)的独特标记物也通过 “‘FindAllMarkers”’函数被分析确定了,分别为水通道蛋白1(AQP1)和血管紧张素II受体类型2(AGTR2)。与IA和N相比,这些基因在MIA上皮细胞中的表达显著增加。通过调查AQP1和AGTR2在该研究scRNA-seq数据和一项公开的scRNA-seq数据中所有细胞类型的表达,可以发现几乎所有同时表达AQP1和AGTR2的细胞都属于上皮细胞。此外,这种高表达主要见于来自MIA样本的细胞。这说明,AQP1和AGTR2的组合能够有效地将MIA细胞与IA细胞区分开来。随后,研究者试图将这两个标记物应用于来自The Cancer Genome Atlas(TCGA)数据库的LUAD队列,以区分具有MIA特征的肺癌患者与其他患者。结果发现,这两个标记物成对共表达,并且其表达水平呈正相关。而且,高AQP1表达(AQP1+)和AGTR2表达(AGTR+)的患者比例在LUAD的T1阶段比晚期(T4)显著更高,这表明AQP1+AGTR2+的组合具有区分LUAD患者早期和晚期的高能力。此外,我们将T1阶段中高AQP1+AGTR2+表达的患者定义为具有MIA特征的患者,发现他们与其他阶段的患者相比具有更高的生存概率。研究者还用IF染色,测量了队列中EpCAM+细胞中AQP1+和AGTR2+细胞的比例,发现EPCAM+细胞中AQP1+、AGTR2+和AQP1+AGTR2+细胞的比例显著高于N和IA。以上结果表明,将AQP1和AGTR2的组合作为为MIA恶性细胞的标志特征,能够精确地区分MIA和IA。
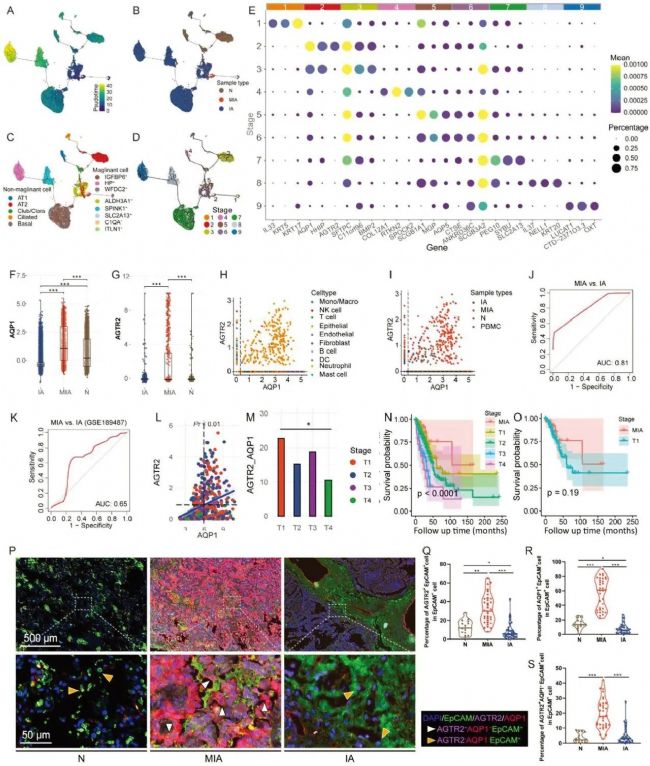
3. MIA 中被证实存在丰富的(GZMK)+ CD8+ T 细胞
研究者对T细胞进行了无监督聚类,确定了13个子簇,并发现它们在患者之间以及IA、MIA、N和PBMC样本内都是一致的。同时,结果表明,在MIA的癌前阶段,LUAD微环境中缺乏成熟和功能性的CD4+ T细胞。此外,PBMC显示出CD4+ T细胞亚群的不同组成,与前三种组织明显不同。MIA样本中CD8+ T细胞的比例与正常样本相当,而IA样本中CD8+ T细胞的比例低于MIA和正常样本。此外,IA样本中CD4+细胞毒性T细胞的比例也低于MIA和正常样本,表明MIA的微环境具有足够的细胞毒性,而IA的微环境的细胞毒性已经衰竭。为了进一步研究MIA和IA样本中CD8+ T细胞的转录特征,研究者又比较了正常、MIA和IA样本中CD8+细胞毒性T淋巴细胞(CTL)的基因表达。DEG分析显示,与MIA和正常相比,IA中的许多基因上调,而与IA和正常相比,MIA中只有少量基因上调。KEGG分析显示,MIA中的CD8+ CTL的特征是细胞毒性、P53和NF-κB信号通路的上调,表明这些细胞在MIA微环境中功能良好。
拟时序分析表明,CD8+ T细胞起源于幼稚CD8+ T细胞,共享相同的转变轨迹,但在PBMC、N、MIA和IA样本中处于不同的状态。PBMC中的CD8+ T细胞处于轨迹的开始,其次是来自MIA的一部分CD8+ T细胞和来自N的所有CD8+ T细胞。同时,IA中的CD8+ T细胞处于晚期状态,而MIA中的一些CD8+ T细胞处于轨迹的末端。细胞毒性和衰竭评分显示,过渡始于幼稚CD8+T细胞,然后通过以高细胞毒性和低耗竭为特征的中间状态,最后达到以高衰竭和低细胞毒性为特征的状态。另外,细胞毒性标志物GZMK的表达直到轨迹结束时才增加,这表明在MIA中存在一种特定的衰老CD8+T细胞亚群,其细胞毒性低但GZMK表达高(CytolowGZMK+),其比例明显高于N、IA和PBMC中的比例。研究者后续又使用干扰素,确认了组织中CD8+ T细胞中GZMK+细胞的比例,证实相较于N和IA,MIA中更高丰度的GZMK+ CD8+ T细胞亚群。以上结果表明,CD8+ T细胞的数量和细胞毒性能力随着LUAD的进展而降低,MIA中的CD8+ T细胞由功能性T细胞和功能失调的低细胞毒性GZMK+衰老亚群组成。
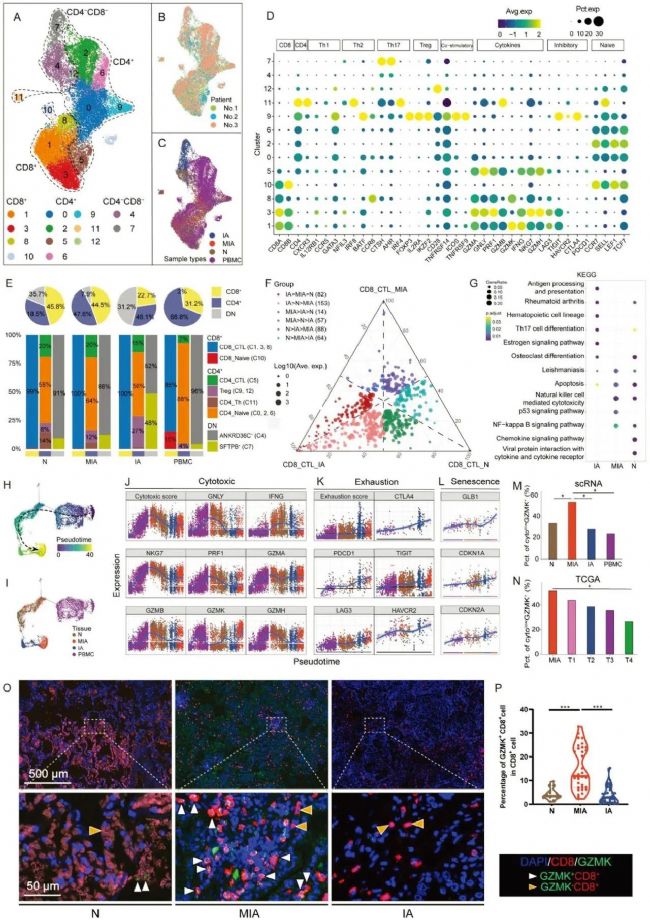
高表达的组织蛋白酶B(CTSB)+肿瘤相关巨噬细胞(TAM)是LUAD MIA阶段的早期应答者scRNA-seq数据表明,单核细胞/巨噬细胞是LUAD中最丰富的免疫细胞之一。伪时序分析显示,来自N、MIA和IA的单核细胞/巨噬细胞在早期和中期阶段遵循类似的转变轨迹,但来自N和IA的巨噬细胞的转变轨迹在晚期阶段出现分歧,而MIA的转变轨迹介于上述两者之间。这表明MIA巨噬细胞具有双重进化潜力。然后,GO分析进一步表明,MIA阶段成熟巨噬细胞的功能与N阶段相似,但与IA阶段不同。这表明N和MIA中成熟巨噬细胞之间的相似性比MIA和IA中成熟巨噬细胞之间的相似性更接近。
另外,研究确定了巨噬细胞中期的两种关键类型的TAM。其中一种TAM以分泌型磷蛋白1(SPP1)的高表达为特征,被称为SPP1+ TAM,而另一种以CTSB的高表达为特征,被称为CTSB+ TAM。GO分析表明,SPP1+TAM的功能主要集中在抗原呈递上,而CTSB+TAM主要参与激活细胞外信号调节激酶通路。IA 中 SPP1+ TAM 细胞的比例高于 N,但 MIA 中 SPP1+ TAM 细胞的比例并不高于 N。相比之下,IA 和 MIA 中 CTSB+ TAM 细胞的比例均显著高于 N,表明 CTSB+ TAM 细胞而非 SPP1+ TAM 细胞在 MIA 中起着至关重要的作用。经Gyorffy校正的719例LUAD患者的综合数据集显示,CTSB和SPP1的高表达水平与较差的生存率显著相关,突出了CTSB+和SPP1+ TAM在LUAD进展中的关键作用。后续进一步的免疫荧光实验,证实了MIA和IA中CTSB+ CD68+巨噬细胞亚群的高丰度,而在N中则没有。由此可知, MIA中CTSB+ TAM被激活,而SPP1+ TAM未被激活,这可能在LUAD早期进展中起关键作用。
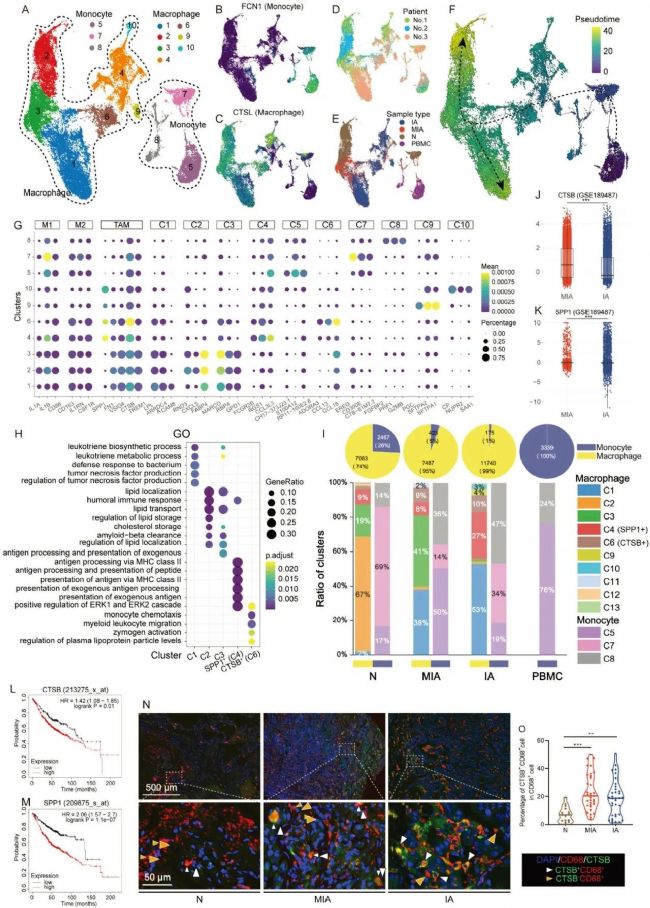
4. CTSB+ TAMs在MIA中表现出与CD8+细胞毒性T细胞的潜在相互作用
为了探究MIA中上皮细胞、T细胞亚群和TAM之间的特定细胞间相互作用,本研究采用了配体-受体相互作用工具CellChat推断信号通路。结果发现, CTSB+和SPP1+ TAM在IA和MIA中都有很强的相互作用。而与IA不同,在MIA中,CTSB+ TAM的相互作用强度强于SPP1+ TAM,表明CTSB+ TAM在MIA起着更关键的作用。上皮本身以及SPP1+ TAM与上皮之间的相互作用在IA中很强,但在N的所有细胞类型之间都很平衡。在CD8+ CTL内以及CTSB+ TAM与CD8+ CTL之间可以观察到SPP1+ TAM之间的强相互作用。
为了确认与CD8+CTL相关的特定信号变化,后续研究比较了CD8+CTL和其他细胞类型之间每对配体-受体之间的相互作用强度。我结果表明,主要组织相容性复合物I(MHC-I)在MIA中的相互作用强度明显强于IA和N。由CTSB+TAM和SPP1+TAM表达的MHC-I配体和受体在MIA中比IA和N中更丰富。基于以上结果可知,随着CTSB+TAM和CD8+CTL之间相互作用强度和相互作用频率的增加,MIA中CTSB+TAM的也会增加。因此,CTSB+TAM可能是MIA中CD8+CTL活化的原因。
研究总结
本文通过使用来自同步多原发LUAD患者的MIA和IA样本,提供了MIA和IA之间肿瘤生态系统联系和异质性的新证据。研究发现,与MIA和IA相比,PBMC内细胞群的亚型和数量存在显着差异。因此,使用PBMC样本在临床环境中评估LUAD的可行性仍需要进一步调查和评估。另外,研究确认了免疫和肿瘤表型的差异,包括细胞类型和比例、癌症细胞的独特特征、T细胞和巨噬细胞的发育轨迹,以及肿瘤和免疫细胞之间的串扰。MIA肿瘤细胞表现出AQP1和AGTR2的高表达以及基底样分子特征。同时,在MIA中,CTSB+ TAM可能会过度激活CD8+ T细胞,导致GZMK+衰老CD8+ T细胞富集,表明MIA的惰性外观下可能存在恶性进展。这些数据可以成为理论依据,加深对维持MIA惰性特征和促进肿瘤进展的机制的理解,并协助开发更有效的治疗靶点和策略,以治疗MIA患者。
原文链接
https://onlinelibrary.wiley.com/doi/10.1002/advs.202303753
关于临床样本的单细胞悬液制备
目前,随着单细胞RNA测序技术(scRNA-seq)在生物研究中的普及,其在各类临床样本中也得到了广泛的应用。本研究凭借该技术,完成了对通过对LUAD 中不同阶段组织样本的转录组分析,从而确认了该疾病中细胞类型和比例、癌症细胞的独特特征、T细胞和巨噬细胞的发育轨迹,以及肿瘤和免疫细胞之间的相互作用。为了能尽可能完整地保留这些临床样本中的信息,一套合适、完善的单细胞悬液制备方案必不可少。
伯豪生物为此研究中的scRNA-seq提供了技术服务。我们的技术团队凭借着大量的经验积累,不断创新样本存储和处理技术,自主研发了20余种样本保存、处理试剂。结合肺癌组织的样本特征和研究目标,我们优化了实验方案,成功协助研究团队完成了这项研究。
考虑到临床样本在获取后难以快速开展后续实验,如何合理地保存组织样本,保证细胞活性便成为最先需要关注的问题。同时,为了最大限度获取各类细胞的scRNA-seq数据,选择恰当的方式对样本进行解离也是其中的关键步骤。而由伯豪生物独立研究开发的伯优系列产品成功为克服这些困难提供了解决方案。
本次研究中,我们使用了伯优®单细胞测序组织保存液和伯优®组织样本悬液制备试剂。
伯优®单细胞测序组织保存液可用于人和动物的新鲜组织样本的低温存储和运输,4°C 条件下 72 小时内可保持细胞活性。保存后的组织样本可直接用于单细胞悬液制备,无需复苏等操作。经测试验证,经本产品保存的新鲜组织样本,制备成单细胞悬液后可用于目前主流单细胞测序平台,包括 10X Genomics 和 BD Rhapsody。
结果参考
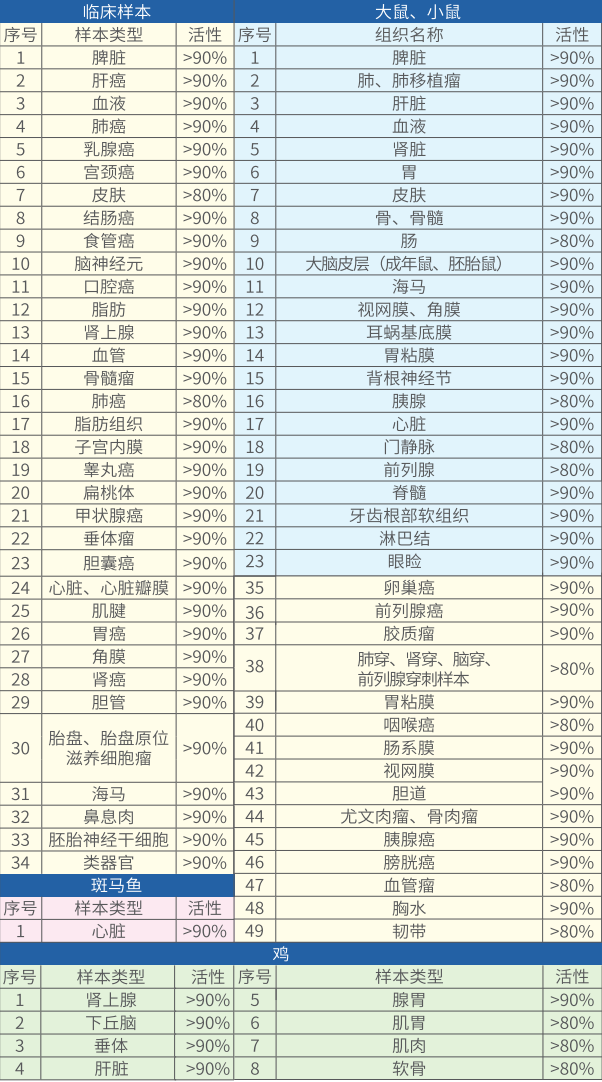

伯优®组织样本悬液制备试剂盒适用于人和常见模式动物的多种类型样本的单细胞悬液制备,通过预处理组织并进行酶解,组织 上的细胞会最大限度的被解离下来,经过过筛收集和离心等步骤,可高效获得目的样本的单细胞悬液。该试剂盒累计成功制备80余种组织类型的细胞悬液,细胞活力平均90%以上。
结果参考
产品列表






