FRAP 系统在脂质立方相(LCP)结晶条件的高通量筛选中的应用
无论用户使用的是可溶性蛋白还是膜蛋白,都需要筛选和优化众多结晶条件,以找到合适的结晶条件。在脂质立方相 (LCP) 中成功结晶的主要因素之一是蛋白质在脂质双层内扩散的能力。蛋白质的扩散速率受蛋白质聚集、LCP 的结构特性和化学环境的影响。扩散速率可以通过光漂白后的荧光恢复 (FRAP) 来确定,它测量标记蛋白的荧光强度在经过光漂白的 LCP 液滴中的一小块区域内重新恢复所需的时间量(图1)。用户可以绘制和分析归一化荧光强度与时间的曲线,以量化两个与蛋白扩散相关的特性:迁移率(强度曲线渐近接近的值)和扩散速率(与曲线起点处的斜率成比例) 。
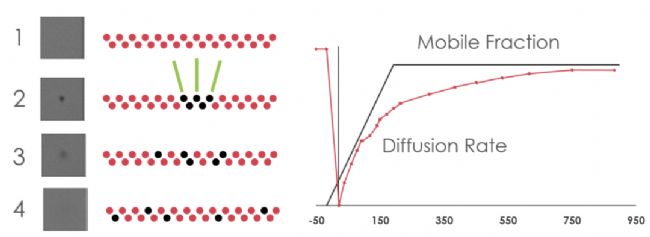
图 1. 1) 以预漂白样品图像作为基线荧光强度;2) 样品通过一个小的(~15 微米直径)激光光斑进行光漂白。3) 随着漂白分子向外扩散和新分子向内扩散,监测该漂白点内的荧光强度。
自动化 LCP-FRAP 仪器最初由斯克里普斯研究所开发,现在由 FORMULATRIX® 生产,极大地加快了LCP 板的筛选过程。用户使用 FRAP 进行筛选,无需等待数天到数周来确定晶体是否已形成, FRAP 给予了使用者即时观察,以此判断条件是否最适合结晶,同时排除那些由于扩散速率不高而不会形成结晶的条件。虽然整个 FRAP 过程仍然相对缓慢,每个蛋白液滴需要花 15-20 分钟才能完成,但这样需要的蛋白质量相对较少。一种能够避免每个 LCP-FRAP 样本的数据采集时间过长的方法便是仅收集终态荧光强度。
FRAP 系统通过使用这种三点数据收集方法(图 2),可以依次漂白所有 96 个孔,然后返回收集荧光恢复图像。虽然这种方法只能恢复样本的迁移率,但研究人员仍然能够仅依靠迁移率分析来识别潜在的结晶样本。
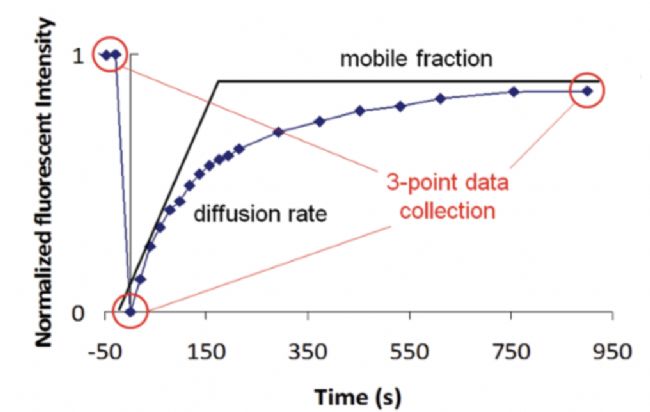
图 2. 高通量 FRAP 方法仅用于收集最终状态荧光强度以确定样本迁移率结果。
利用图 3 所示的工作流程,FORMULATRIX 的 RockImager-FRAP 可以在 50 分钟内完成 96 孔 FRAP 数据采集。
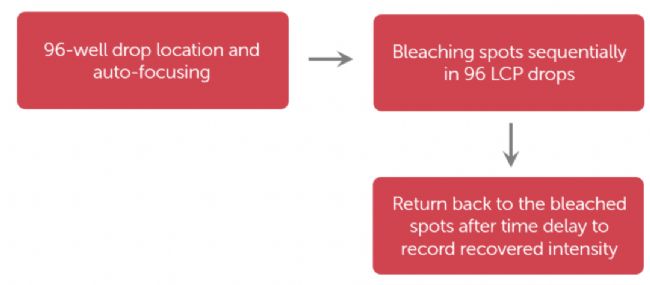
图 3. 高通量 LCP-FRAP 数据采集流程图
整块结晶板的 FRAP 迁移率数据可以分组到具有颜色编码背景的画布视图中,以便用户快速识别结晶孔(图 4)。然后,研究人员可以与软件进行交互,将孔标记为结晶或非结晶。在大多数情况下,仅迁移恢复数据就足以让研究人员识别潜在的结晶生成条件。尽管如此,人们可能仍希望生成完整的恢复曲线来检查曲线形状并确定扩散速率。为避免通过完全恢复运行所有 96 个样本,此过程仅适用于用户在三点高通量 FRAP 分析期间指定的那些潜在结晶生成孔。
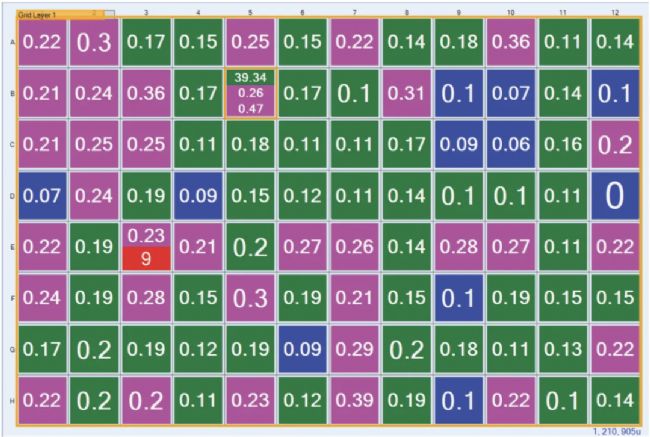
图 4. 收集的 FRAP 迁移率数据显示在画布视图中,颜色编码用于快速识别有无结晶生成可能。
可以绘制完整的强度恢复曲线并用贝塞尔函数拟合以得出扩散速率和恢复时间。在大多数情况下,单个 Bessel 函数足以实现低残差拟合结果。在其余的大多数情况下,两种不同类型的分子同时扩散。这通常是因为蛋白质没有被充分纯化,而脂质和蛋白质分子都被荧光染料标记。较小分子量的脂质比大蛋白质分子扩散得快得多。在这种情况下,必须使用双分量 Bessel 函数拟合来准确模拟两种不同的扩散速率。





