Sapphire激光扫描成像在Cas13激活新机制可优化腺相关病毒治疗中应用
CRISPR-Cas系统由于具有高度可编程性和灵活性,被广泛应用于体内RNA敲降和转录调控。然而,Cas13效应物的大尺寸及在激活后的非特异性RNA切割,限制了Cas13系统基于腺相关病毒的的治疗应用。
近日,美国莱斯大学在Nature Communication上发表了题为Structural basis for the activation of a compact CRISPR-Cas13 nuclease的研究文章,报告了一种适合腺相关病毒传递的紧凑型Cas13 (Cas13bt3)的详细生化和结构特征,并对其体内工程化应用进行了有效探索。

1 Cas13bt3活性的生化表征
基于体外RNA切割凝胶试验(Sapphire FL激光扫描成像系统拍摄),作者首先设计了一个带有30 nt间隔的crRNA,用于检测Cas13bt3对target RNA和非特异性RNA的活性。Cas13bt3在缺乏crRNA的情况下无活性,而crRNA结合激活Cas13bt3可有效切割122nt的target RNA(T0)(图1b)。有趣的是,与常规的cas13表现不同,激活的Cas13bt3复合物(Cas13bt3复合物+crRNA+完全匹配的target RNA(T1))的旁支切割(collateral cleavage)活性很低,其表现为针对poly-U reporter RNA的外切酶切割模式 (U20,图1c, f) 。
另一方面,激活的Cas13bt3有效地切割了一个36 nt的ssRNA (ssRNA36),可能围绕着ssRNA36中存在的“UUC”序列(补充图1a, b)。作者随后设计了一系列短的10 nt ssRNA reporter,每个reporter具有一个核苷酸变异(R1-5,图1f)。在电泳和荧光分析实验(基于Sapphire FL激光扫描成像系统)中,Cas13bt3可在“UUC”位点有效切割R1底物 (图1d, e, f,补充图1c),但不能切割poly-A10、poly-C10和poly-G10,且U10表现出与poly-U20 reporter RNA相同的低外切酶活性(图1c,补充图1d)。
可见,仅具有UC基序的底物才能被激活的Cas13bt3有效切割(图1g)。
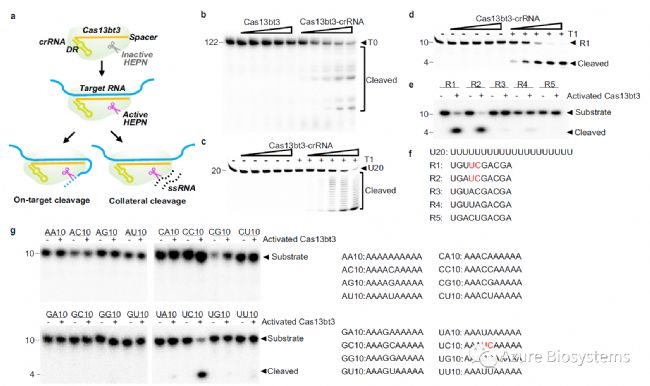
图1. Cas13bt3切割的生化表征。a. Cas13bt3靶切及旁支切割活性图。b. 有无crRNA时,Cas13bt3(12.5 ~ 200 nM)靶向切割122nt target RNA (T0)。c, d. 12.5-200 nM活化Cas13bt3复合物旁支切割U20底物(c)和R1底物(d)。e激活的Cas13bt3(50 nM)旁支切割不同序列Reporter RNA (R1-R5)。f. 旁支切割实验使用的Reporter RNA序列。g. 激活的Cas13bt3(50 nM)旁支切割16种可能组合的Reporter RNA。
Cas13bt3激活对target长度有依赖。将target长度从30nt逐渐降至21nt后,旁支切割活性随之逐渐降至6%,30nt左右长度的target才能完全激活Cas13bt3。此前报道的Cas13bt3结构可能只是活化的中间态 (Cas13bt3Int,target长度20nt) 。
2 活化Cas13bt3的冷冻电镜结构
冷冻电镜下,Cas13bt3Act(真正激活态的Cas13bt3-crRNA-hpRNA三元复合物,target长度30nt,见图2d)显示为二裂片结构,REC lobe和NUC lobe分别位于spacer/target dsRNA两端,由两个IDL(结构域间连接物)连接。REC lobe位于target 5’端,由Helical1、 Helical2及Lid 构成,用于识别DR (图2f,补充图s) 。NUC lobe由HEPN1和HEPN2结构域组成,位于spacer/target dsRNA远端。与Cas13bt3-crRNA 二元复合物(Cas13bt3Bin)和Cas13bt3Int相比,REC lobe和NUC lobe发生很大的构象变化。REC lobe对齐后,Cas13bt3Act中NUC lobe的质量中心相比于前两者,分别移动了~40 Å和20 Å,旋转了34度和19度。HEPN结构域发生显著的刚性运动,IDL1和IDL2的构象也发生了剧烈的变化 (图3e, f) 。
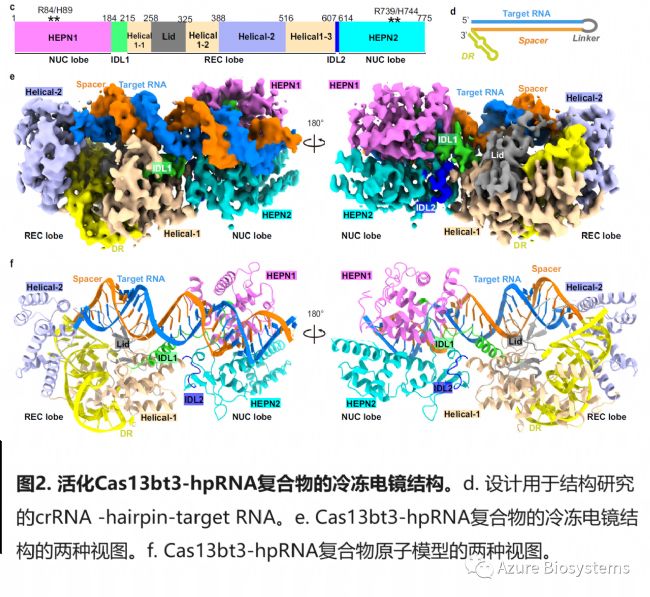
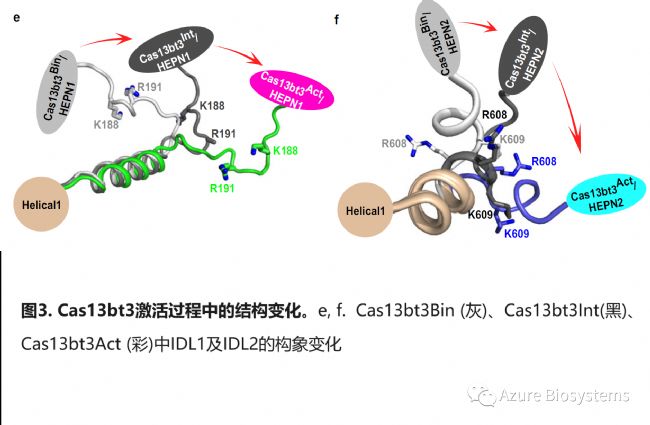
3 spacer/target dsRNA识别的分子基础
在Cas13bt3Act中,直接的蛋白质- RNA接触(距离< 3.5 Å)是分散的。在target的5′端,来自Helical1的一个环与间隔链接触,两个带正电的残基K243和K245在10-11位与间隔链相互作用(图4b)。在target的3‘端,两个HEPN结构域形成一个裂缝,用于dsRNA结合(图4a)。HEPN1的残基K54、K57、R179、K180、R155和R156和HEPN2的残基R681靠近RNA主干(图4d) 。此外,Cas13bt3Act中完全拉伸的IDL1与位置11-20附近的spacer/target dsRNA相互作用(图4c) 。残基K188、R191、R204、D205和T193的主干位于spacer/target dsRNA的主槽附近(图4c) 。
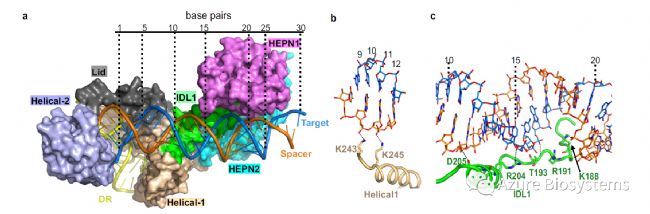
图4. Cas13bt3与dsRNA的相互作用。Cas13bt3中的spacer/target dsRNA结合界面。dsRNA 从target RNA 5′-端到3′-端进行编号。b,c. 放大的Helical1环结构域作用视图(b), IDL1 (c), HEPN
生化实验与cas13bt3诱导的RNA敲降实验均显示,Cas13bt3对target RNA具有一定的错配耐受性。
4 Cas13bt3活化的结构基础及工程应用
作者在活性位点周围发现了两个带正电荷的patch(patch1和patch2),其在长链target RNA结合时经历了构象转变(图5a, b),可能与HEPN的激活有关。Patch1中K194E、R608E/K609E和K645E的突变几乎消除了HEPN的切割(图5c) 。Patch2的R719残基突变可使活性降低94%(图5c) , K748E突变使切割率降低50%(图5c) 。
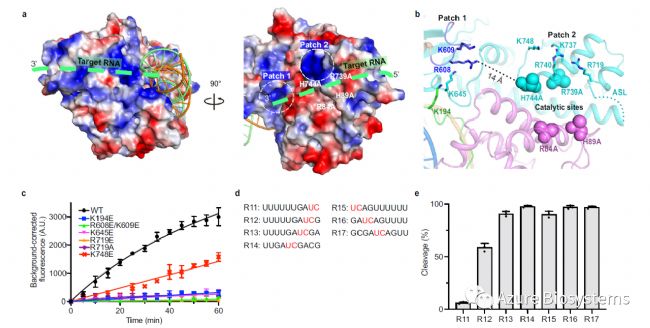
图5. Cas13bt3的底物结合面。a. Cas13bt3带电电位面的两种视图。target RNA的可能路径用绿色虚线表示。b. 核酸酶活性位点周围的Patch1和Patch2的放大图。c. WT和突变Cas13bt3在Patch1和Patch2上的旁支切割活性。
为了在体内进行转录调控和RNA敲降,需要一个既能有效切割target RNA、又能保持最小非特异性切割的Cas13系统,以减少靶细胞的转录组损耗。为此,作者在IDL和带正电的patch上测试了一系列突变,并进行体外切割凝胶试验(补充图9e-h,Sapphire FL激光扫描成像系统拍摄)。结果表明,活性位点附近的带正电荷的patch可能更有助于非特异性RNA结合,从而导致旁支切割。
随机诱变筛选显示,干扰带正电patch附近的疏水相互作用可能会影响局部折叠和RNA结合。作者在K645附近找到两个疏水簇,分别在Y643和 Y647附近(图6a) 。突变后的Y643A几乎消除了这两种切割活性,而Y647A显著降低旁支切割活性至4%(Y647A蛋白浓度高达800nM时为10%)(图6c),但仍保持70%的靶标切割活性 (图6b,补充图9e, f)。也同时进一步验证了Patch 1对Cas13bt3激活的关键作用。
最后,为评估结构突变体(Y643A或Y647A)在哺乳动物细胞中的collateral effect,进行流式细胞术实验。结果证实(图6e, f),合理设计的Cas13bt3 Y647A具有最小的collateral effect,同时保持强大的靶标切割活性,是一种有前途的体内RNA编辑工具和进一步的治疗应用。
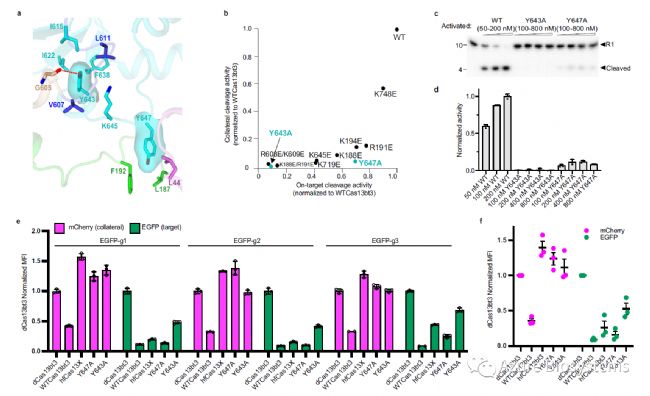
图6. Cas13bt3的高保真切割工程。a. 残基K645周围的两个疏水簇。b. 突变Cas13bt3归一化的靶切和旁支切割活性。c. 不同蛋白浓度下WTCas13bt3、Y643A、Y647A旁支切割的代表性凝胶图。d. 切割活性归一化,如(c)所示。e. HEK293T细胞中Cas13bt3突变体的靶切及旁支切割。f. e中Cas13bt3突变体相对切割效率的统计数据分析。归一化MFI为相对于dCas13bt3条件的平均荧光强度。
总之,作者通过对Cas13bt3的结构和生化表征研究,揭示了其独特的靶RNA识别和激活机制,或有助于指导最近发现的大量结构域相似的新Cas13的研究。作者成功构建了工程化变体,对指导Cas13bt3的体内应用具有重要意义。
原文链接:https://www.nature.com/articles/s41467-023-41501-5






