KLF4和AMPK在内皮细胞脉冲剪切应力抑制糖酵解中的作用
内皮细胞排列在动脉壁的管腔表面,并与血流直接接触。动脉直段部分的脉动剪切应力 (PS) 会维持内皮稳态,而分岔和弯曲处的振荡剪切应力 (OS) 会损害内皮功能。这种 OS 诱导的内皮细胞 (EC) 功能障碍的特征是糖酵解、炎症、增殖和活性氧 (ROS) 的产生增强。总的来说,这些 EC 表型变化会导致动脉粥样硬化。
作为葡萄糖分解代谢的唯一途径,糖酵解是内皮细胞的主要能量来源。EC 中增加的糖酵解满足了 EC 迁移和增殖所需的葡萄糖消耗需求。然而,内皮细胞中过度的糖酵解与肿瘤血管生成、糖尿病性视网膜病变和动脉粥样硬化等疾病状态有关。
越来越多的证据表明,剪切应力通过流动模式调节 EC 中的糖酵解。有研究表明,OS 通过稳定 ROS 介导的低氧诱导因1α (HIF-1α) 来增加内皮糖酵解,从而增加EC 增殖和炎症。虽然这些报告指出 OS 下糖酵解的增加,但内皮细胞中糖酵解对不同流动模式的调节机制的系统研究仍不明确。
Krüppel 样因子4 (KLF4) 和 AMP 活化蛋白激酶 (AMPK) 是参与 ECs 机械转导机制的两个主要分子。在 ECs 中,KLF4 是内皮谱系必不可少的家族依赖型转录因子(TF),也是PS 诱导的信号依赖型TF。在 PS 作用下,KLF4 转录上调许多动脉粥样硬化保护基因。
作为一种代谢指标,AMPK 通过增加分解代谢途径和减少合成代谢途径来全局调节细胞代谢。AMPK 的激活可降低糖酵解的能量消耗,同时促进线粒体氧化代谢以恢复能量稳态。许多 AMPK 底物蛋白,例如 eNOS 和血管收缩素转化酶2,对内皮稳态至关重要。
己糖激酶 (HK1) 是糖酵解途径中的限速酶之一,HK IV,也称为葡萄糖激酶 (GK),在 ECs 中大量表达。糖酵解通过葡萄糖激酶调节蛋白 (GCKR) 与 HK1 的结合受到抑制,从而将 HK1 隔离在细胞核中。糖酵解速率受GCKR水平和GCKR/HK1结合状态的影响,这是动态的、复杂的调节,并可在代谢条件下迅速改变。因此,GCKR 的表达及其翻译后修饰是糖酵解中必不可少的调节机制。
鉴于缺乏关于剪切应力如何通过 GCKR 调节 EC 糖酵解的信息,来自上海交通大学机械生物学与医学工程研究所、美国加州大学圣地亚哥分校医学系、香港中文大学生命与健康科学学院等机构的专家学者启动了这项研究,于 Proceedings of the National Academy of Sciences of the United States of America发表了题为《Roles of KLF4 and AMPK in the inhibition of glycolysis by pulsatile shear stress in endothelial cells》的实验成果,以探讨 KLF4 和 AMPK 通过 GCKR 调控 EC 糖酵解的作用。
实验结果:
PS在系统水平下调ECs 中的糖酵解
首先通过分析来自人脐静脉内皮细胞(HUVECs)在 PS (12 ± 4 dyn/cm2 ) 和 OS (1 ± 4 dyn/cm2 ) 作用0至24小时的RNA-seq数据,评估了糖酵解途径中相关基因响应PS 与OS 的动态表达变化。通路分析表明,与 OS 相比,PS从16 h开始就普遍下调糖酵解过程中的酶(图1 A)。这些结果证实 PS 和 OS 对ECs糖酵解的调控方向相反。RNA测序发现,通过qPCR证实了PS会抑制糖酵解酶(图1 B)。
因为表观遗传调控是 ECs 响应剪切应力的机械转导的组成部分,实验接下来研究了PS下调糖酵解基因是否与染色质重塑有关。因此,实验确定了在人类糖酵解基因的转录起始位点两侧的转座酶可接近性染色质测序 (ATAC-seq) 峰(测量去浓缩的染色质结构)的富集。这些糖酵解基因的启动子区域在OS 和PS下表现出ATAC峰的富集(图1 C)。
总之,这些结果表明,糖酵解基因的 PS 抑制发生在表观遗传和转录水平。

图 1
KLF4 响应 PS 调节 GCKR 表达
除了测试 PS 下调基因外,实验还检测了参与糖酵解的 PS 上调的基因。PS在24小时内显著诱导GCKR转录 (图2 A),并通过qPCR验证(图2 B)。接下来检查了 PS 对 GCKR 启动子区域中 H3K27ac 富集的影响。PS富集了H3K27ac信号(图2 C),表明在PS下GCKR启动子具有比OS更加去浓缩的染色质结构。
接下来,实验探讨了 PS 诱导的 GCKR 是否由 KLF4 表观遗传和转录介导。根据 GSE103672 数据集,在可能与 GCKR 启动子结合的转录因子中,PS 最大程度地诱导了 KLF4 mRNA(图2 D)。与在GCKR启动子中所预测的两个假定的KLF4结合位点一致(图2 C),RNA-seq数据表明,过表达KLF4的ECs诱导GCKR。(图2 E)。
为了验证图2 A-E 中的结果,在 ECs 中过表达 KLF4,模仿 KLF4 的 PS 诱导。通过KLF4染色质免疫沉淀( ChIP)-PCR、qPCR和蛋白质印迹检测,KLF4过表达增加了KLF4与GCKR启动子的结合和GCKR的表达(图2 F-H)。
在 ECs KLF4 敲低的相互实验中,PS对GCKR的诱导作用在mRNA和蛋白水平上减弱(图2 I、J)。与这些结果一致,PS 增加了 KLF4 与 GCKR 启动子的结合并增强了 GCKR 的表达(图2 B、K、L)。
小鼠胸主动脉 (TA) 和主动脉弓 (AA) 处于动脉粥样硬化保护与动脉粥样硬化流动模式下。体内验证结果发现,从 TA 分离的内膜中 GCKR mRNA 水平高于 AA(图2 M)。总之,图2 中的结果表明,PS 诱导的 GCKR 取决于 KLF4 介导的表观遗传和转录调控。
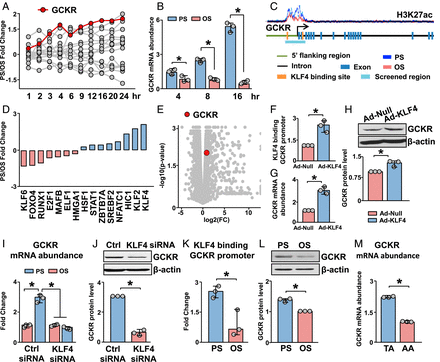
图 2
AMPK 磷酸化并调节 GCKR
为了确定 PS 诱导的 GCKR 是否也涉及蛋白质磷酸化,实验使用生物信息学方法来确定磷酸化位点和磷酸化GCKR 的相应激酶。
总体而言,结果表明 PS 增加了 GCKR Ser-481 的 AMPK 磷酸化,这反过来增强了 GCKR-HK1 的相互作用,以减弱 ECs 中的 HK1 活性。
KLF4-AMPK/GCKR 抑制高水平自主跑步的小鼠的糖酵解
实验使用来自选择性繁殖的小鼠模型的成年雄性小鼠,它们具有高水平的自愿轮跑能力,以证实 KLF4-AMPK/GCKR在体内抑制内皮细胞糖酵解的发现。
总体而言,数据表明,有氧运动可能有益于血管内皮细胞的能量利用,并且这种有益结果是由 GCKR 表达和活性增加所介导的。支撑机制应该包括 KLF4 和 AMPK 分别在转录和翻译后水平上的调控。
实验结论:
这项实验确定了血流调节血管内皮糖酵解的机械转导机制。实验证明了在体内和体外内皮细胞中,动脉粥样硬化保护流模式可以减少糖酵解,这是一种需要能量的代谢过程。与其他糖酵解基因的下调相反,GCKR 是糖酵解通量的抑制剂,通过动脉粥样硬化保护流上调。
作为由动脉粥样硬化保护流诱导的先驱转录因子,KLF4 表观遗传重塑 GCKR 启动子,从而激活 GCKR。在翻译后水平,动脉粥样硬化保护血流激活 AMPK 磷酸化 GCKR,从而增加 GCKR 与己糖激酶(糖酵解的关键酶)的结合。
鉴于糖酵解是利用葡萄糖支持EC代谢的重要途径,本研究中新定义的这一机制可能与其他代谢途径协同作用,以维持内皮细胞的功能。
参考文献:Han Y, He M, Marin T, Shen H, Wang WT, Lee TY, Hong HC, Jiang ZL, Garland T Jr, Shyy JY, Gongol B, Chien S. Roles of KLF4 and AMPK in the inhibition of glycolysis by pulsatile shear stress in endothelial cells. Proc Natl Acad Sci U S A. 2021 May 25;118(21):e2103982118. doi: 10.1073/pnas.2103982118. PMID: 34001623; PMCID: PMC8166073.
文章来源:http://www.naturethink.com/?news/126.html
小编旨在分享、学习、交流生物科学等领域的研究进展。如有侵权或引文不当请联系小编修正。微信搜索公众号“Naturethink”,学习更多关于流体机械力学刺激细胞培养相关知识吧!





