Eppendorf S41i CO2恒温摇床在间充质干细胞扩增上的应用
作者:Khandaker Siddiquee and Ma Sha, Eppendorf Inc., Enfield, CT, U.S.A
摘要
使用装载微载体的小型生物反应器如旋转培养瓶,扩增培养干细胞(包括间充质干细胞)被证明是成功的。而在本研究中我们使用了传统锥形瓶,为采用微载体进行间充质干细胞扩增开发了一种简单的替代方法。这种方法需要一台新型的内置摇床功能的 CO2 培养箱,例如 Eppendorf New BrunswickTM S41i CO2 培养箱。利用装载微载体的锥形瓶摇瓶和旋转培养瓶来对比脂肪间充质干细胞(ADMSCs)的扩增效果。两个对照实验都使用含有 0.5g 微载体的干细胞培养液 40 mL,ADMSCs 接种密度都为 3×103 个细胞 /cm2。
细胞培养周期为 12 天,每日进行采样分析细胞生长状态、生物化学和代谢产物指标进行对比。细胞密度比较结果表明,脂肪间充质干细胞培养在对数生长期(4 天)和平台期(9 天)中, 在锥形瓶条件下扩增比在旋转培养瓶条件下细胞数量高 1.6-1.8倍。日常代谢产物分析显示,培养早期旋转培养瓶中氨水平较高,但锥形瓶中没有此现象,这可能是由于搅拌子产生的剪切力造成的干细胞损伤所引起的。
细胞培养周期为 12 天,每日进行采样分析细胞生长状态、生物化学和代谢产物指标进行对比。细胞密度比较结果表明,脂肪间充质干细胞培养在对数生长期(4 天)和平台期(9 天)中, 在锥形瓶条件下扩增比在旋转培养瓶条件下细胞数量高 1.6-1.8倍。日常代谢产物分析显示,培养早期旋转培养瓶中氨水平较高,但锥形瓶中没有此现象,这可能是由于搅拌子产生的剪切力造成的干细胞损伤所引起的。
最后,通过 CD44 和 CD90 干细胞标记分析,间充质干细胞具有分化成脂肪细胞或骨细胞的能力,这证实了使用锥形瓶扩增的脂肪间充质干细胞具有较高的质量。
综述
干细胞由于具有自我更新能力并能分裂很长一段时间,从而被视作未分化细胞。当提供合适的生长因子及条件时,干细胞具有分化成不同的特化细胞的能力。干细胞可大致分为:胚胎干细胞、成体干细胞和诱导多功能干细胞(iPS)。成体干细胞可进一步通过它们的组织来源特征性表达,比如:造血干细胞、乳腺干细胞、肠干细胞、间充质干细胞、内皮干细胞、神经干细胞和毛囊干细胞。大部分成体干细胞研究使用的是造血干细胞或者脂肪来源的间充质干细胞 1。像其他的成体干细胞一样, 脂肪间充质干细胞(AdMSCs)可显示所有干细胞常规标志物, 并能在合适的生长条件下分化成不同类型的特化细胞。与其他间充质干细胞相比,脂肪间充质干细胞由于可从脂肪组织中大量分离并对凋亡耐受所以更具优势 2。
尽管间充质干细胞在药物更新、药物筛选以及药物研发中具有诸多优势,但其应用受到工业或临床运用所需数量的限制 3。在本研究中,我们开发了一种简单的锥形瓶培养技术来扩增基于微载体的间充质干细胞培养,从而可将培养规模放大至更大的生物反应器。装载微载体的锥形瓶需同时控制搅拌速度和 CO2 浓度,我们可利用 Eppendorf New BrunswickTM S41i CO2 恒温摇床进行培养实验。

Eppendorf New BrunswickTM S41i CO2 恒温摇床,为悬浮细胞及贴壁细胞的培养而设计,配备可靠的 New Brunswick 摇床驱动轴,并可精确控制温度和CO2 浓度。先进特性包括带密封圈的内 / 外门、高温消毒功能以及与同类产品相比 CO2 气体消耗量较少 4。
材料和方法
在细胞培养瓶中进行的最初培养
脂肪来源的间充质干细胞来源于 ATCC(PCS-500-011)第二代细胞,以 5000 个细胞 /cm2 接种于 Eppendorf T-75 cm2 细胞培养瓶中,使用 15 mL 添加有 2% 胎牛血清、5 ng/mL 重组人碱性成纤维细胞生长因子、5 ng/mL 重组人酸性成纤维细胞生长因子、5 ng/mL 重组人上表皮生长因子和 2.4 mM L- 丙氨酰 - L 谷氨酰胺的间充质干细胞基础培养基(ATCC)。
在实验开始之前, 将 0.5g 125-212 微米聚苯乙烯微载体(SoloHill®)(180 cm2 适用于 50 mL 的培养)转移到经过硅化处理((Sigmacoat®,Sigma) 的250 mL 旋转培养瓶(Corning®) 以及含有 25-30 mL PBS 的锥形瓶中(Schott®, Duran)。随后,所有培养瓶在 121 °C 下至少高温灭菌 30 分钟。微载体可放置在培养瓶或锥形瓶的底部,使用装有 25 mL 或 50 mL 移液管的 Easypet®(Eppendorf)电动助吸器小心注入经高温灭菌的 PBS 缓冲液。脂肪来源的间充质干细胞最初以 3000 个细胞 /cm2 的密度接种于两种培养瓶中,每个均装载 40 mL 间充质干细胞基础培养基。
为了培养初期的细胞贴壁,Eppendorf New BrunswickTM S41i CO2 恒温摇床以及旋转培养瓶( 安置于 Eppendorf Galaxy® 170 R CO2 培养箱内部)的搅拌转速皆维持在 50 rpm,在 37 °C、5%CO2 浓度条件下培养 2 小时。之后,细胞培养体积最终被调节至 50 mL,其中 10 mL 的培养基中含有血清,从而使得最终的胎牛血清浓度达到 4%,并使生长添加物的最终浓度达到目标(重组人碱性成纤维细胞生长因子、重组人碱性成纤维细胞生长因子和重组人上表皮生长因子的最终浓度达 10 ng/ml、L- 丙氨酰 -L 谷氨酰胺的最终浓度达 4.8 mM)。在添加 FBS 和生长添加物之后,旋转培养瓶和 New BrunswickTM S41i CO2 恒温摇床搅拌转速都增至 70 rpm。接种 18 小时至24 小时之后,取 1 mL 包含有培养基和微载体的均匀样品用于显微镜观察、细胞计数和生化分析。
细胞计数
通过血球计数板计算微载体上的细胞。为了完成计数,从试管中移取上清液与含结晶紫的柠檬酸溶液(0.1 M 柠檬酸溶液中添加 0.1 % 结晶紫)等体积混合。试管中的内容物在 37 °C下培养 1 个小时或过夜,涡旋几秒钟以释放被染色的细胞核。使用血球计数板对细胞核计数。
生化以及代谢分析
细胞计数收集的上清液被用于生化以及代谢测量,使用 YSI 2950 自动生化分析仪。
干细胞表面标记物分析
为评估脂肪来源间充质干细胞扩增后的质量,并确保微载体培养期间保留了干细胞的标志物,CD44 和 CD90 的特定荧光免疫分析通过如下步骤进行。在使用微载体的培养末期,分别从转瓶和锥形瓶中取出 5 mL 样品。当微载体沉淀于底部上清液被移除后,在室温条件下使用 PBS 润洗负载有细胞的微载体三次,随后在多聚甲醛中固定 30 分钟,再用 PBS 润洗三次。在室温下,将包含有细胞的微载体在 5% PBS 中浸泡 1 小时, 使用FITC - 连结抗人CD44 抗体(Biolegend)和APC 连结抗人 CD90(Biolegend)抗体溶液免疫染色样品,在室温条件下维持 1 小时。随后,在室温条件下使用 PBS 润洗包含有细胞的微载体五次,并且使用 EVOS FL 荧光显微镜观察。
生化以及代谢分析
细胞计数收集的上清液被用于生化以及代谢测量,使用 YSI 2950 自动生化分析仪。
干细胞表面标记物分析
为评估脂肪来源间充质干细胞扩增后的质量,并确保微载体培养期间保留了干细胞的标志物,CD44 和 CD90 的特定荧光免疫分析通过如下步骤进行。在使用微载体的培养末期,分别从转瓶和锥形瓶中取出 5 mL 样品。当微载体沉淀于底部上清液被移除后,在室温条件下使用 PBS 润洗负载有细胞的微载体三次,随后在多聚甲醛中固定 30 分钟,再用 PBS 润洗三次。在室温下,将包含有细胞的微载体在 5% PBS 中浸泡 1 小时, 使用FITC - 连结抗人CD44 抗体(Biolegend)和APC 连结抗人 CD90(Biolegend)抗体溶液免疫染色样品,在室温条件下维持 1 小时。随后,在室温条件下使用 PBS 润洗包含有细胞的微载体五次,并且使用 EVOS FL 荧光显微镜观察。
干细胞分化分析
从锥形瓶和转瓶中收获脂肪间充质干细胞,并置于 50 mL 试管中。当微载体沉淀于试管底部之后, 移除上清液, 使用DPBS 清洗细胞。随后,在 37 °C 下使用 5 mL 预热过的胰蛋白酶 - EDTA 溶液处理 10 分钟。在培养期间,随机涡旋试管2 秒钟,并加入等体积的胰蛋白酶中和溶液。微载体沉淀于试管底部,随即收集上清液。使用 DPBS 清洗微载体 2-3 次,并收集尽量多的上清液于 50 mL 试管中。润洗之后 120 g 离心5 分钟,脂肪间充质干细胞被收集于试管底部,并在 5 mL 间充质干细胞培养基中重悬。以 18000 个细胞 /cm2 的密度接种于 24 孔板中。使用 ATCC 分化分析试剂盒分析脂肪细胞和骨细胞的分化情况。分化的脂肪细胞和骨细胞可以依据 Oil red O 或者Alizarin red S 试剂盒(ScienCell®)厂商的指示将特定细胞染色来鉴别。使用 OLYMPUS CK40 显微镜观察。
结果与讨论
为了比较锥形瓶和转瓶培养,在两种培养体系中脂肪来源的间充质干细胞以 3000 个细胞 /cm2 接种。细胞培养比较持续了12 天,每天取样分析细胞生长、生化以及代谢情况。通过细胞生长对比发现,使用锥形瓶培养脂肪间充质干细胞,其细胞密度在对数生长早期(第 4 天)以及平台期(第 9 天)是转瓶培养的 1.6 到 1.8 倍(图 1 A)。生化以及代谢分析揭示在摇瓶中培养细胞时葡萄糖含量从 1.09 g/L 降至 0.548 g/L,在转瓶中培养时葡萄糖含量则降至 0.798 g/L。而在培养 12 天之后,锥形瓶中的乳酸含量从 0.042 g/L 升高至 0.396 g/L,在转瓶
中则升高至 0.259 g/L(图 1B 和 1C)。锥形瓶中较高的葡萄糖消耗速率以及乳酸生成速率表明在锥形瓶条件下干细胞生长更快。此外,在生长早期(第 4 天)转瓶中的氨累积浓度(2.4 mM)是锥形瓶培养(1.3 mM)的 1.8 倍(图 1D)。文献证实即使是低浓度的氨(1.9 mM)也会抑制间充质干细胞的生长 5。转瓶培养显示在培养初期及随后的培养过程中氨的浓度已经超过了 2 mM,表明转瓶培养中较慢的细胞生长速率可能由氨累积诱导的毒害作用所引起。在培养初期转瓶培养中氨的累积与锥形瓶相比有所增加表明了由搅拌子引起的剪切力可能对干细胞产生伤害。搅拌子在低速时有“停顿和启动”的动作,在低搅拌速度的条件下,精确的转速控制是不可能的。
为了判定脂肪来源的间充质干细胞在锥形瓶培养过程中是否保持干细胞特性,我们分析了干细胞表面标记物的免疫染色以及分化,使用干细胞表面标记抗体,如 FITC- 连结抗人 CD44 抗体和 APC 连结抗人 CD90 抗体对包含有脂肪来源间充质干细胞的微载体进行免疫染色,并且表明了脂肪来源的间充质干细胞在锥形瓶培养过程中保持了干细胞特性(图 2A 和 B)。对于脂肪细胞和骨细胞的分化分析,脂肪来源的间充质干细胞从微载体上收集并接种于包含有脂肪细胞或骨细胞分化培养基的 24 孔板中。培养 17 天之后,使用Oil red O 或者Alizarin red S 染色溶液进行染色。显微镜观察表明摇瓶培养中大部分的脂肪来源间充质干细胞成功分化成脂肪细胞或者骨细胞(图 3A 和B)。



- 微载体上脂肪间充质干细胞对 CD90 干细胞标记物显示阳性,在荧光成像下显示红色
- 微载体上脂肪间充质干细胞对 CD44 干细胞标记物显示阳性,在荧光成像下显示绿色。蓝色表示由 DAPI 染色的干细胞核。
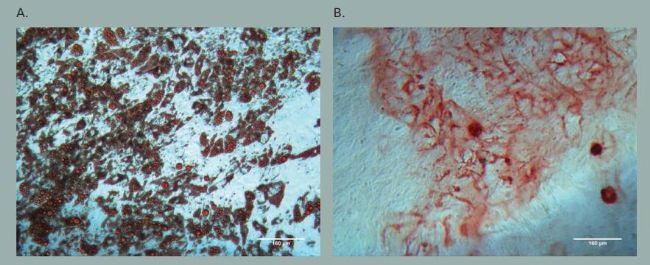
A) 由 Oil red O 阳性染色表明脂肪细胞分化形成了脂质小滴
B) 由 Alizarin red S 阳性染色显示骨细胞分化引起了细胞外基质的钙结合
结论
与旋转培养瓶培养体系相比,使用锥形瓶培养扩增间充质干细胞成为一种可行以及简单的替代方法。这种新方法依赖于一种新型的内置摇床功能的二氧化碳培养箱,例如 New BrunswickTM S41i CO2 恒温摇床。New BrunswickTM S41i CO2 恒温摇床降低了剪切力,减少了搅拌子对细胞所产生的潜在危害,缓解了在CO2 培养箱中装载旋转培养仪带来污染的风险并降低了实验的复杂性。由于在 New BrunswickTM S41i CO2 恒温摇床中可以放置大量的锥形瓶,这同样极大增加了培养细胞的能力。在转瓶培养的案例中,传统的、没有主动冷却功能的培养箱只能应付少量旋转培养仪发出的热量,容易导致温度过高这也显著限制了使用转瓶扩增细胞的应用。与之相比,使用New BrunswickTM S41i CO2 恒温摇床培养干细胞更具有优势,该方法减少了细胞扩增时遇到的瓶颈, 并为大规模用于生产临床材料的工业生物反应器接种提供了高质量的干细胞。
标签:
恒温摇床 间充质干细胞扩增





