利用具有pH检测控制和补料功能的新型摇床研究利福霉素SV种子培养过程
杜吉泉② 王军峰 储炬 王永红 庄英萍 张嗣良③
(华东理工大学生物反应器工程国家重点实验室 国家生化工程技术研究中心,上海 200237)
摘要: 种子培养过程中pH变化规律能够反映菌体对不同营养物质的利用情况及菌体生理特性的变化,可为移种时机的选择提供线索。在实际生产过程中通过取样来确定种子的生长状况存在较多弊端,而通过数学模型对种子的生长进行预测有很大的优势。本文利用具有pH检测控制与补料功能的新型摇床,得到了利福霉素SV种子的最适接种量范围为6~8%(v/v)及最适移种时间为对数生长期末期(判断标准为pH到达第二个低谷),并建立了预测菌体浓度的数学模型,检验证明此模型能够较准确地预测利福霉素SV产生菌在对数生长期及移种时(对数生长期末期)的菌浓,并可用于预测在一定接种量下达到预定菌浓所需的培养时间。
关键词: 具有pH检测控制和补料的摇床;利福霉素SV; 培养过程优化; 菌浓预测;数学模型
中图分类号:TQ920.6 文献标识码:A
Studies on Rifamycin SV Seed Cultivation with
pH-controlled fed-batch shaker①
Du Ji-quan②, Wang Jun-feng, Chu Ju, Wang Yong-hong, Zhuang Ying-ping, Zhang Si-liang③
(State Key Laboratory of Bioreactor Engineering, National Engineering Research Center for Biotechnology (Shanghai), East China University of Science & Technology, Shanghai 200237)
ABSTRACT The variety of pH during rifamycin SV seed cultivation responses to the consumption of substrates and usually can indicate the physiological characteristics of Amycolatopsis mediterranei. The process of vegetative seed cultivation was investigated with pH-controlled fed-batch shaker (ab. pH-shaker). The optimized time window for seed transferring was the second valley of the pH profile and the optimized inoculum amount was 6~8% (v/v). Furthermore, a mathematical model for predicting the PMV of the vegetative seed process was developed, which was proved suitable for logarithmic phase of vegetative seed growth.
KEY WORDS pH-controlled fed-batch shaker; Rifamycin SV; Optimization of seed cultivation; PMV prediction; mathematical model
利福霉素(Rifamycin)是由地中海拟无枝酸菌(Amycolatopsis mediterranei)产生的一类安莎大环类抗生素,广泛应用于治疗结核病、麻风病和与艾滋病有关的分枝杆菌感染[1]。其最主要活性组分SV和B是利福平、利福喷叮等利福霉素类药物的直接前体[2,3]。目前我国利福霉素产量占世界产量的绝大部分,但生产水平经常出现波动,其中种子退化及种子质量控制不稳定是一个主要原因,因此种子质量的稳定控制意义重大。
菌丝浓度是反映种子质量的一个关键指标,对它进行在线测量目前仍是一个难题。利用数学模型对种子培养过程的菌浓及生长状况进行预测是快速估计菌体浓度的有效方法之一,黄明志等[4]曾经基于神经网络对发酵过程中细胞浓度进行了在线估计,并取得较好效果。
具有pH检测控制和补料功能的新型摇床(以下简称pH摇床),相当于一个多罐并联操作的简易型生物反应器,能够实现菌株大量快速筛选、种子扩大培养、生理生化特性研究、培养基优化、补料工艺优化等多种目的。Jutta Altenbach-Rehm等人[5,6]曾用类似装置对重组E.coli表达GDP-manPP的发酵过程进行了研究,结果利用优化后的诱导剂IPTG的添加策略使产物产量提高了一倍。本文利用pH摇床研究了利福霉素SV种子培养过程最适接种量和最适移种时间,并针对对数生长期及移种时的菌体浓度建立了数学预测模型。
1 材料与方法
1.1 实验用菌株
出发菌为地中海拟无枝酸菌(Amycolatopsis mediterranei)U-32,由同联集团上海研究所提供;实验用菌种为出发菌原生质体再生后筛选得到的Y-14高产菌株。
1.2 培养方法
1.2.1 种子培养基[7]:母瓶与子瓶培养基配方相同。
1.2.2培养方法:甘油管接母瓶(一级种子),摇床培养48小时后转接子瓶(二级种子),子瓶于pH摇床上培养2天左右转接发酵瓶,发酵瓶在摇床上培养120小时放瓶。
1.3 主要仪器设备
SPY50双层培养摇床(上海离心机械研究所);SHpH-6型pH控制-补料摇床(上海国强生化工程装备有限公司)。
1.4 测定方法
菌浓为PMV法;化学效价为分光光度法[8];pH为pH摇床在线测量及pH计离线测量。
2 结果与讨论
2.1 最适移种时间及接种量
2.1.1最适移种时间的判定
将母瓶按一定的接种量转接子瓶,后者分别在pH摇床上在线测量pH值及在普通摇床上以多个平行摇瓶离线取样测定pH值,以检验二者在pH测量及变化趋势上是否存在差异。
从Fig. 1看出,普通摇床和pH摇床所培养的子瓶,其pH变化趋势基本一致,但普通摇床摇瓶的pH测定结果波动较大,而pH摇床所显示的pH变化趋势更为连贯,可以更好地反映pH的细微变化和用于代谢分析。以上利福霉素种子瓶pH的变化规律简述如下:
A点~B点(8~16h)由于葡萄糖作为碳源和能源被菌体利用而产生酸性中间代谢物导致pH下降;
B点~C点(16~30h)估计此时可快速利用的碳源已经短缺,而淀粉的水解速率相对偏低,菌体开始利用有机氮源作为碳骨架导致pH回升;
C点~D点(30~44h)可能此时葡萄糖利用限制与淀粉水解之间的矛盾得到缓解,释放出较多的糖代谢中间产物如有机酸等,导致pH再次下降;
D点(±44h)之后pH再次小幅回升,可能是由于碳源缺乏及菌体的开始少量自溶引起,推测此时应是移种的关键时刻。在此点(44h)前后分别移种转接发酵瓶测试菌种发酵能力,结果见Fig. 2。


由Fig. 1和Fig. 2可知,当种子培养过程pH到达第二个低谷(在此接种量下约为44h)时种子的产素能力最强;而且44h左右菌体正处于对数生长期末期(见Fig. 4),可见对利福霉素发酵来说选择对数生长期末期移种较为合适。
2.1.2 最适接种量
分别按2%、4%、6%、8%的接种量从母瓶转接到子瓶,检测后者培养过程pH变化曲线,结果见Fig. 3。

由Fig. 3可见几种不同接种量的种子培养过程的pH曲线的变化趋势基本一致(2%接种量时,在图示范围内pH没有出现第二个低谷),不同之处在于形成峰值和低谷值的时间不同,说明这几种情况下菌体的生理代谢过程相似,即接种量没有超出正常范围。当接种量太小或太大时种子培养过程的pH曲线同Fig. 3相比已发生较大变化(数据略)。
在Fig. 3所示接种量范围内,由于开始培养时菌体浓度不同,造成对营养物质消耗的快慢程度不同。接种量大,营养物质消耗快,菌体生长也快, pH曲线上表现为低谷值及峰值出现较早,可见最适移种时间会随接种量的增大而提前,Tab. 1比较了几种不同接种量下的最适移种时间及其相应产素能力。
Tab. 1 The titers of rifamycin fermentation resulting from different inoculum sizes of vegetative seed cultivation

* 此几种接种量下的移种时间是指pH曲线分别到达第二个低谷的时间。
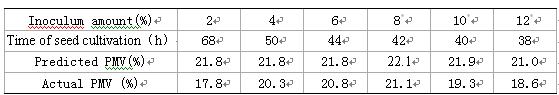
由Tab. 1可见,接种量6%和8%的子瓶的产素能力最高,随接种量的增大或减小产素能力有所下降。接种量过大或过小,会对菌体的生长产生一定的影响,从而在一定程度上影响了菌浓及菌丝质量(见Tab. 2),最终导致产素能力下降,故接种量应选择6%~8%较为合适。
2.2菌浓预测模型的建立
2.2.1假设条件
菌浓预测模型的建立,基于以下假设。
(1)利福霉素产生菌在生长过程中经历四个阶段:迟滞期、对数生长期、稳定期和衰亡期。由迟滞期转向对数生长期的条件是:菌体浓度要达到某个阈值Cm,只有达到了这个阈值菌体才可进入对数生长期,通常Cm > a,a为初始菌浓。
(2)迟滞期菌体主要是为下一步的生长作物质的准备,菌体缓慢生长,因此假设迟滞期所用的时间和菌体的初始浓度成反比。
(3)两种不同的接种量下,若菌体培养过程pH曲线变化趋势一致,则可以假设当pH达到第二个峰值时(如Fig. 1 C点所示)两个摇瓶的菌体量相同(本实验条件下菌浓测定值为12%)。原因是接种的菌体量相对于此时的菌体量很小可以忽略,而在此时二者的营养物质消耗基本一致,故产生的菌体量也应该相同。
2.2.2 菌浓预测模型的建立
分别从母瓶中按4%和6%的接种量转接子瓶,在pH摇床上实时记录培养过程pH变化趋势,如Fig. 3所示。由Fig. 3知二者pH达到峰值的时间分别为t1 = 38 h,t2 = 32 h;由于母瓶移种时菌浓为15%,故实际接种量(即接种后子瓶中实际菌浓)a1 = 0.6%,a2 = 0.9%,菌体的倍增时间td = 14 h。
根据假设条件, 可得迟滞期方程
(1)
对数生长期的菌浓方程
(2)
由方程(2)可得:
(3)
(4)
2.2.3 模型验证与误差估计
6%接种量下的子瓶对数生长期的菌浓模型预测值与实测值如Fig. 4所示。
 (—□-Predicted PMV; -●-Actual PMV)
(—□-Predicted PMV; -●-Actual PMV)
由Fig. 4看出,模型预测值与实测值基本吻合,只是在对数生长前期及外推至对数生长末期(此接种量下为44h,即pH变化的第二个低谷值)误差略大,原因有:一是对数生长前期实测菌浓由于固体培养基的存在对菌浓的实际值产生了干扰,而对数生长末期菌体已经向稳定期过渡,已不是纯粹的对数生长;二是模型本身存在一定的偏差,因为迟滞期和初始的接种量不一定是线性关系,同时模型所采用的倍增时间可能与真实的倍增时间有一定的偏差。
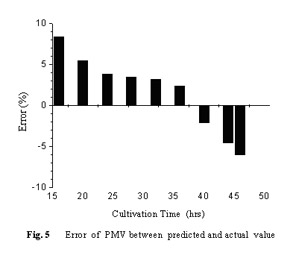
预测模型与实测值之间的相对误差值如Fig. 5所示,虽然模型和实测值在对数生长前期和后期误差略大,但总体上误差比较小,一般在5%以内。另外,由Tab. 2可见其它接种量下,移种时间的模型预测值和实测菌浓误差也较小,个别误差较大的原因分析见下文讨论部分。
综上所述,可见本模型能够较准确地预测种子培养过程中对数生长期的菌丝浓度变化。
Tab. 2 The predicted and actual PMV of seeds with different inoculum amount
at the optimal transfer occasion
 * 接种量较大时,计算接种后初始菌浓应考虑接种后的体积变化。
* 接种量较大时,计算接种后初始菌浓应考虑接种后的体积变化。
2.2.4 模型讨论
(1)本模型能够预测种子培养过程中的菌丝浓度变化,但是存在一定的局限性。主要是它受培养条件的影响,只有在培养基成份不变、培养环境不变时本模型才适用,否则模型参数需重新估计。
(2)本模型在适宜的接种量范围内准确度较高,但随接种量的偏离程度的增加准确度会有所减小,原因可能是此时菌体的生长与建模时的假定条件有所偏离。
(3)本模型不但可以预测移种时的菌浓,而且同样能够预测在一定接种量下达到预定菌浓所需的培养时间,这可为生产进度安排提供方便。
(4)不同批次种子瓶的移种时机可能会略有不同,在发酵过程中纯粹以培养时间来确定移种时机是不可取的,而要根据菌体浓度、菌体形态、生化检测指标等综合判定。
3 结论
本文利用pH摇床得到了利福霉素SV的最适移种时机为对数生长期末期,但具体移种时间会因接种量的改变而延长或缩短;研究显示利福霉素SV种子培养过程最适接种量为6~8%(v/v);为了预测移种时的菌体浓度,本文建立了菌浓预测模型,检验证明该模型能够较准确地预测对数生长期及移种时菌浓,同时该模型也可用于根据接种量来预测达到预定菌浓的时间,为种子移种时机的判断提供依据。
符号说明:
a: 初始接种量(即接种后子瓶中实际菌浓)
a1:接种量为4%时接种后子瓶中实际菌浓
a2:接种量为6%时接种后子瓶中实际菌浓
β:迟滞期系数
C:对数生长期的菌浓
C1:接种量为4%时pH达到第二峰值的菌浓
C2:接种量为6%时pH达到第二峰值的菌浓
Cm:菌体进入对数生长期必需达到的浓度阈值
PMV:以离心质量法计算的菌体浓度
t:对数生长期内的任一时间
t1:接种量为4%时pH达到第二峰值的时间
t2:接种量为6%时pH达到第二峰值的时间
td:菌体倍增时间
τ:迟滞期
τ1:接种量为4%时的迟滞期
τ2:接种量为6%时的迟滞期
参 考 文 献
[1] Queener SW, Sebek OK and Vezina C. Mutants blocked in antibiotic synthesis [J]. Rev Microbiol, 1978, 32: 593
[2] Sanfilippo, A., Della, B.C., Marsili, L. et al. Biological activity of a new class of rifamycins-piperidyl-rifamycins [J]. J Antibiot, 1980, 33: 1193
[3] Lal, R. and Lal, S. Recent trends in rifamycin research. Bioessays [J]. 1994, 16: 211
[4] 黄明志,杭海峰,储炬等. 人工神经网络在红霉素发酵过程状态预估中的应用[J]. 华东理工大学学报, 2000, 26 (2) : 162
[5] Jutta Altenbach-Rehm, Christina Nell, Matthias Arnold, and Dirk Weuster-Botz. Parallel Bubble Columns with Fed-Batch Technique for Microbial Process Development on a Small Scale [J]. Chem Eng Technol, 1999, 22 (12) : 1051
[6] Dirk Weuster-Botz , Jutta Altenbach-Rehm, and Christina Nell, Matthias Arnold. Parallel substrate feeding and pH-control in shaking-flasks [J]. Biochem Eng J, 2001, 7: 163
[7] 焦瑞身,陈聿美,吴梦淦等. 地中海诺卡式菌合成利福霉素代谢调节的研究[J]. 植物生理学报, 1979, 5 (4) : 395
[8] Sensi P, Thiemann J E. Production of rifamycins [J]. Prog Ind Microbiol, 1967, 6: 21
上海国强生化工程装备有限公司 余序舜 供稿
地址:徐汇区华泾路1305弄19号(华东理工大学科技园)
网址:http://www.nc-bio.com
电话:021-54827631/54827734-8102
邮箱:nc-bio@163.com
(华东理工大学生物反应器工程国家重点实验室 国家生化工程技术研究中心,上海 200237)
摘要: 种子培养过程中pH变化规律能够反映菌体对不同营养物质的利用情况及菌体生理特性的变化,可为移种时机的选择提供线索。在实际生产过程中通过取样来确定种子的生长状况存在较多弊端,而通过数学模型对种子的生长进行预测有很大的优势。本文利用具有pH检测控制与补料功能的新型摇床,得到了利福霉素SV种子的最适接种量范围为6~8%(v/v)及最适移种时间为对数生长期末期(判断标准为pH到达第二个低谷),并建立了预测菌体浓度的数学模型,检验证明此模型能够较准确地预测利福霉素SV产生菌在对数生长期及移种时(对数生长期末期)的菌浓,并可用于预测在一定接种量下达到预定菌浓所需的培养时间。
关键词: 具有pH检测控制和补料的摇床;利福霉素SV; 培养过程优化; 菌浓预测;数学模型
中图分类号:TQ920.6 文献标识码:A
Studies on Rifamycin SV Seed Cultivation with
pH-controlled fed-batch shaker①
Du Ji-quan②, Wang Jun-feng, Chu Ju, Wang Yong-hong, Zhuang Ying-ping, Zhang Si-liang③
(State Key Laboratory of Bioreactor Engineering, National Engineering Research Center for Biotechnology (Shanghai), East China University of Science & Technology, Shanghai 200237)
ABSTRACT The variety of pH during rifamycin SV seed cultivation responses to the consumption of substrates and usually can indicate the physiological characteristics of Amycolatopsis mediterranei. The process of vegetative seed cultivation was investigated with pH-controlled fed-batch shaker (ab. pH-shaker). The optimized time window for seed transferring was the second valley of the pH profile and the optimized inoculum amount was 6~8% (v/v). Furthermore, a mathematical model for predicting the PMV of the vegetative seed process was developed, which was proved suitable for logarithmic phase of vegetative seed growth.
KEY WORDS pH-controlled fed-batch shaker; Rifamycin SV; Optimization of seed cultivation; PMV prediction; mathematical model
利福霉素(Rifamycin)是由地中海拟无枝酸菌(Amycolatopsis mediterranei)产生的一类安莎大环类抗生素,广泛应用于治疗结核病、麻风病和与艾滋病有关的分枝杆菌感染[1]。其最主要活性组分SV和B是利福平、利福喷叮等利福霉素类药物的直接前体[2,3]。目前我国利福霉素产量占世界产量的绝大部分,但生产水平经常出现波动,其中种子退化及种子质量控制不稳定是一个主要原因,因此种子质量的稳定控制意义重大。
菌丝浓度是反映种子质量的一个关键指标,对它进行在线测量目前仍是一个难题。利用数学模型对种子培养过程的菌浓及生长状况进行预测是快速估计菌体浓度的有效方法之一,黄明志等[4]曾经基于神经网络对发酵过程中细胞浓度进行了在线估计,并取得较好效果。
具有pH检测控制和补料功能的新型摇床(以下简称pH摇床),相当于一个多罐并联操作的简易型生物反应器,能够实现菌株大量快速筛选、种子扩大培养、生理生化特性研究、培养基优化、补料工艺优化等多种目的。Jutta Altenbach-Rehm等人[5,6]曾用类似装置对重组E.coli表达GDP-manPP的发酵过程进行了研究,结果利用优化后的诱导剂IPTG的添加策略使产物产量提高了一倍。本文利用pH摇床研究了利福霉素SV种子培养过程最适接种量和最适移种时间,并针对对数生长期及移种时的菌体浓度建立了数学预测模型。
1 材料与方法
1.1 实验用菌株
出发菌为地中海拟无枝酸菌(Amycolatopsis mediterranei)U-32,由同联集团上海研究所提供;实验用菌种为出发菌原生质体再生后筛选得到的Y-14高产菌株。
1.2 培养方法
1.2.1 种子培养基[7]:母瓶与子瓶培养基配方相同。
1.2.2培养方法:甘油管接母瓶(一级种子),摇床培养48小时后转接子瓶(二级种子),子瓶于pH摇床上培养2天左右转接发酵瓶,发酵瓶在摇床上培养120小时放瓶。
1.3 主要仪器设备
SPY50双层培养摇床(上海离心机械研究所);SHpH-6型pH控制-补料摇床(上海国强生化工程装备有限公司)。
1.4 测定方法
菌浓为PMV法;化学效价为分光光度法[8];pH为pH摇床在线测量及pH计离线测量。
2 结果与讨论
2.1 最适移种时间及接种量
2.1.1最适移种时间的判定
将母瓶按一定的接种量转接子瓶,后者分别在pH摇床上在线测量pH值及在普通摇床上以多个平行摇瓶离线取样测定pH值,以检验二者在pH测量及变化趋势上是否存在差异。
从Fig. 1看出,普通摇床和pH摇床所培养的子瓶,其pH变化趋势基本一致,但普通摇床摇瓶的pH测定结果波动较大,而pH摇床所显示的pH变化趋势更为连贯,可以更好地反映pH的细微变化和用于代谢分析。以上利福霉素种子瓶pH的变化规律简述如下:
A点~B点(8~16h)由于葡萄糖作为碳源和能源被菌体利用而产生酸性中间代谢物导致pH下降;
B点~C点(16~30h)估计此时可快速利用的碳源已经短缺,而淀粉的水解速率相对偏低,菌体开始利用有机氮源作为碳骨架导致pH回升;
C点~D点(30~44h)可能此时葡萄糖利用限制与淀粉水解之间的矛盾得到缓解,释放出较多的糖代谢中间产物如有机酸等,导致pH再次下降;
D点(±44h)之后pH再次小幅回升,可能是由于碳源缺乏及菌体的开始少量自溶引起,推测此时应是移种的关键时刻。在此点(44h)前后分别移种转接发酵瓶测试菌种发酵能力,结果见Fig. 2。


由Fig. 1和Fig. 2可知,当种子培养过程pH到达第二个低谷(在此接种量下约为44h)时种子的产素能力最强;而且44h左右菌体正处于对数生长期末期(见Fig. 4),可见对利福霉素发酵来说选择对数生长期末期移种较为合适。
2.1.2 最适接种量
分别按2%、4%、6%、8%的接种量从母瓶转接到子瓶,检测后者培养过程pH变化曲线,结果见Fig. 3。

由Fig. 3可见几种不同接种量的种子培养过程的pH曲线的变化趋势基本一致(2%接种量时,在图示范围内pH没有出现第二个低谷),不同之处在于形成峰值和低谷值的时间不同,说明这几种情况下菌体的生理代谢过程相似,即接种量没有超出正常范围。当接种量太小或太大时种子培养过程的pH曲线同Fig. 3相比已发生较大变化(数据略)。
在Fig. 3所示接种量范围内,由于开始培养时菌体浓度不同,造成对营养物质消耗的快慢程度不同。接种量大,营养物质消耗快,菌体生长也快, pH曲线上表现为低谷值及峰值出现较早,可见最适移种时间会随接种量的增大而提前,Tab. 1比较了几种不同接种量下的最适移种时间及其相应产素能力。
Tab. 1 The titers of rifamycin fermentation resulting from different inoculum sizes of vegetative seed cultivation

* 此几种接种量下的移种时间是指pH曲线分别到达第二个低谷的时间。
由Tab. 1可见,接种量6%和8%的子瓶的产素能力最高,随接种量的增大或减小产素能力有所下降。接种量过大或过小,会对菌体的生长产生一定的影响,从而在一定程度上影响了菌浓及菌丝质量(见Tab. 2),最终导致产素能力下降,故接种量应选择6%~8%较为合适。
2.2菌浓预测模型的建立
2.2.1假设条件
菌浓预测模型的建立,基于以下假设。
(1)利福霉素产生菌在生长过程中经历四个阶段:迟滞期、对数生长期、稳定期和衰亡期。由迟滞期转向对数生长期的条件是:菌体浓度要达到某个阈值Cm,只有达到了这个阈值菌体才可进入对数生长期,通常Cm > a,a为初始菌浓。
(2)迟滞期菌体主要是为下一步的生长作物质的准备,菌体缓慢生长,因此假设迟滞期所用的时间和菌体的初始浓度成反比。
(3)两种不同的接种量下,若菌体培养过程pH曲线变化趋势一致,则可以假设当pH达到第二个峰值时(如Fig. 1 C点所示)两个摇瓶的菌体量相同(本实验条件下菌浓测定值为12%)。原因是接种的菌体量相对于此时的菌体量很小可以忽略,而在此时二者的营养物质消耗基本一致,故产生的菌体量也应该相同。
2.2.2 菌浓预测模型的建立
分别从母瓶中按4%和6%的接种量转接子瓶,在pH摇床上实时记录培养过程pH变化趋势,如Fig. 3所示。由Fig. 3知二者pH达到峰值的时间分别为t1 = 38 h,t2 = 32 h;由于母瓶移种时菌浓为15%,故实际接种量(即接种后子瓶中实际菌浓)a1 = 0.6%,a2 = 0.9%,菌体的倍增时间td = 14 h。
根据假设条件, 可得迟滞期方程
(1)

对数生长期的菌浓方程
(2)

由方程(2)可得:
(3)

(4)

2.2.3 模型验证与误差估计
6%接种量下的子瓶对数生长期的菌浓模型预测值与实测值如Fig. 4所示。
 (—□-Predicted PMV; -●-Actual PMV)
(—□-Predicted PMV; -●-Actual PMV)由Fig. 4看出,模型预测值与实测值基本吻合,只是在对数生长前期及外推至对数生长末期(此接种量下为44h,即pH变化的第二个低谷值)误差略大,原因有:一是对数生长前期实测菌浓由于固体培养基的存在对菌浓的实际值产生了干扰,而对数生长末期菌体已经向稳定期过渡,已不是纯粹的对数生长;二是模型本身存在一定的偏差,因为迟滞期和初始的接种量不一定是线性关系,同时模型所采用的倍增时间可能与真实的倍增时间有一定的偏差。

预测模型与实测值之间的相对误差值如Fig. 5所示,虽然模型和实测值在对数生长前期和后期误差略大,但总体上误差比较小,一般在5%以内。另外,由Tab. 2可见其它接种量下,移种时间的模型预测值和实测菌浓误差也较小,个别误差较大的原因分析见下文讨论部分。
综上所述,可见本模型能够较准确地预测种子培养过程中对数生长期的菌丝浓度变化。
Tab. 2 The predicted and actual PMV of seeds with different inoculum amount
at the optimal transfer occasion
 * 接种量较大时,计算接种后初始菌浓应考虑接种后的体积变化。
* 接种量较大时,计算接种后初始菌浓应考虑接种后的体积变化。2.2.4 模型讨论
(1)本模型能够预测种子培养过程中的菌丝浓度变化,但是存在一定的局限性。主要是它受培养条件的影响,只有在培养基成份不变、培养环境不变时本模型才适用,否则模型参数需重新估计。
(2)本模型在适宜的接种量范围内准确度较高,但随接种量的偏离程度的增加准确度会有所减小,原因可能是此时菌体的生长与建模时的假定条件有所偏离。
(3)本模型不但可以预测移种时的菌浓,而且同样能够预测在一定接种量下达到预定菌浓所需的培养时间,这可为生产进度安排提供方便。
(4)不同批次种子瓶的移种时机可能会略有不同,在发酵过程中纯粹以培养时间来确定移种时机是不可取的,而要根据菌体浓度、菌体形态、生化检测指标等综合判定。
3 结论
本文利用pH摇床得到了利福霉素SV的最适移种时机为对数生长期末期,但具体移种时间会因接种量的改变而延长或缩短;研究显示利福霉素SV种子培养过程最适接种量为6~8%(v/v);为了预测移种时的菌体浓度,本文建立了菌浓预测模型,检验证明该模型能够较准确地预测对数生长期及移种时菌浓,同时该模型也可用于根据接种量来预测达到预定菌浓的时间,为种子移种时机的判断提供依据。
符号说明:
a: 初始接种量(即接种后子瓶中实际菌浓)
a1:接种量为4%时接种后子瓶中实际菌浓
a2:接种量为6%时接种后子瓶中实际菌浓
β:迟滞期系数
C:对数生长期的菌浓
C1:接种量为4%时pH达到第二峰值的菌浓
C2:接种量为6%时pH达到第二峰值的菌浓
Cm:菌体进入对数生长期必需达到的浓度阈值
PMV:以离心质量法计算的菌体浓度
t:对数生长期内的任一时间
t1:接种量为4%时pH达到第二峰值的时间
t2:接种量为6%时pH达到第二峰值的时间
td:菌体倍增时间
τ:迟滞期
τ1:接种量为4%时的迟滞期
τ2:接种量为6%时的迟滞期
参 考 文 献
[1] Queener SW, Sebek OK and Vezina C. Mutants blocked in antibiotic synthesis [J]. Rev Microbiol, 1978, 32: 593
[2] Sanfilippo, A., Della, B.C., Marsili, L. et al. Biological activity of a new class of rifamycins-piperidyl-rifamycins [J]. J Antibiot, 1980, 33: 1193
[3] Lal, R. and Lal, S. Recent trends in rifamycin research. Bioessays [J]. 1994, 16: 211
[4] 黄明志,杭海峰,储炬等. 人工神经网络在红霉素发酵过程状态预估中的应用[J]. 华东理工大学学报, 2000, 26 (2) : 162
[5] Jutta Altenbach-Rehm, Christina Nell, Matthias Arnold, and Dirk Weuster-Botz. Parallel Bubble Columns with Fed-Batch Technique for Microbial Process Development on a Small Scale [J]. Chem Eng Technol, 1999, 22 (12) : 1051
[6] Dirk Weuster-Botz , Jutta Altenbach-Rehm, and Christina Nell, Matthias Arnold. Parallel substrate feeding and pH-control in shaking-flasks [J]. Biochem Eng J, 2001, 7: 163
[7] 焦瑞身,陈聿美,吴梦淦等. 地中海诺卡式菌合成利福霉素代谢调节的研究[J]. 植物生理学报, 1979, 5 (4) : 395
[8] Sensi P, Thiemann J E. Production of rifamycins [J]. Prog Ind Microbiol, 1967, 6: 21
上海国强生化工程装备有限公司 余序舜 供稿
地址:徐汇区华泾路1305弄19号(华东理工大学科技园)
网址:http://www.nc-bio.com
电话:021-54827631/54827734-8102
邮箱:nc-bio@163.com





