用 FDA二乙酸荧光素和 PI碘化丙啶对细胞球状体进行活力染色操作手册
基于荧光染色的细胞活力检测法可用于评估哺乳动物细胞的活力。同时使用两种荧光染料可以对活细胞群和死细胞群进行双色区分。在本应用指南中,我们介绍了一种使用二乙酸荧光素(FDA)和碘化丙啶(PI)的染色方案,它们可分别对存活细胞和死亡细胞进行染色。染色方案适用于贴壁细胞、嵌入细胞外基质的单细胞和3D细胞簇,例如细胞球状体。
实验原理在生物学研究中,FDA(二乙酸荧光素)和PI(碘化丙啶)被用作活/死细胞的染色剂。FDA 能够被细胞吸收,并在酯酶的作用下,无荧光的 FDA 可被转化为带绿色荧光的代谢物荧光素。这种转化过程可以作为细胞活力的指标,因为它依赖于活细胞内的酯酶活性。
与之相对,PI 作为一种细胞核染色染料,它无法穿越活细胞的完整细胞膜。然而,当细胞死亡时,其细胞膜的结构会发生变化,PI能够通过这些无序的区域进入细胞核,并与 DNA 双螺旋结构结合。
实验材料与设备-
二乙酸荧光素(FDA)
将 5 mg FDA 溶解在 1 mL 丙酮中,配制得 FDA 储存液(储存液需 -20 °C 保存)
-
碘化丙啶
将 2 mg PI 溶于 1 mL PBS( 4 °C 储存),配制得 PI 原液。
-
不含胎牛血清的细胞培养基
-
磷酸盐缓冲液或其他缓冲液
-
带 Texas Red 和 FITC 滤片的倒置荧光显微镜
染色步骤
为确保实验结果的准确性,染色体系应即配即用,且其有效使用时间应严格控制在 2 h 以内。在非使用时段,为确保染色体系的稳定性和有效性,应将其避光保存,并置于 4°C 恒温条件下进行保存。

图 1:二乙酸荧光素/碘化丙啶染色体系
针对单个细胞的染色步骤对于粘附在培养表面或嵌入细胞外基质中的单细胞,建议采用以下染色方案:
- 根据图1所示之配方,准确配制染色体系,并将其存放在 4 ℃ 冰箱中冷藏;
- 将细胞离心后弃上清(去除细胞培养基);
- 加入染色体系——其体积应基于所用载玻片或培养皿的尺寸和规格确定(请参考相应的产品规格说明);
- 在室温下避光孵育细胞 4~5 min;
- 将细胞离心后弃上清(去除染色体系);
- 用适量磷酸盐缓冲液(PBS)冲洗样本,以去除残留的染色体系;
- 加入 PBS 或不含胎牛血清的培养基;
- 使用荧光显微镜观察细胞。
以下方案适用于 3D 细胞培养,如细胞球状体、组织等:
-
根据图1所示之配方,准确配制染色体系,并将其存放在 4 ℃ 冰箱中冷藏;
-
收集细胞团;如有必要,将细胞培养体系离心后弃上清,以收集细胞团;
-
离心后弃上清;
-
精确加入 1 mL 染色体系;
-
在室温下避光孵育细胞 4~5 min;
-
将细胞离心后弃上清(去除染色体系);
-
用适量磷酸盐缓冲液(PBS)冲洗样本,以去除残留的染色体系;
-
加入 PBS 或不含胎牛血清的培养基;
-
将细胞团转移至 ibidi µ-Slide 8 孔腔室载玻片中(ibidi, 80826);
-
使用荧光显微镜观察细胞。

ibidi, 80826
常见实验问题
1.信号弱针对信号弱的问题,建议根据实验的具体情况调整染料浓度或延长孵育时间。同时,务必确保染色液的使用时间不超过两小时,以保持其活性。另外,建议将染色液储存于 4°C 的避光环境中。
2.背景信号高高背景信号可能由培养基成分引起,这些成分可能干扰荧光信号的检测。为确保实验的准确性,推荐使用不含血清的培养基。另外,可尝试使用无酚红培养基或磷酸盐缓冲液(PBS)作为替代。在除去染色液后,增加额外的清洗步骤有助于降低背景信号的干扰。
3.光漂白效应荧光信号可能因光漂白效应而随时间减弱。因此,快速操作对于保持实验条件的一致性和可重复性至关重要。在处理大量样品时,建议分批次进行染色,每次仅处理有限数量的样品。为确保细胞的最佳生长条件,建议使用 ibidi 载物台培养箱进行培养。

ibidi 载物台培养箱
1.对单个细胞进行染色

贴壁细胞系 MDA-MB-231 的活力染色显示细胞活力很高(从左到右:相差显微镜镜检(明场)图像、示 PI 信号图像、示 FDA 信号图像、FDA 和 PI 信号的叠加场图像)比例尺:200 μm。
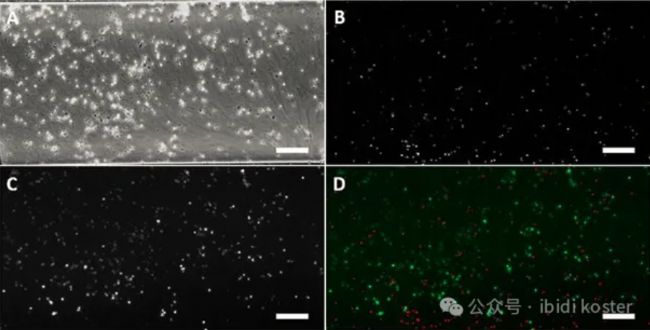
对包埋在胶原基质胶中的 Jurkat 细胞进行活力染色,结果显示细胞活力为 65%。(A:相差显微镜镜检(明场)图像;B:示 PI 信号图像;C:示 FDA 信号图像;D:FDA 和 PI 信号的叠加场图像)比例尺:200 μm。
2.对细胞球状体进行染色
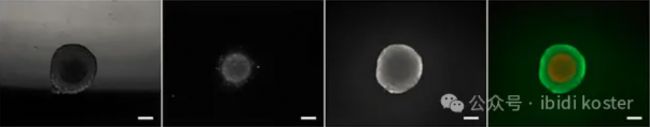
MCF-7 细胞球状体的活力染色(从左到右:相差显微镜镜检(明场)图像、示 PI 信号、示 FDA 信号、FDA 和 PI 信号的叠加场图像)比例尺:200 μm。
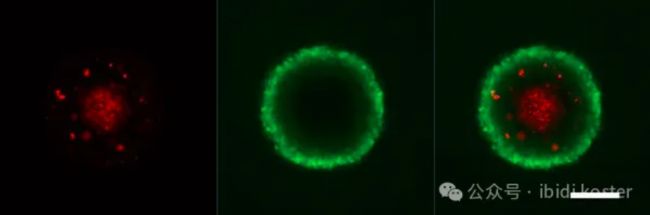
MCF-7 细胞球状体的共聚焦激光扫描显微镜图像显示了球状体的内部结构:坏死的中心被一层有活力的细胞包围(从左到右:示 PI 信号图像、示 FDA 信号图像、FDA 和 PI 信号的叠加场图像)。标尺:200 μm

广州科适特科学仪器有限公司是德国ibidi公司在中国区合作伙伴
如果你感兴趣请和我们联系
电话:020-38102730
服务QQ:501747125
邮箱:info@kosterscience.com
地址:广州市天河区体育西路骏汇大厦北塔110 D房





