生物工艺中一次性系统的颗粒物风险

起初缓冲液制备和培养基,中间体的存储这类应用中开始使用包括塑料生物容器以及过滤胶囊等一次性部件。随着一次性系统逐渐在工艺中被接受,工艺上游也开始采用一次性生物反应器及混合系统。目前一次性系统也开始在灌装及原液储存等下游方面上进行应用。由于一次性系统可以更有效减少成本支出,生产占地面积更小、更灵活。并且其系统的设计和建造也可以符合当前的监管要求,例如根据美国食品及药物管理局(FDA)的现行良好生产规范指南,对于采用质量源于设计(QbD)理念的要求(质量可以规划的理论方法,大多数质量危机和问题都与最初规划质量的方式有关)。一次性系统在生物工艺中的使用占比逐渐加大,供应商也快速开发出各类预先灭菌的配件、管路、泵、传感器和容器以在工艺流程或单个步骤中使用。然而越接近终端制剂环节,对于析出物和颗粒物的要求也越为严苛,也引发了用户对于一次性系统中聚合材料的担忧。
01 生物工艺中的颗粒物风险
在接受含有颗粒物污染的注射的受试者中已记录了许多临床副反应,例如包括静脉炎 、肺栓塞、肺肉芽肿、免疫系统功能障碍、肺功能障碍、梗死、甚至是死亡。对于制药生产流程来说,终端药品需要避免化学,物理,以及微生物方面上的污染,目前对于微生物污染的测量和控制已经得到了全面的理解。然而由于污染物的性质、药品生产的现状以及灵敏的测量技术的可用性,化学和颗粒物所导致的污染依然很难避免,从而导致注射药品都受到一定程度的固体颗粒物的污染,包括纤维、灰尘、橡胶和硅酮等,这些材料会在生产工艺流程过程中进入药品。因此FDA也有对此的相关标准,其明确要求最终药品必须“基本上不含”可见颗粒污染物,并且目视检查必须符合USP 790 标准(主要针对于大于100μm的可见异物)。此外,最终药品必须符合 USP 788 对亚可见颗粒的限制(主要针对于小于100 μm的亚可见异物)。
除了可能的临床影响之外,还有商业影响。 颗粒异物可能会导致产量降低和批次报废。从而导致生产和销售的成本上升,还额外需求企业在QA质量控制层面进一步加大投入以缓解风险确保产品质量及安全。同时企业也会遭到监管机构更多的审查,监管机构相关文件及标准也在持续性更新以减少颗粒污染并确保其药物的安全性。

02 生物工艺中颗粒物来源以及USP 788标准
生物中的颗粒物污染大致可以分为两类来源:内在或外在性质污染(如下图)。其中外在污染主要来源于实验室环境,包括实验室内的加热,通风,空调系统,实验室所使用的工具设备及涉及参与生产工艺的操作人员。其内在性污染主要源于在工艺流程中所使用的储存,混合,纯化,传输流体等工艺环节,这些环节中会大量使用一次性系统及耗材,也是一次性系统中可能造成颗粒物污染的来源。
| 来源 | 颗粒物 | 内源性/外源性 |
| 环境 | 灰尘 纤维 生物制品——昆虫部位、微生物、花粉 人类来源的纤维 头发 皮肤 涂料/涂层碎片 灰尘 金属 矿物质 聚合物 玻璃(例如,来自组件的残留物) 异物(例如,橡胶塞组件中残留的物质) |
外源性 |
| 包装材料 | 橡胶 玻璃 聚合物 硅酮 |
内源性 |
| 溶液和配方成分 | 沉淀 低聚物 降解物 结块 未溶解的物质 |
内源性 |
| 产品与包装的相互作用 | 玻璃片 二氧化硅 橡皮 塑料 |
内源性 |
| 0过程产生的颗粒物 | 金属(例如工艺设备中的不锈钢) 过滤器及耗材纤维 玻璃 |
内源性 |
由于颗粒物被注射进入体内是具有潜在的伤害性,每当静脉注射药物,就会有一定数量的颗粒物同时进入病患体内,并且在工艺流程中并无法完全避免颗粒物的污染,因此USP788规定了相关注射药物的颗粒物标准以确保药物的安全性。USP788规定了光阻法颗粒计数试验及显微颗粒计数试验两种方法用于测定颗粒物以及以及样本是否来自大体积(>100 mL) 或小体积(≤ 100 mL) 的肠外注射剂量。其具体检测要求标准列于下表中。
| >100mL 采取样本的USP788 标准 | 限制 |
| 光阻法颗粒计数试验 | 大于等于10 μm的颗粒应小于等于25 颗粒/毫升, 大于等于25 μm的颗粒应小于等于3颗粒/毫升 |
| 显微颗粒计数试验 | 大于等于10 μm的颗粒应小于等于12 颗粒/毫升, 大于等于25 μm的颗粒应小于等于2颗粒/毫升 |
| ≤100mL 采取样本的USP788 标准 | 限制 |
| 光阻法颗粒计数试验 | 大于等于10 μm的颗粒应小于等于6000 颗粒/毫升, 大于等于25 μm的颗粒应小于等于600颗粒/毫升 |
| 显微颗粒计数试验 | 大于等于10 μm的颗粒应小于等于3000 颗粒/毫升, 大于等于25 μm的颗粒应小于等于300颗粒/毫升 |
值得注意的是USP788为美国药典对于注射剂的中含有的颗粒物检测规范,而非仅针对于一次性系统之中。在工艺流程中需要全方位的注意并采取进一步措施以减少颗粒物的污染,包括使用可检测颗粒物更少的一次性系统及耗材等,以在最终成品中减少颗粒物的污染,制造出更符合标准以及更洁净安全的成品药物。
03 一次性系统颗粒物及Sanisure Pharmatainer系列产品检测水平
对于一次性系统中其颗粒物主要来源于其生产制造流程,制造材料以及生产人员和环境。Sanisure Pharmatainer产品可以有效帮助您降低颗粒物污染并保证您的工艺安全。所有PharmaTainer™瓶都是由100%无动物源性成分、医用级原生树脂原料生产。原料提供FDA注册的DMF文件。批次间一致性有更好的保障。并且在在ISO 5级洁净室完成瓶子成型和装盖,具有ISO9001 2015认可并有唯一溯源序列号和有效期,以及在ISO 7级洁净室中完成包装,通过不同的包装方式以保证产品的严格无菌。在生产环节以及其生产环境中有效确保了无菌性并大量减少了颗粒物的存在。
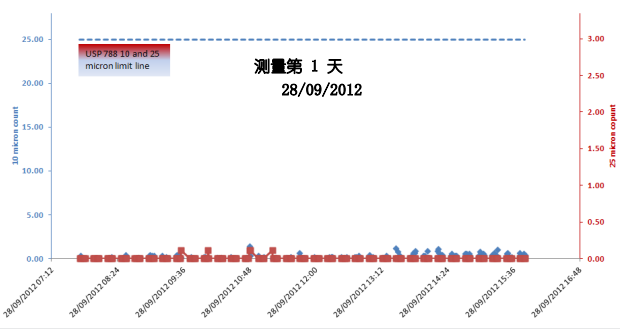
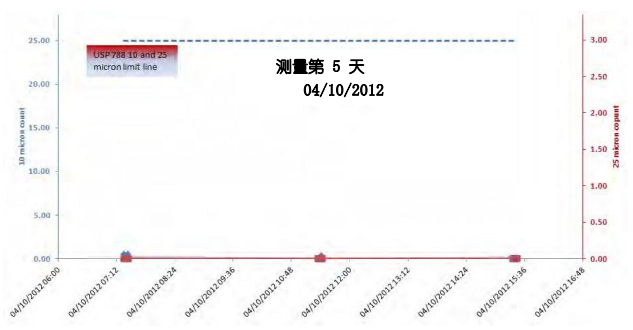
同时,Sanisure PharmaTainer 系列多款储液瓶经过验证测试,其颗粒物检测标准均远低于USP检测标准颗粒物,仅是USP< 788>检测限值的1.7%,是生物工艺关键应用的完美解决方案。(具体检测数值如下图所示)。在您的生物工艺中应用Sanisure产品可以有效降低一次性系统中所带来的颗粒物污染,帮助您简化工艺流程,生产更具有安全效益的产品。Sanisure诚挚希望能帮助您在减少成本的基础上,生产符合法规且更安全可靠的成品,并更好地为您实现拯救生命的目标。我们也将根据您的需求提供多种定制选项,持续创新性的生物工艺解决方案。
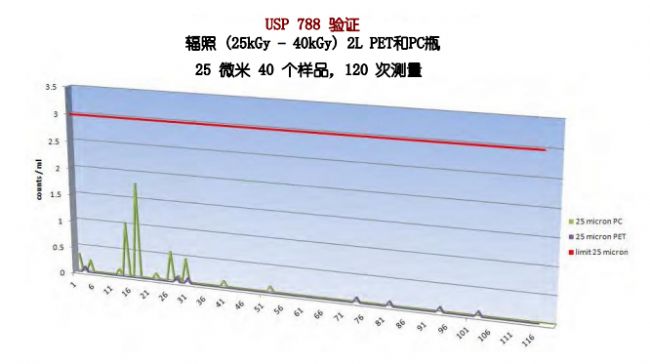
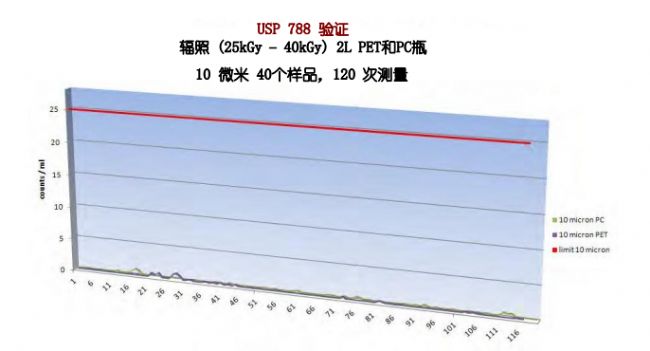
PharmaTainer 2L PET/PC 瓶颗粒物检测数据
Sanisure Pharmatainer储液瓶订购信息

样品试用申请
Sanisure的核心制造能力包括注塑、注塑-拉伸吹塑、洁净室组装、挤管、 加工定制、针头制造和其他专有技术。Sanisure提供各类一次性产品,包括业内 最洁净的PharmaTainer储液瓶、小体积混合解决方案Mixed4Sure、 Cap2v8一体成型瓶盖和管路系统、RC40智能滚瓶系统、Cellgyn硅胶管、Pharma-Clear硅胶管、高精度灌装针和灌装组件、各类配件等。

欢迎各位老师扫码申请试用
References:
Wormuth, Klaus, Fanny Gaston, and Mathieu Labedan. "Particulate contamination in single use systems: Measurement challenges." (2017).
Johnson, Michael W. "Understanding particulates in single-use bags."BioProcess Int 12.4 (2014): 22-28.
Langille, Stephen E. "Particulate matter in injectable drug products."PDA J Pharm Sci Technol 67.3 (2013): 186-200.
Sandle, Tim, and Madhu Raju Saghee. "Some considerations for the implementation of disposable technology and single-use systems in biopharmaceuticals."Journal of Commercial Biotechnology 17 (2011): 319-329.
Wormuth, Klaus, et al. "Particulate contamination in single-use systems: real versus perceived risk." (2018).
关于我们
贝朗新创(北京)生物科技有限公司成立于2019 年,是一家专注于生物工艺尤其是细胞培养 / 微生物发酵工艺的设备和解决方案供应商,核心管理团队及技术人员来自国际知名生物工艺供应商,平均行业内经验超过十五年。贝朗新创秉承客户至上,服务为先的理念以卓越的产品品质, 专业的技术能力服务于中国生物技术行业,帮助您优化工艺流程,降本增效,快速建立安全,稳定的生物工艺。
贝朗新创是德国bbi-biotech GmbH 驻中国办事处,及Sanisure中国区授权经销商。负责德国 bbi-biotech xCUBIO 系列生物反应器以及Sanisure储液瓶,管路,混合系统等相关耗材的在中国的市场推广,销售和售后服务工作。覆盖了单抗、疫苗、基因和细胞治疗的细分市场,提供从工艺开发及优化,中试放大以及最终 GMP 商业化生产的综合性生物工艺解决方案





