NOX2诱导生成的ROS和PITX2在肥胖介导的房颤中发挥的作用
心房颤动(AF)是最常见的持续性心律失常。越来越多的数据证明肥胖(身体质量指数[BMI]≥30 kg/m2)是造成房颤的关键因素之一。人类和动物研究表明,肥胖诱导的心房重构会产生一种促纤维化底物进而诱导房颤发生,在喂食高脂肪饮食(HFD)的饮食诱导肥胖(DIO)小鼠中,心房的结构重构和电重构会增加 AF 患病风险。然而,肥胖介导 AF 的分子机制仍然知之甚少。
氧化应激和活性氧(ROS)的产生在介导肥胖诱导的心房重构和房颤的发展中起关键作用。产生 ROS 的主要来源是 NADPH 氧化酶(NOX)、线粒体、黄嘌呤氧化酶、细胞色素 c 氧化酶和一氧化氮合酶。研究显示,识别和靶向参与 ROS 产生的特定途径,如 NOX2,可能不仅可抑制房颤,还可阻止其在肥胖介导的房颤中的进展。
此外,与房颤患者 4q25 染色体位点相关的配对样同源结构域转录因子2 (PITX2)表达改变导致人和小鼠心房电特性异常,突出了其在房颤病理生理中的重要意义。研究 PITX2 诱导的电重构对心律失常的影响是理解和治疗房颤的关键一步。然而,PITX2 在肥胖介导的房颤和 NOX2 升高中的具体作用尚不清楚。
基于此,美国伊利诺伊大学芝加哥分校 Dawood Darbar 团队在The Journal of Clinical Investigation杂志(最新IF: 13.3)上发表“Modulation of NOX2 causes obesity-mediated atrial fibrillation”相关文章。

假设 NOX2 在肥胖介导的房颤中通过调节 PITX2 驱动氧化应激产生 ROS,导致心房通道和结构改变。为了验证这一点,文章中使用了 NOX2 敲除(KO)小鼠模型和棕榈酸(PA)处理的 hiPSC-aCMs,并用 Apocynin(NOX 阻滞剂)和 GSK-2795039 (NOX2 抑制剂)处理。总之,肥胖小鼠和 PA 处理的 hiPSC-aCMs 中 NOX2 的遗传和药理学抑制消除了离子通道和结构重塑,并通过 PITX2 的转录调节预防肥胖介导的房颤。
研究结果:
1. 在肥胖个体的心房组织中,NOX2 表达增加
已有实验证明 DIO 小鼠由肥胖介导的 AF 中 NOX2 蛋白表达增加,为了进一步检测肥胖个体心房组织中 NOX2(NADPH 氧化酶 2)的表达水平,本实验采用实时定量 PCR(qPCR)技术,观察到在 BMI 大于 30 kg/m2 的个体中,人心房 NOX2 的 mRNA 表达增加。与消瘦个体相比,肥胖个体的心房 NOX2 的表达增加了 2 倍以上。然后,我们评估了心脏离子通道和结构基因的表达。与消瘦个体相比,肥胖个体的 KCNA5 mRNA 表达显著增加。在超重和肥胖的个体中,编码连接蛋白 40 的 GJA5 的 mRNA 表达量也有所下降。相比之下,与消瘦个体相比,编码 INa 的 SCN5A 没有显著变化;编码 ICa,L 的 CACNA1C 在肥胖个体中显著增加。
为了明确 NOX2 与肥胖介导的人类 AF 中心房离子通道重构之间的关联,本研究评估了对照组、DIO 组、Nox2-KO(Nox2 敲除)组和DIO Nox2-KO 组四组小鼠的体重水平:与对照组和 Nox2-KO 小鼠相比,DIO、DIO-Apocynin 和 DIO Nox2-KO 小鼠的体重增加。与对照组和Nox2-KO 小鼠相比,DIO、DIO-Apocynin 和 DIO Nox2-KO 小鼠的平均体重显著增加。经食管心房起搏后,观察到与 DIO 小鼠相比,DIO Nox2-KO 和 DIO-Apocynin 小鼠的 AF 负担显著降低。DIO Nox2-KO 小鼠和 DIO-Apocynin 小鼠的 AF 持续时间显著低于 DIO 小鼠。此外,与 DIO 小鼠相比,DIO Nox2-KO 小鼠 AF 发生率降低,而 DIO-Apocynin 小鼠的变化无统计学意义。综上所述,NOX2 表达的遗传和药理抑制都可以抑制 DIO 小鼠起搏诱导的 AF。
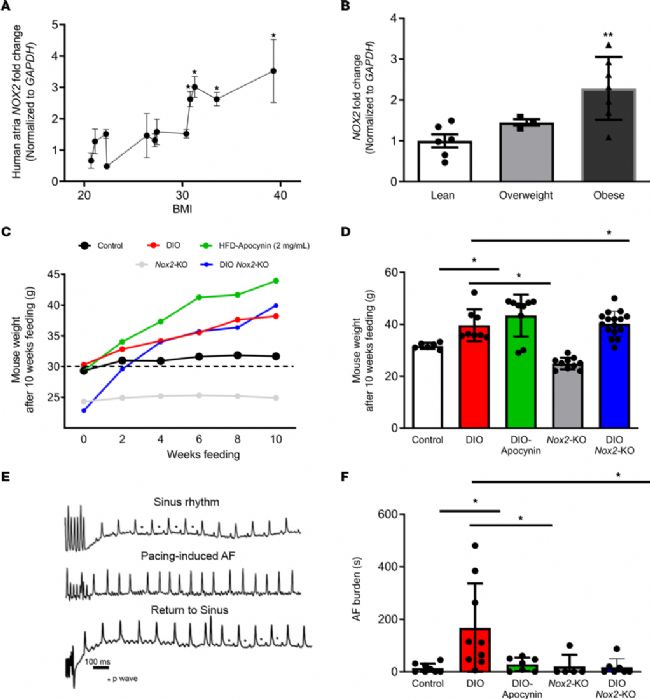
图1. NOX2 的遗传和药理抑制作用减少了肥胖介导的 AF
3. 抑制 Nox2 的表达使心房 APD 正常化从而逆转肥胖介导的房颤
为了评估 Nox2 缺失对心房心肌细胞的电生理学影响,分别检测四组小鼠心房心肌细胞的电生理变化。结果表明,与 DIO 小鼠相比,DIO Nox2-KO 小鼠的心房 AP 时程延长、最大 AP 振幅(APAmax)和上升速度(dV/dTmax)均显著升高。此外,DIO Nox2-KO 小鼠的心房 AP 与对照组和 Nox2-KO 小鼠非常相似,3 组间的 APD20、APD50、APD90、APAmax、dV/dTmax 均无变化。
4. DIO Nox2-KO 小鼠通过调节 INa 和 IKs 来恢复 APD
为了确定抑制 NOX2 蛋白表达对心房 INa 的影响,对 4 组小鼠进行了全细胞膜片钳检测,结果证明,与 DIO 小鼠相比,DIO Nox2-KO 小鼠的峰值 INa 密度显著增加,在所有测试电位下 INa 密度均恢复,与对照小鼠和 Nox2-KO 小鼠相似。此外,DIO Nox2-KO 和 DIO-Apocynin 小鼠中 Nav 1.5 蛋白表达也显著增加。已知 Nox2 的增加导致 PKC 亚型蛋白的表达增加从而下调 Nav 1.5 的表达最终抑制 INa。由此,对对照组、DIO、Nox2-KO 和 DIO Nox2-KO 小鼠进行免疫印迹检测,结果显示,敲除 Nox2 逆转了肥胖诱导的 PKC-α 和 PKC-δ 亚型蛋白表达的增加。
与 DIO 小鼠相比,DIO Nox2-KO 小鼠在 30 mV 和 50 mV 时的 IKs 密度显著降低。DIO Nox2-KO 小鼠 Kv 7.1 和 MinK 蛋白表达降低,但 Kv 1.5 主要钾通道保持不变。DIO Nox2-KO 小鼠显示编码 IKs 的 Kcnq1、Kcne1 和编码 IKur 的 Kcna5 的 mRNA 表达减少。最后,与 DIO 小鼠相比,DIO Nox2-KO 小鼠中 Kcnj3(乙酰胆碱活化钾通道(IKACh)的一部分)的表达显著降低。之前的研究表明,心房利钠肽(ANP)活性的增加可以调节含有 NPPA 突变的 hiPSC-aCMs 中的 IKs。与对照组相比,DIO 小鼠 ANP mRNA 和蛋白表达明显增加,而在 DIO Nox2-KO 小鼠中表达被抑制。
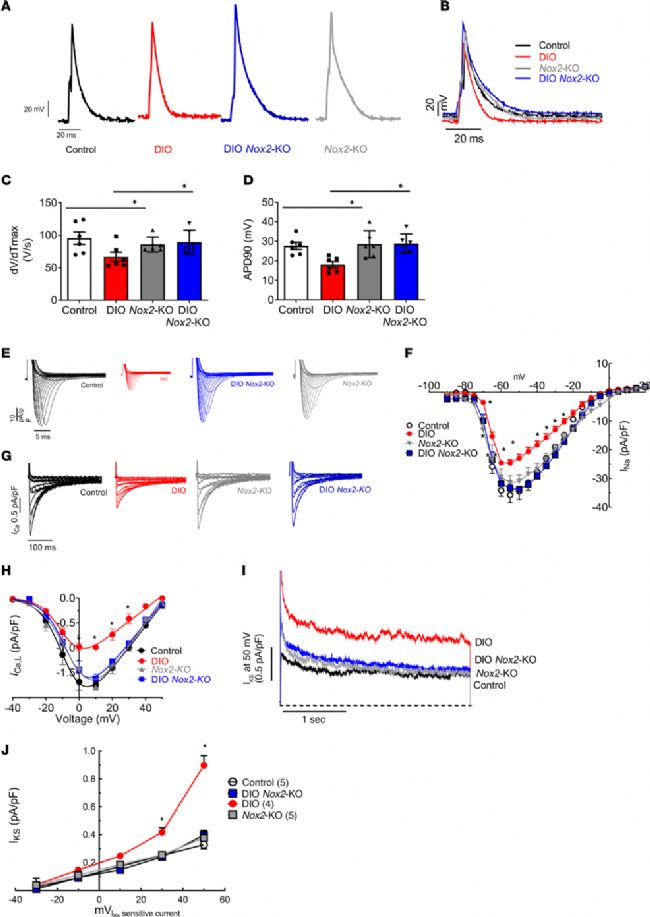
图2. DIO Nox2-KO 小鼠显示出心房动作电位的增加和肥胖诱导的离子通道重构的消除
5. 抑制 NOX2 的表达改善了 DIO 小鼠心房心肌细胞和 PA 处理的 hiPSC-aCMs 的收缩性
ICa,L 密度的降低是 DIO 小鼠心房电重构的一个标志。ICa,L 的减少抑制了肌浆网(SR)的钙释放和整体心房的收缩力。为了进一步评估这一变化,应用膜片钳技术分别对四组小鼠心房心肌细胞进行 ICa,L 的检测,并使用荧光钙染料 Fura-2 进行钙瞬变检测。实验结果表明,在 DIO Nox2-KO 小鼠中,ICa,L 减少得到了显著缓解并且 Ca2+ 浓度高于 DIO 小鼠心房细胞,说明 DIO Nox2- KO 小鼠肌浆网钙释放量的增加。与对照组和 DIO Nox2-KO 组小鼠心房细胞相比,DIO 组小鼠心房细胞肌节的缩短得到显著抑制。
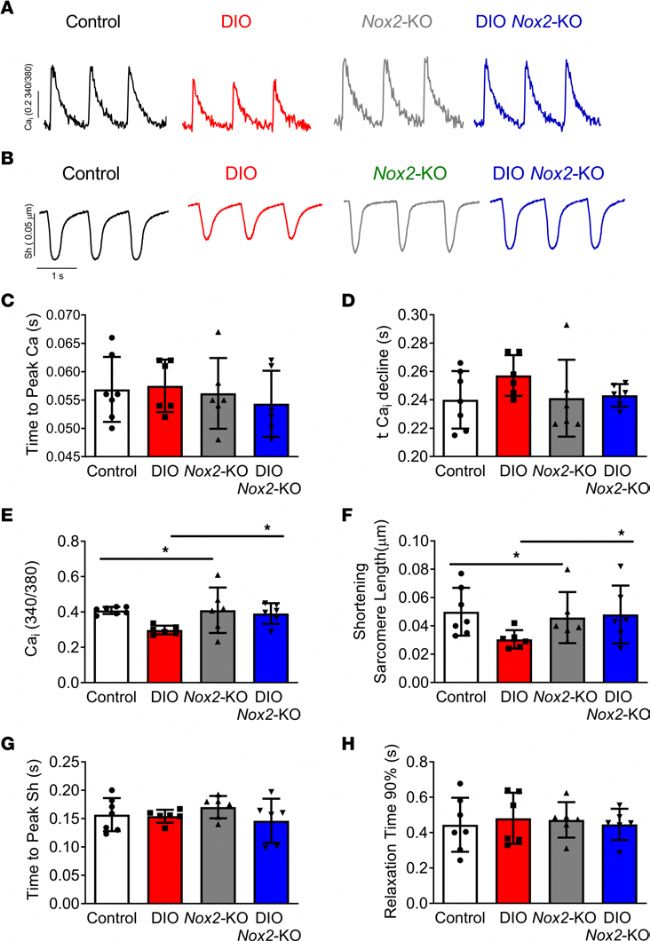
图3. NOX2 抑制可改善 DIO 小鼠的心房收缩力
6. 使用 NOX2 小分子抑制剂能够抑制 PA 处理的 hiPSC-aCMs 中 NOX2 的表达,逆转了肥胖诱导的离子通道重构
流式细胞计数法结果显示,与 DMSO 处理的细胞相比,视黄酸处理的细胞中表达 Kv 1.5 的细胞百分比显著增加,而表达心室标记物 MLC2v 的细胞百分比显著下降。为了探究 NOX2 在介导脂肪酸(FA)诱导的心房重构中的作用,本实验选用 PA 和 NOX2 小分子抑制剂 GSK-2795039(20μM,PA-GSK-hiPSC-aCMs)和油酸(OA)处理 5 天。荧光标测技术结果表明与 PA 处理的 hiPSC-aCMs 相比,PA-GSK-hiPSC-aCMs 的 APD10、APD50、APD90 均有所恢复。与 DIO 小鼠一样,经 PA 处理的 hiPSC-aCMs 也显示出 IKs 和总 IK 的增加,而在 PA-GSK-hiPSC-aCMs 中则被逆转。全细胞膜片钳检测结果显示,慢性 PA 治疗缩短了 APD 在20%、50% 和 90% 的复极化,而 OA 治疗显著延长了 APD50,增加了除极速度。与牛血清白蛋白(BSA)-hiPSC-aCMs 相比,PA-hiPSC-aCMs 的 AP 最大上升速度和最大(APAmax)振幅显著降低。此外,与对照组 hiPSC-aCMs 相比,PA-hiPSC-aCMs 也显示出 INa 和 ICa,L 密度的降低,而在 PA-GSK-hiPSC-aCMs 中则发生了逆转。因此,这提示在 DIO Nox2-KO 小鼠和 PA-GSK-hiPSC-aCMs 中,NOX2 的基因缺失和药理抑制消除了肥胖介导的心房 APD 缩短,并缓解了肥胖诱导的房颤。超声心动图分析显示,与对照组小鼠相比,DIO 小鼠的 LA 和 RA 均增大。其他超声心动图参数,如左心室射血分数、缩短分数、主动和被动心室充盈之间的脉搏波比 (A'/E')、心输出量和左心室后壁直径在 4 组小鼠中保持不变。
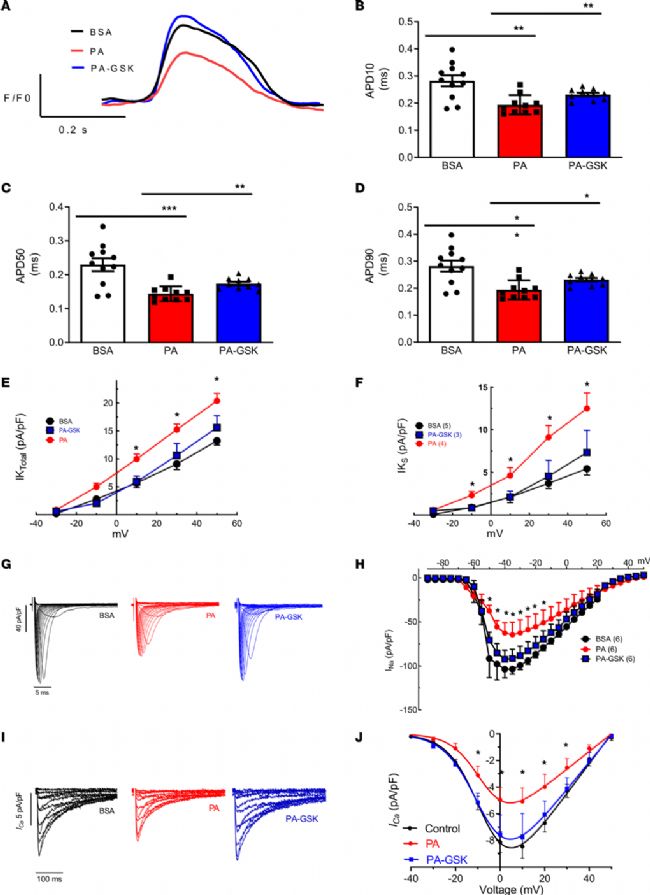
图4. 使用 NOX2 小分子抑制剂 GSK-2795039 对 PA 处理的 hiPSC-aCMs 进行抑制 NOX2 时,可以逆转肥胖诱导的离子通道重构
7. 抑制 NOX2 表达可预防肥胖介导的心房纤维化,增加心房 CV
为了研究传导的变化,采用 Langendorff 离体心脏灌流系统分别灌流对照组、DIO 组、Nox2-KO(Nox2 敲除)组和 DIO Nox2-KO 组小鼠离体心脏,进行心房和左心室的心外膜多通道电生理标测。实验结果表明,与对照组相比,DIO、Nox2-KO 和 DIO Nox2-KO 小鼠的心房和左心室的 CV 均减少。然而,与 DIO 小鼠相比,DIO Nox2-KO 小鼠的 LA、RA 和左心室 CV 均得到了改善。等时线图显示,与 DIO 小鼠相比,DIO Nox2-KO 小鼠的两个心房的 CV 均显著升高。然后,通过对四组小鼠心房组织进行天狼星红染色和 Masson 三色染色,确定抑制 NOX2 表达对肥胖诱导的心房纤维化的作用。结果表明,与对照组和 DIO Nox2-KO 小鼠相比,DIO 小鼠的 LA 和 RA 切片出现明显的纤维化。然而,4 组小鼠的心室切片纤维化程度没有差异。
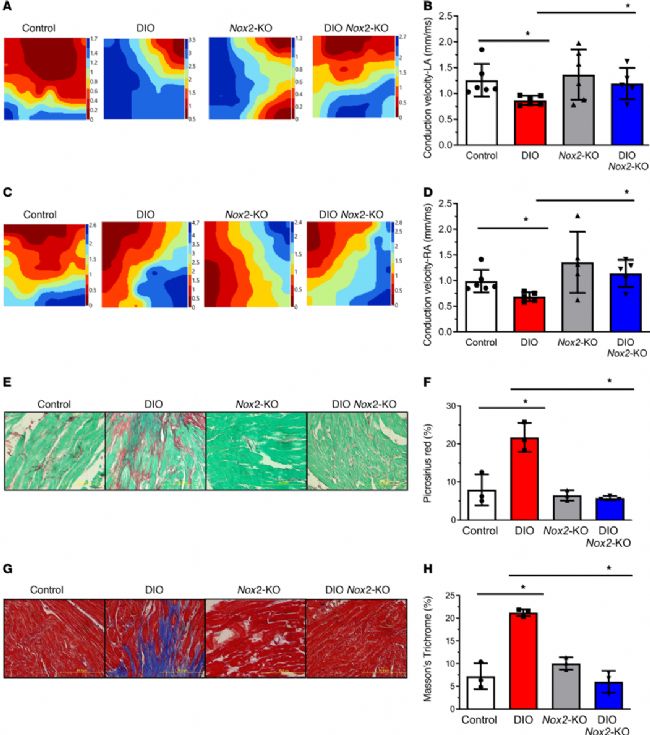
图5. NOX2 抑制可预防 DIO 小鼠的心房纤维化并增加心房 CV
8. 抑制 Nox2 表达降低了 DIO 小鼠和 PA-hiPSC-aCMs 中 ROS 的产生
使用 H2DCFDA 染色(一种成熟的可视化和定量胞质 ROS 的技术),评估了对照组小鼠、DIO 小鼠、Nox2-KO 小鼠、DIO Nox2-KO 心房心肌细胞和 BSA-、PA-、PA-GSK-hiPSC-aCMs 的 ROS 水平(在基线和染色 12 分钟后进行测量)。与对照组、Nox2-KO 和 DIO Nox2-KO 小鼠心房肌细胞不同,DIO 小鼠的 ROS 水平显著升高。这种增长持续了 12 分钟,这是 DIO 组独有的趋势。同样,与 BSA- 和 PA-GSK-hiPSC-aCMs 相比,PA 处理的 hiPSC-aCMs 从一开始就出现升高现象,并且在 12 分钟内持续显著升高。
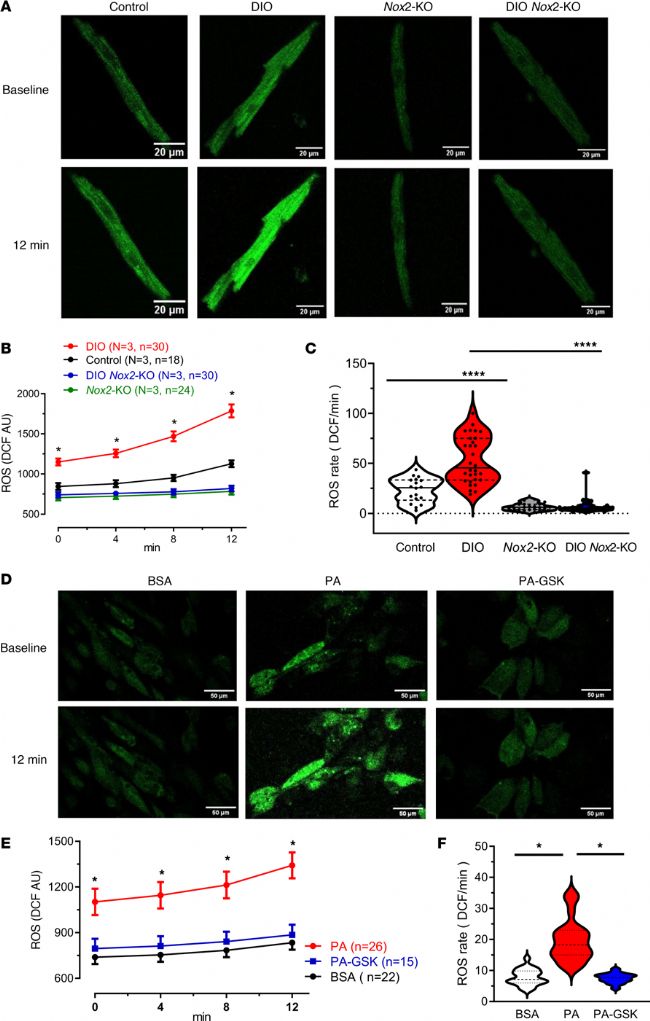
图6. 使用 NOX2 小分子抑制剂 GSK-2795039 对 PA 处理的 hiPSC-aCMs 的 NOX2 抑制逆转了肥胖诱导的离子通道重构
研究结论:
本研究强调了 NOX2 诱导生成的 ROS 和 PITX2 在肥胖介导的房颤中发挥的关键作用。机制研究表明,在肥胖小鼠、PA 处理的 hiPSC-aCMs 中以及敲除 NOX2 后,使用 NOX 阻滞剂和 NOX2 特异性抑制剂靶向心房氧化损伤和 ROS 产生,不仅可以预防和治疗 AF,还可以延缓肥胖个体中 AF 的进展。本课题研究结果对房颤肥胖患者的靶向治疗具有重要意义,靶向抑制 NOX2 可能是一种新的治疗肥胖患者的方法,并为肥胖介导的房颤患者提供新的辅助治疗方案。





