不同时期小鼠心肌细胞的分离方法
原代心肌细胞(CMs)是体外心脏生理和病理生理研究的宝贵材料。原代小鼠心肌细胞在不同发育阶段心肌细胞的增殖、凋亡、电生理、细胞内钙通量、收缩力学和蛋白质表达均有不同。分离不同阶段、获得活性较好的CMs最佳方法仍存在一些问题。
中国医学科学院、北京协和医学院国家心血管病中心阜外医院心血管病国家重点实验室聂宇教授团队在《Journal of Molecular and Cellular Cardiology》上发表了题为“Methods of mouse cardiomyocyte isolation from postnatal heart”的文章。文章优化了小鼠从胚胎期到成年期分离高质量CMs的方案,为心血管疾病的机制、病理和药理学研究提供了支持。

分离方法和结果:
2.1 胚胎期14.5天(E14.5)小鼠CMs的分离与评价
由于组织致密性低,胚胎心脏的分离采用传统的胰蛋白酶消化。
2.1.1 E14.5小鼠CMs的分离
(1)用异氟醚麻醉孕小鼠,在体视显微镜下,取出胚胎心脏。
(2)在磷酸盐缓冲液(PBS)中去除心房,心室剪至1 mm3大小。
(3)心室用0.25% Trypsin-EDTA,37℃水浴消化,每10-15分钟轻拍三次,使细胞分散。
注:胰蛋白酶体积由心脏大小和数量决定。通常500 μL 0.25% Trypsin-EDTA,可解离10个E14.5心脏。
(4) 当观察不到明显组织时,加入含有10% FBS的DMEM培养基,停止消化。
(5) 用100 μm滤网过滤细胞悬液,300 ×g,离心5 min,小心抽吸上清液。
(6) 加入红细胞溶解液,去除红细胞。孵育3-5 min后,300 ×g,离心5分钟,小心抽吸上清液。
(7) 将含CMs和非CMs的细胞沉淀物用PBS洗涤一次,然后用含10% FBS的DMEM重悬。
(8) 采用梯度沉降法分离CMs。将心肌细胞置于含有10% FBS的DMEM培养皿中,37℃,5% CO2,培养90 min,去除附着的非CMs,收获主要含有CMs的细胞悬液。
2.1.2 检测分离得到的E14.5 CMs的活力、产量、形态,纯度和大小
Countstar仪器测定表明,分离的E14.5 CMs具有较高的生存率(> 90%)和产量((2.5±0.2)× 105)。培养24小时后,CMs分布良好,呈梭状多边形。E14.5 CMs中α-actinin+细胞的比例为87.67±1.25%(图1)。培养过夜,α-actinin免疫荧光染色显示典型的CM形态结构。E14.5 CMs的长度为37.9±5.2 μm,宽度为12.5±4.0 μm。
这些结果表明,传统的胰蛋白酶消化法适用于制备胚胎小鼠CMs,具有较高的存活率、产量和纯度。
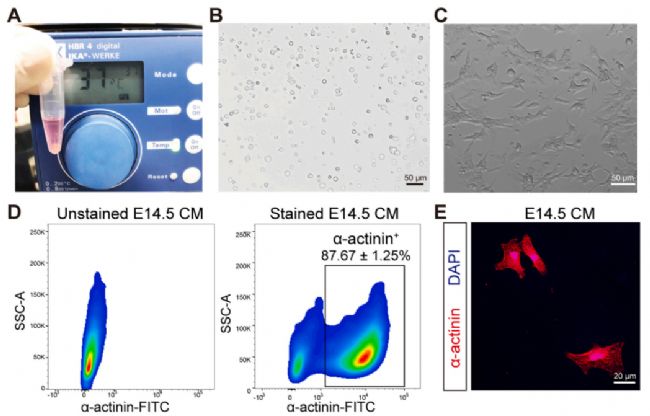
图1 E14.5小鼠CMs的分离
2.2 出生后第1天(P1)小鼠CMs的分离与评价
新生期心脏分离试剂盒用于从新生小鼠心脏中温和快速地产生单细胞悬液,结合Gentle MACS™解离器,获得高产量的CMs。
(1)麻醉P1小鼠,取心脏。
(2)在PBS中去除心房,将心室放入C-tube中,使用新生期心脏分离试剂盒。
注:心室未被剪成小块。每2.5 mL酶混合物可处理多达20个的新生小鼠心脏。当处理更多的心脏时,所有的试剂体积相应增加。
(3)将C-tube中的心室置于Gentle MACS Octo解离器中,使用37°C_mr_NHDK的程序进行消化。消化时间约为56分钟。
(4)如果没有Gentle MACS™解离器,新生期心脏可以用新生期心脏解离试剂盒,37°C水浴分离,每15-20分钟轻弹三次。
(5)结束时,立即加入含10% FBS的DMEM,终止消化。
注意:在分离结束时,使用含有10% FBS的预热DMEM立即终止消化,以避免过度消化导致CMs活力和产量降低。
(6)用100 μm滤网过滤细胞悬液,300 ×g,离心5 min,小心吸取上清液。
注:每次离心后,轻拍CMs,使细胞分散。避免剧烈的涡旋和移液对CMs的损害。
(7) 加入红细胞溶解液,去除红细胞。孵育3-5分钟后,300 ×g,离心5分钟。小心吸取上清液。
(8) 将含CMs和非CMs的细胞沉淀物用PBS洗涤一次,然后用含10% FBS的DMEM重悬。
(9) 采用梯度沉降法分离CMs。将心肌细胞置于含有10% FBS的DMEM培养皿中,37℃,5% CO2,培养90 min,去除附着的非CMs,收获主要含有CMs的细胞悬液。
2.2.2 P1 CMs的活力、产量、形态、纯度和大小
使用Gentle MACS方法,每颗心脏产生约4.2 × 105 CMs,平均存活率为96%。培养24 h后,CMs伸展良好,呈现梭形多边形样。分离的P1 CM检测,约84%的细胞为α-actinin+(图2)。
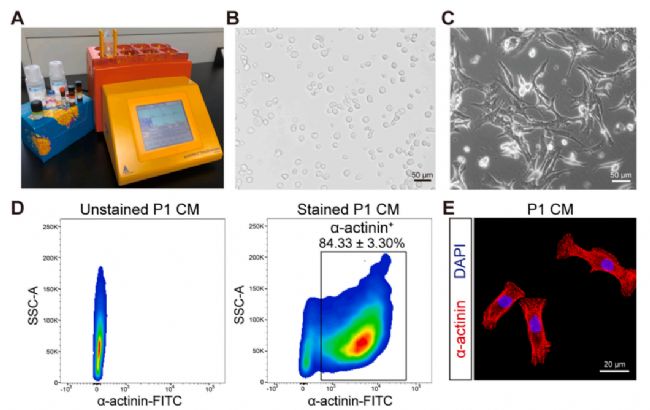
图2 P1小鼠CMs的分离
2.3 P4和P7小鼠CMs的分离
Gentle MACS方法分离P4和P7小鼠心脏,然而,获得的CMs细胞活力较低,杆状细胞较少。因此,采用另一种方法Langendorff-free perfusion method分离P4和P7小鼠心脏。
2.3.1 采用Langendorff-free法分离P4和P7小鼠CMs
(1)用异氟醚麻醉P4或P7小鼠,固定在解剖平台上。
(2)切开下腔静脉和腹主动脉放血。
(3)打开胸腔,充分暴露心脏,将EDTA缓冲液恒速缓慢的注入右心室(RV)顶点。
(4)打开升主动脉,用Lahey钳夹住。
(5)立即将心脏移入装有EDTA缓冲液的6 cm培养皿中,将EDTA缓冲液恒速缓慢的注入左心室心尖。
(6)然后将心脏转移到灌注液的6 cm培养皿中,灌注液以恒速缓慢注入左室。
注:在整个心脏灌注步骤中,使用加热毯保持温度在37℃,以获得高活力的高数量CMs。
(7) 然后将心脏移入含有胶原酶缓冲液(预热至37℃)的6 cm培养皿中,将胶原酶缓冲液恒速缓慢注入左室,直至心脏变白变软。
注:严格控制缓冲液的灌注速度,以获得更多的杆状CMs。速度过高会导致细胞破裂,杆状细胞减少。灌注速率约为4-5 mL / min。
(8) 取下钳,用微型剪剪开心室至1 mm3大小,然后轻轻移液。
(9) 终止缓冲液停止消化,100 μm滤网过滤细胞悬液。
(10) 室温下,多次自然重力沉降(每次20 min),收集含CMs颗粒。悬浮液中未沉淀的细胞为非CMs细胞,通过300 ×g,离心5 min,可收集非CMs进行研究。
注:P4和P7小鼠CMs也可以通过低速离心(室温下,约20 ×g ,3分钟)沉淀,以获得高产量的棒状CMs。
2.3.2 P4和P7 CMs的活力、产量、形态、纯度和大小
P4和P7 CM的杆状细胞存活率分别高达84%和75%。CM产率分别为每颗心脏7.2(±0.2)× 105 和8.2(±0.4)× 105 CMs,表现出典型的CM形态结构,肌丝排列有序,CM的纯度大概达到80%(图3)。P4和P7 CMs的长度分别为58.7±10.7 μm和69.3±9.0 μm,宽度分别为12.4±5.8 μm和12.5±2.9 μm。
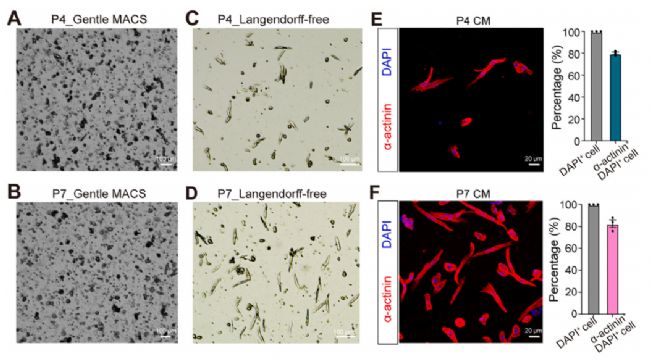
图3 P4和P7小鼠CMs的分离
首先采用了langendorff -free灌注分离P14小鼠心脏,获得每心脏产生8.8(±0.7)× 105 CMs和82%±2.2% 的活的杆状CMs。此外,也使用了Langendorff灌注分离成年的CMs。
2.4.1 Langendorff灌注系统分离P14小鼠CMs
(1)用异氟烷麻醉P14小鼠,固定在解剖平台上。
(2)沿剑突打开胸腔,尽可能清晰地暴露心脏。
(3)然后迅速找到主动脉,用镊子固定,剪下心脏。将心脏置于预冷灌注液中,并迅速冲洗。
(4)心脏自然泵出血液后,快速找到主动脉,适当切开。
(5)将5 ml注射器针头插入主动脉口,悬挂心脏。
(6)灌注液灌注心脏3-5 min,灌注速率约为4 - 5 mL / min。
(7)预热胶原酶液,消化心脏。心脏在前10分钟逐渐僵硬、肿胀、变白,然后慢慢软化。
(8)约30 min后,心脏变白变软,置于胶原酶缓冲液中。分离心室至1 mm3大小,然后轻轻移液。
(9)终止缓冲液停止消化,100 μm滤网过滤细胞悬液。
(10)室温下进行多轮自然重力沉降(每次20 min),收集含CMs颗粒。悬浮液中未沉淀的细胞为非CMs细胞,通过300 ×g,离心5 min,可收集非CMs进行研究。
2.4.2 P14 CMs的活力、产量、形态、纯度和大小
该方法每心脏产生8.6(±0.5)× 105 CMs和79%±3.3%的活的杆状CMs(图4)。P14 CMs中α-actinin+ DAPI+/DAPI+细胞的比例大于90%,存在大量多核多倍体CMs。P14 CMs的长度为78.6±12.1 μm,宽度为16.5±2.8 μm。
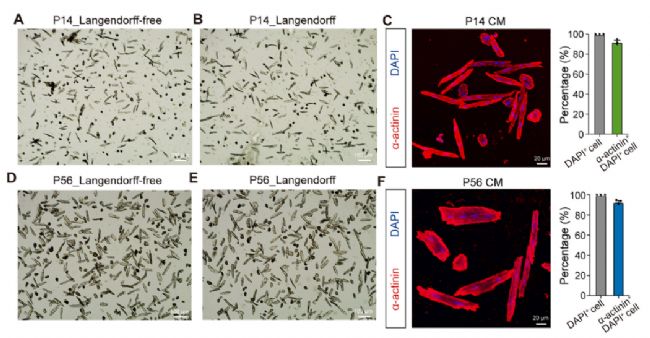
图4 P14和P56小鼠CMs的分离
2.4.3 P56小鼠CMs的分离
采用Langendorf-free灌注法和Langendorff灌注系统对P56小鼠心脏进行灌注。两种方法的杆状CMs百分比相似(> 76%),每心脏约为9× 105 CMs(图4)。P56 CMs中α-actinin+ DAPI+/DAPI+细胞的比例约为93%(图4)。P56 CMs长85.3±16.0 μm,宽27.6±9.9 μm。
(1) 分离的P56小鼠CMs进行连续4轮重力沉降,使用3种复钙缓冲液,使钙浓度逐渐恢复到生理水平。
(2) 每轮的细胞颗粒都富集了CM,最终得到了高纯度的CM颗粒。
(3) 将CMs重悬于预热的培养液中,在加湿组织培养箱(37◦C, 5% CO2)中以不同的应用密度,种植在预先涂有laminin(5 μg/mL)的组织培养塑料或玻璃皿上。
(4) 孵育1 h后,将培养液换为新鲜、预热的培养基。
(5) 培养CMs用于后续实验。培养基每48 h更新一次。
2.5 分离的CMs的RNA测序
我们对不同发育阶段分离的小鼠CMs进行了RNA测序(RNA- seq)。转录组学数据的主成分分析(PCA)显示,CM组按发育阶段聚类,包括E14.5、P1、P4、P7、P14和P56阶段,每个发育阶段对应的3个生物重复呈现一致的聚类。结果显示,在所有分离的CM中,非CM标记基因均低表达,包括成纤维细胞标记Pdgfra、内皮细胞标记Pecam1、血管平滑肌细胞标记Myh11、白细胞标记Ptprc、巨噬细胞标记Adgre1、单核细胞标记Itgal、T细胞标记Cd3g和B细胞标记Cd79a(图5),表明分离的CMs具有较高的纯度。
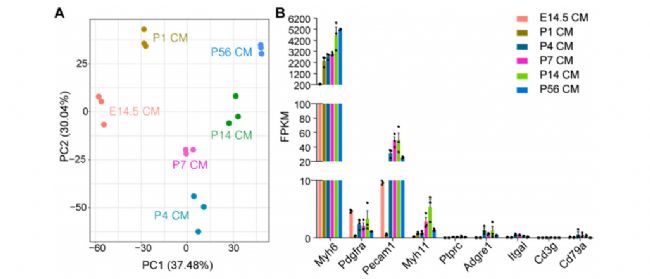
图5 不同年龄小鼠分离的CMs的RNA序列分析
2.6 血管紧张素II(Ang II)干预后CM随时间的活性和细胞功能的评估
使用CCK-8试剂盒测量P1 CMs的活力,在前3-4天CM的活力升高,随后CM活力逐渐下降。而P56 CM的活力随着时间的推移逐渐下降。在第4天,大约50%的P56 CMs仍有活力,在第14天几乎没有观察到有活力的CMs(图6)。
用Ang II处理P1和P56 CM 48小时后,细胞大小均增加。
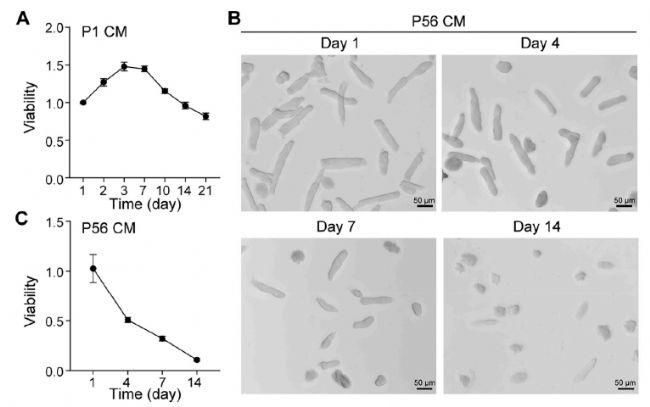
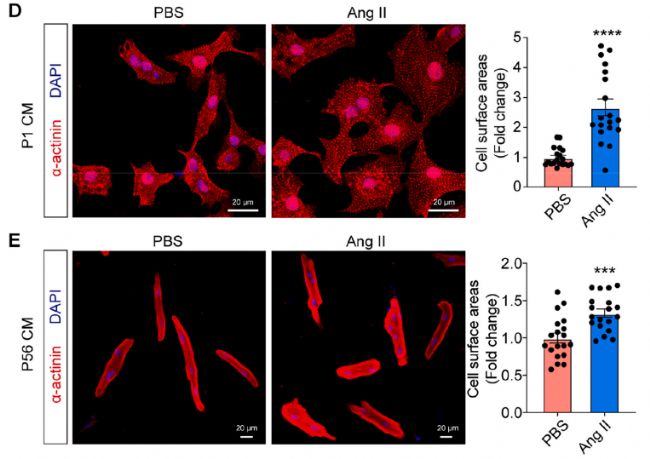
图6 血管紧张素II(Ang II)干预后CM随时间的活性和细胞功能的评估





