利用Scn5a 的体内碱基编辑技术实现对长QT综合征小鼠模型的基因治疗
遗传性心律失常是死亡的一个重要原因,导致心脏性猝死的比例高达 12% 至 20%。编码心脏离子通道和相关蛋白的基因中的致病性变异 (PV) 会损害其转录、组装、运输和门控, 导致长 QT 综合征 (LQTS)类型(LQT1、LQT2 和 LQT3)、 短 QT 综合征、 Brugada 综合征、儿茶酚胺多形性室性心动过速和病窦综合征。虽然有预防心律失常和心源性猝死的方法,但它们往往还会引起副作用。如β-受体阻滞剂在临床上用于治疗 LQTS, 但心血管事件和猝死仍然会发生。因此,对该疾病的永久治疗确实存在未满足的需求。迄今为止,预防遗传性心律失常最有前途的治疗策略是通过使用基因编辑工具直接靶向突变基因来消除遗传性基因损伤。
编码心脏钠通道α亚基(Nav1.5)的基因Scn5a发生变异是该类疾病产生的原因之一,称为3型长QT综合征(LQT3)。为了研究碱基编辑工具对LQT3的治疗作用,近日,中国医学科学院阜外医院兰峰教授、复旦大学王永明教授等团队,在顶刊《Circulation》发表了题目为“In vivo base editing of Scn5a rescues type 3 long QT syndrome in mice” 的相关研究论文,在这项研究中利用Scn5a的体内碱基编辑技术实现对长QT综合征小鼠模型的基因治疗。

文中采用荧光标测技术(Optical Mapping,MappingLab,UK)检测不同小鼠模型的动作电位信号,清晰描绘出各组模型的心脏动作电位各项指标的变化。同时采用全细胞膜片钳检测了不同模型组离体心室心肌细胞的动作电位和钠电流的变化。
结果:
1.构建LQT3小鼠模型
在本研究中,使用双腺相关病毒血清型9(AAV9) 传递腺嘌呤碱基编辑器 ABE (ABE max31) 对 Scn5a 进行碱基编辑(图1),将患者的致病突变T1307M引入到小鼠的Scn5a基因上,构建了携带Scn5a T1307M致病性变异的LQT3小鼠模型。小鼠模型表现出LQT3患者的心电图特征-QT及QTc延长。另外,在卡巴胆碱降低心率后,小鼠模型心脏窦性停搏增加;同时卡巴胆碱可诱导纯合小鼠模型产生室性心动过速(图2)。

图1.通过碱基编辑器对出生后小鼠心脏中的 Scn5a 基因组进行编辑
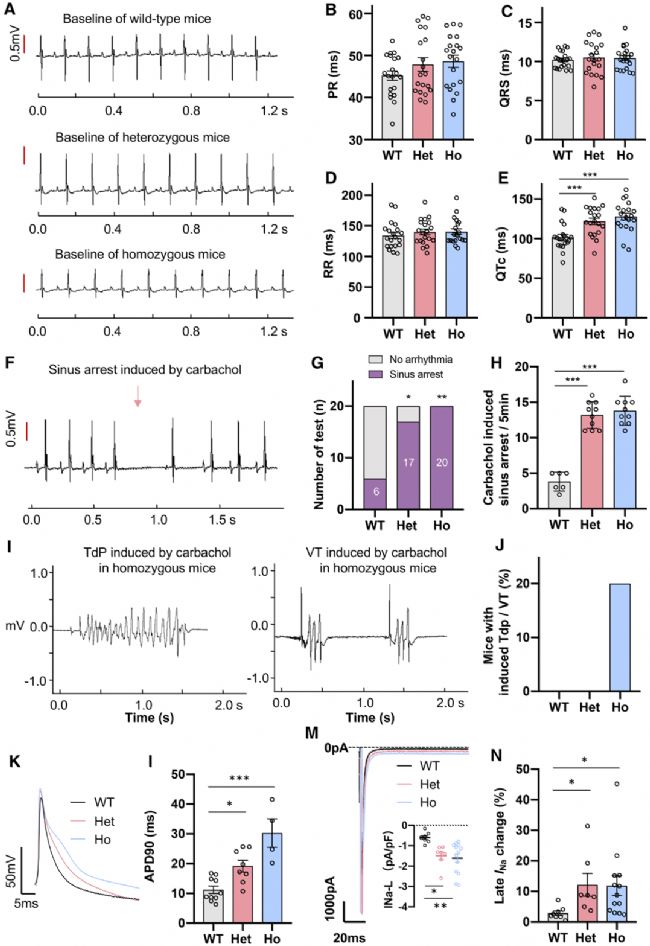
图2.携带Scn5a T1307M致病性变异的LQT3小鼠模型的生成
同时还对小鼠模型离体心脏进行了光学标测,结果显示,与 WT 小鼠相比,心室传导无差异,但杂合子和纯合子 T1307M 小鼠的心室动作电位时程 APD90显著延长,APD30 / APD80比率增加(图 S8)。当从心尖给予 8 Hz 刺激时,获得了一致的结果。然后,我们通过全细胞膜片钳检测了离体心室心肌细胞的动作电位和钠电流。与 WT 肌细胞相比,Scn5a T1307M心肌细胞的晚期钠电流密度显著增加,都体现了人类LQT3的疾病表型。以上结果说明模型构建成功。
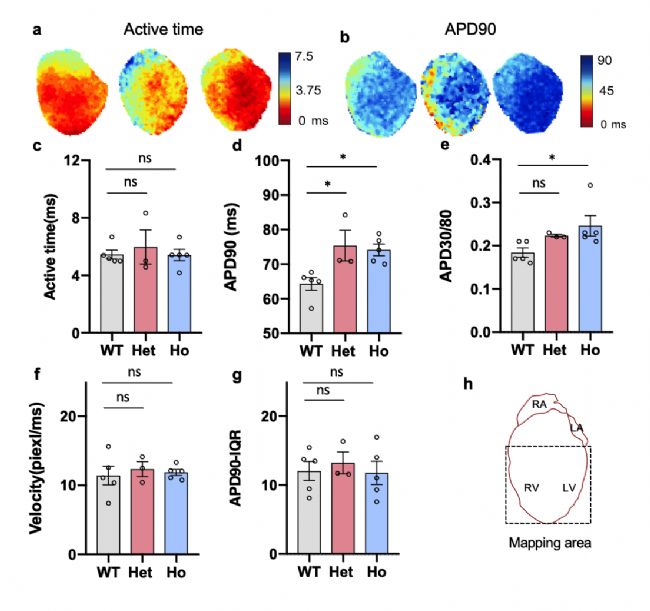
图S8. 自发节律下离体心脏的光学标测
2. ABE 对 Scn5a T1307M 的体内校正并减轻了LQT3表型
T1307M突变是由碱基C变成T形成的。ABE碱基编辑器能将T转变成C,进而纠正碱基突变。实验中采用反式剪接将ABE分成两段后,利用AAV9送到小鼠体内。单次腹腔注射AAV9-ABE 病毒可以实现~40%的DNA纠正及~70%的mRNA纠正。而AAV9主要是感染心肌细胞,Scn5a主要在心肌细胞中表达,所以在Scn5a mRNA水平的纠正效率高。这些发现表明 ABE 可以有效纠正小鼠心脏中的 Scn5a T1307M 序列变异。ABE治疗还减少了杂合子和纯合小鼠中由卡巴胆碱给药引起的心窦骤停,并消除了纯合子 Scn5a T1307M 小鼠中卡巴胆碱诱导的 TdP 或 VT(图3)。以上结果说明碱基编辑技术针对心肌细胞的基因编辑治疗对于电生理功能表型是有效和安全的,可以有效的减轻 LQT3 表型。
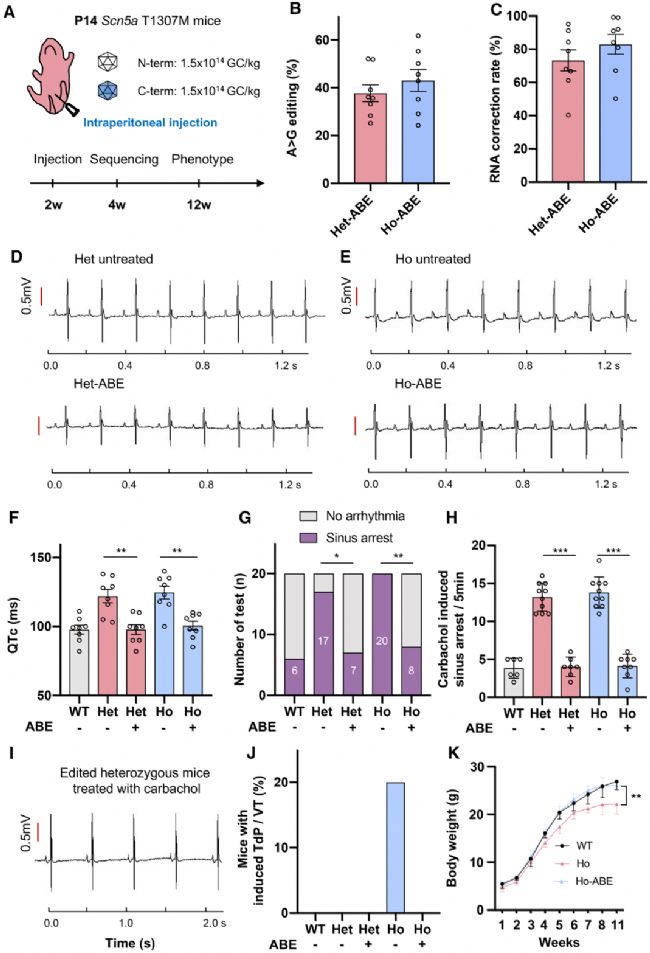
图3. 体内碱基编辑技术减轻了 LQT3 表型。
3.T1307M小鼠碱基编辑的治疗阈值及脱靶效应检测
为了探究多高的编辑效率可以治疗 LQT3 表型,研究人员向新生2周龄的杂合小鼠腹腔注射AAV9-ABE病毒。10周后,观察到 T1307M mRNA的修正率从 23.29% 到 95.72% 不等。将mRNA修正率与 QT间期以及窦性停搏次数关联。结果显示随着修正率的增加,QT及QTc间期逐渐缩短,卡巴胆碱诱导的窦性停搏次数逐渐下降(图4),即使较低的编辑效率,也能减轻长QT的表型。
当mRNA 的修正率超过60%时,可完全消除杂合小鼠的心律失常表型。同时,在纯合T1307M小鼠中,碱基编辑还消除了致命性室性心动过速(图4)。这些结果表明编辑效率达到一定的阈值时,可以完全消除心律失常表型。
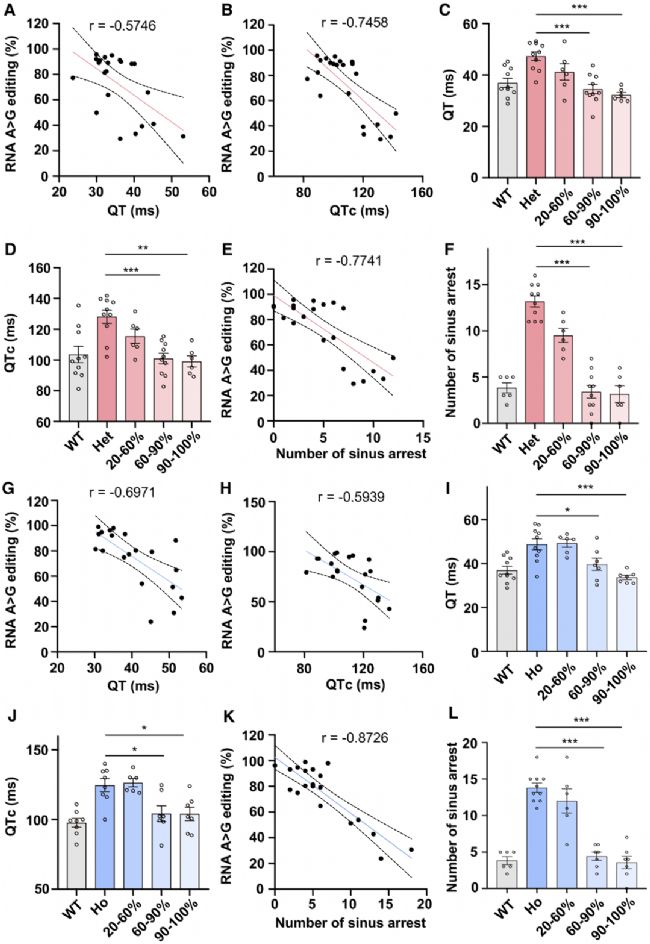
图4.T1307M小鼠碱基编辑的治疗阈值
为了评价ABE心脏治疗的安全性,研究人员对基因编辑后的心脏DNA进行全转录组测序,测序结果并未发现明显的DNA或RNA脱靶(图5)。碱基编辑也没有引发额外的心率失常。这些结果表明 ABE 是一种安全的体内心脏编辑工具。

图5.碱基编辑器的脱靶效应检测

图6.总体示意图模型
总之,这些研究表明,体内 AAV9-ABEmax 编辑可以纠正变异的 Scn5a 等位基因,有效改善心律失常表型。为遗传性心律失常的治疗提供了有效的概念性证明。





