使用安捷伦 Seahorse XF 实时 ATP 速率测定试剂盒检测代谢调节

摘要
细胞生物能量代谢的调控被视为癌细胞增殖的关键驱动因素。鉴别调节生物能量代谢的关键通路是一种开发用于癌症治疗的新治疗靶标的颇具前景的策略。对活细胞中糖酵解和线粒体产生三磷酸腺苷 (ATP) 的速率进行同步定量,为研究细胞生物能量代谢提供了重要视角。将安捷伦 Seahorse XF 实时 ATP 速率测定试剂盒与最新的数据分析软件相结合,应用新型工作流程对调节癌细胞代谢的药剂进行快速功能筛选。本应用简报介绍了 XF 实时 ATP 速率测定数据在选择代谢调节剂和评估药物效力方面所提供的丰富的信息。还展示了使用激酶抑制剂库进行抗癌药物筛选的工作流程。该工作流程可用于鉴别靶向癌细胞代谢的药物化合物或影响线粒体和糖酵解代谢的药物靶标。
前言
癌细胞在肿瘤发生发展过程中会经历代谢重编程。针对癌细胞代谢特性寻找治疗靶标方面已经取得了重大进展[1]。此外,更好地了解癌细胞代谢可以提供有关恶劣肿瘤微环境的宝贵信息,从而可大幅改善实体瘤新兴免疫疗法的疗效[2,3]。对于省时且稳定的分析工具的需求也在不断增长,以探索调节癌细胞代谢的药物靶标和基因。
XF 实时 ATP 速率测定能够同时定量糖酵解和线粒体呼吸 ATP 产生速率。它使用 ATP 产生速率作为定量生物能量代谢活动的通用单位,对细胞能量表型进行定量表征。该测定旨在通过连续进样寡霉素以及鱼藤酮与抗霉素 A 的混合物来测量细胞的实时耗氧率和质子释放率。它能够计算多个细胞生物能量代谢参数,包括来自单个样品和测定的 (1) 线粒体 ATP 产生速率(mitoATP 速率)、(2) 糖酵解 ATP 产生速率(glycoATP 速率)、(3) 总 ATP 产生速率(总 ATP 速率)和 (4) XF ATP 速率指数[4]。
XF 实时 ATP 速率测定是筛选和考察调节细胞生物能量代谢的候选物的强大工具,作为一种起始测定方法,它具有多项优势。首先,该测定提供了一种灵敏且直接的方法来检测基础代谢表型的变化。由于该测定同时测量两条主要生物能量代谢通路的ATP 产生,因此能够实时快速鉴别线粒体呼吸与糖酵解之间碳源使用的切换。此外,通过利用两种代谢活动的 ATP 产生速率的通用单位,可以通过两个参数之间的占比(糖酵解百分比 vs. 氧化磷酸化百分比)或比率(ATP 速率指数)来定量评估代谢变化。
其次,这种实时分析能够鉴别细胞代谢表型的动态变化,而通过广泛使用的荧光或发光探针测量细胞内 ATP 浓度则无法检测到这些变化。在活细胞中,通过调整 ATP 产生和消耗的速率,细胞内 ATP 浓度受到严格调节并维持在稳态水平。换句话说,细胞通过响应执行任何细胞功能所需的 ATP 消耗的变化来增加或减少 ATP 的产生,反之亦然。由于细胞 ATP 水平的显著改变表明发生了灾难性事件,因此它们仅适用于评估细胞活力[5,6]。相比之下,使用 XF 实时 ATP 速率测定来实时测量ATP 产生速率能够测量总细胞能量生成代谢的变化。这些变化可用于评估细胞功能(例如活化、分化等),以及区分对个体生物能量代谢通路的影响,尽管其对细胞活力没有显著影响。第三,由于它测量基础代谢率,因此该测定仅需先后进样两次试剂,且试剂具有宽最佳浓度范围。无需额外的试剂优化步骤。这一优势简化了测定工作流程,特别是在筛选包含基因修饰的多个细胞系或细胞中的线粒体功能障碍时。最后,可用于该测定的定制软件工具能够快速定量测量由化学刺激或基因修饰引起的代谢干扰,包括筛选和剂量反应分析功能。
实验部分
XF 实时 ATP 速率测定
ATP 产生速率按照《XF 实时 ATP 速率测定用户指南》[7]中所述进行测量。
将 A549 (ATCC) 和 PC-9 (ECACC) 细胞在补充有 2 mmol/L GlutaMax (Gibco) 和 10% 胎牛血清 (FBS, HyClone) 的 RPMI 1640 (Gibco) 中培养。将细胞以 1 × 104 个细胞/孔的密度接种到安捷伦 Seahorse XF Pro M 细胞培养微孔板中,并培养过夜。测定当天,将培养基更换为补充有 10 mmol/L 葡萄糖、1 mmol/L 丙酮酸钠和 2 mmol/L 谷氨酰胺的 Seahorse XF RPMI 培养基 (pH 7.4),在 37 °C 和不含 CO2 的条件下,将细胞分别在添加或不添加 1 µmol/L CB-839 或 BAY-876 的情况下孵育1 小时。测定结束后,使用 BioTek Cytation 1 细胞成像多功能微孔板检测系统和安捷伦 Seahorse XF 成像和归一化系统对细胞计数以实现数据归一化。所有关键参数和图表均使用Seahorse Analytics 生成。
表 1 列出了运行 XF 实时 ATP 速率测定以进行筛选和剂量反应研究所需的安捷伦产品。有关所有培养基类型的完整列表以及我们针对每种检测试剂盒的建议,请参阅《安捷伦 Seahorse XF 培养基选择指南》[8]。
激酶抑制剂库筛选
将 THP-1 和 PBMC 细胞分别在补充有 10% FBS 和 β-巯基乙醇的 RPMI 1640(货号 A1049101,Gibco)和 Immunocult-XF T 细胞扩增培养基(货号 10981,STEMCELL Technologies)中培养。将细胞重悬于补充有 10 mmol/L 葡萄糖、1 mmol/L 丙酮酸钠和 2 mmol/L 谷氨酰胺的 XF RPMI pH 7.4 测定培养基(安捷伦)中,并以 2 × 105 个细胞/孔接种到安捷伦 Seahorse XFe96/XF Pro PDL 板上。每次测定前,将细胞在含有1 µmol/L 或 10 µmol/L 的 80 种不同激酶抑制剂(SCREEN-WELL 激酶抑制剂库,货号 BML-2832,Enzo Life Sciences)的条件下孵育 1 小时,而溶剂对照组在含有 0.1% DMSO 的条件下孵育。
表 1. 用于筛选和剂量反应分析的 XF 实时 ATP 速率测定所需的关键产品
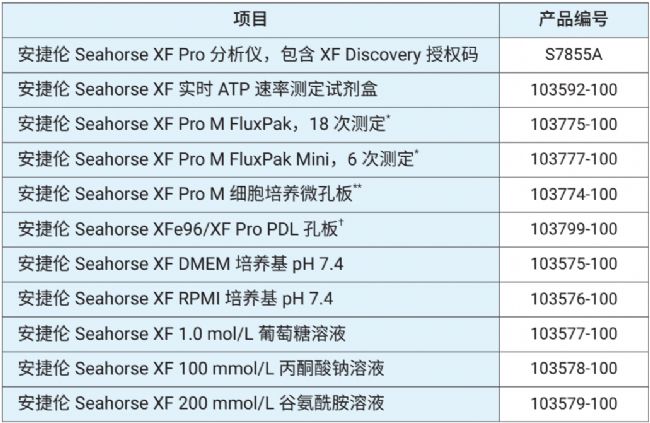
** 货号 103774-100 不包含进行 XF 测定所需的 XF 探针板。只有当需要其他孔板来优化接种密度时才需要这个货号的产品
† 货号 103799-100 不包含 XF 探针板。仅当存在非贴壁血癌细胞或免疫细胞时才需要此货号
使用安捷伦 Bravo 液体处理器进行自动化测定设置
利用安捷伦 Bravo 液体处理器简化测定前处理。在所有测定中使用 Bravo 进行细胞清洗,每孔留 100 µL 的最终体积,为添加 100 µL 的 2x 预处理溶液做准备。对于库筛选,利用 Bravo 制备化合物,并在洗板后将化合物转移到细胞板中。在此过程中使用的实验耗材如《Bravo Seahorse 实验工作台用户指南》所述[9]。细胞清洗方案采用对《用于 Seahorse XFe96 样品前处理的 Bravo 工作流程》[10] 中的方案进行修改后的方案。在 96 孔储液槽中进行连续稀释和化合物库稀释,仅需一步即可转移预处理溶液。加药口采用手动加药。如有需要,也可以使用 Bravo 完成此步骤。
CellTiter-Glo 测定
为测量总 ATP 水平,将 A549 或 PC-9 细胞以 2 × 104 个细胞接种到传统白色 96 孔板 (Greiner) 中。暴露于代谢调节剂 1 小时后,根据制造商提供的手册,使用 CellTiter-Glo (Promega) 试剂盒测量总 ATP 水平。
结果与讨论
生物能量代谢表型变化的实时定量
如上所述,细胞内 ATP 水平或含量的测量常用于评估细胞活力。相比之下,在非致死或亚致死条件下,XF 实时 ATP 速率测定可提供比 ATP 的静态量更多的有关细胞代谢表型的信息。为证明该方法检测不影响细胞内 ATP 水平的代谢变化的灵敏度,对两种非小细胞肺癌细胞系 A549 和 PC-9 在以下两种代谢抑制剂中暴露 1 小时所获得的结果进行了比较:CB-839,一种谷氨酰胺合酶抑制剂 (Selleck Chemicals);和 BAY-876,一种 Glut1 葡萄糖转运蛋白抑制剂 (Selleck Chemicals)。
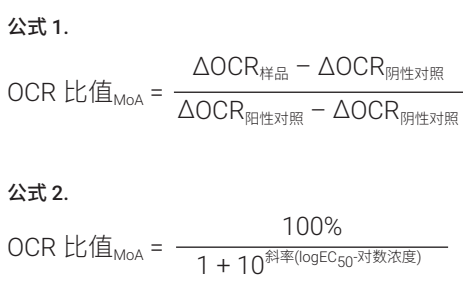
图 1A 显示出在所示处理后测得的细胞内 ATP 水平的变化,表明在处理期间,无任何抑制剂导致测试的任一细胞系的细胞活力发生显著变化。当测量总 ATP 产生速率时,观察到类似的结果,在细胞暴露于 CB-839 后,仅观察到 ATP 产生速率发生小幅下降(图 1B)。相比之下,当单独分析线粒体呼吸和糖酵解 ATP 产生速率时,在暴露于 CB-839 和 BAY-876 后分别观察到显著下降,因为相互代谢通路上调以补偿抑制作用(图 1C 和 1D)。因此,在这两种细胞系中,用代谢抑制剂进行处理导致细胞代谢表型发生了剧烈变化。CB-839 将细胞转变为更偏向糖酵解的表型,而 BAY-876 则将细胞转变为更偏向有氧的表型(图 1E),而总产生速率几乎保持不变(图 1B)。

图 1. 使用 XF 实时 ATP 速率测定检测线粒体和糖酵解调节剂。将 A549 和 PC-9 细胞用溶剂对照 (0.1% DMSO)、1 µmol/L CB-839 或 1 µmol/L BAY-876 预处理 1 小时,并分析静态细胞内 ATP 水平 (A) 和 ATP 产生速率(B 至 E)。(A) 利用 CellTiter-Glo 测得的细胞内 ATP 浓度。(B) 总 ATP 产生速率。(C) 线粒体 ATP 产生速率。(D) 糖酵解 ATP 产生速率。(E) ATP 速率指数。(n = 6,平均值 ± SD)
此外,除监测抑制剂所引起的代谢表型转变以外,还可以定量比较通路特异性 ATP 产生速率的变化,并用于评价细胞对不同药物的敏感性。由 CB-839 导致的 A549 的 mitoATP 产生速率和 ATP 速率指数的降低比 PC-9 的降低程度更大(图 1C 和1E)。相比之下,与 A549 相比,响应 BAY-876 时 PC-9 细胞的 glycoATP 产生速率降低更多,并且 ATP 速率指数变化更显著(图 1D 和 1E)。
通过执行剂量反应测定,能够更清晰地评价这些敏感性差异(图 2)。响应 CB-839 处理时的 mitoATP 速率变化的剂量反应研究显示,A549 中的 IC50 为 PC-9 中的 1/50 以下(图 2A)。相比之下,与 PC-9 相比,A549 中 BAY-876 的glycoATP 速率的 IC50 高出八倍多(图 2B)。
抗癌代谢调节剂筛选
作为一种简单而稳定的代谢表型测定,XF 实时 ATP 速率测定非常适合筛选和评价代谢靶标候选药物的药物效力。例如,我们使用激酶抑制剂库来筛选癌细胞特异性线粒体调节剂。其工作流程如图 3 所示。简而言之,评价了来自 SCREEN-WELL 激酶抑制剂库 (Enzo Life Sciences) 的 80 种激酶抑制剂对THP-1 细胞(一种急性单核细胞白血病细胞系)和外周血单核细胞 (PBMC)(一种非癌细胞对照组)的代谢干扰。比较了它们与选定的表现出显著独特效果的抑制剂对细胞能量代谢的抑制作用。使用 Project 工具组合来自三个独立筛选重复测定的数据,该工具是 Seahorse Analytics 软件中的一种多文件分析功能,有助于鉴别在 THP-1 和 PBMC 中表现出不同反应的候选药物。此外,通过比较两种细胞类型的剂量反应,进一步评价了选定化合物的效力。
所有数据分析均采用 Seahorse Analytics 软件,该软件提供ATP 的产生速率工作流程简化了早期药物发现中筛选化合物和剂量反应实验的数据解析。
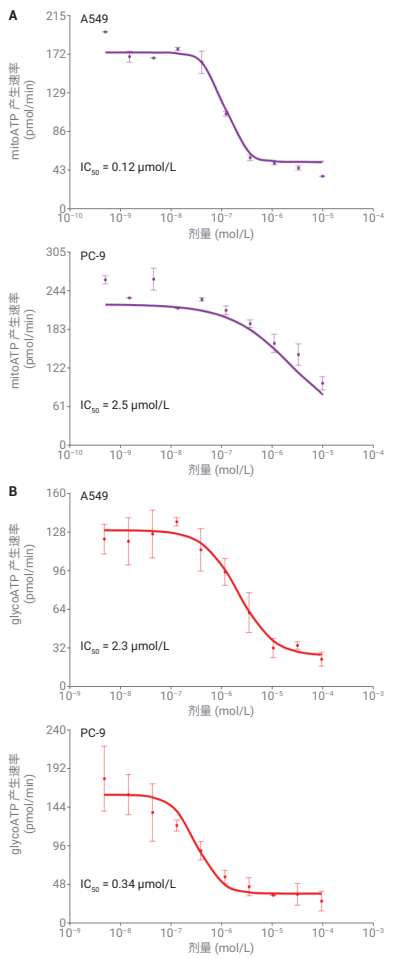
图 2. A549 与 PC-9 细胞系之间对代谢抑制剂敏感性的比较。如图所示,在 Agilent XF 实时 ATP 速率测定之前,将 A549 和 PC-9 细胞用 CB-839 或BAY-876 预处理 1 小时。利用安捷伦 Seahorse Analytics 中的 XF ATP 速率剂量分析工具对 IC50 值进行评估。(A) mitoATP 速率对 CB-839 的剂量反应。(B) glycoATP 速率对 BAY-876 的剂量反应。(n = 4,平均值 ± SD)
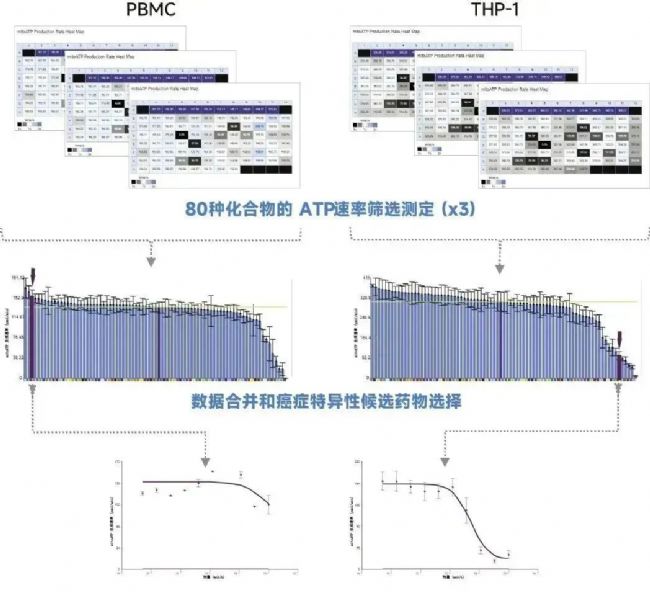
图 3. 提出的筛选靶向细胞代谢的抗癌药物的工作流程。通过多个针对每种细胞类型的独立的 XF 实时 ATP 速率测定来评价化合物对实验细胞 (THP-1) 和对照细胞(PBMC) 的影响。根据安捷伦 Seahorse Analytics 中的调节剂排名,对重复测定进行组合和比较。利用剂量反应研究进一步分析药物效力,以选择对 THP-1 靶细胞具有特异性的代谢调节剂
药物效力评价
图 4 示出在 THP-1 细胞中获得的三次重复筛选测定结果的代表性数据。每种化合物对 ATP 产生速率的上调和下调可以用各种图形格式(包括条形图和热图)表示,因此用户可以快速鉴别最有效的代谢调节剂。此外,ATP 速率 指数(以mitoATP 产生速率与 glycoATP 产生速率之间的比率计算)图能够检测导致向线粒体呼吸(指数增加)或糖酵解表型(指数减小)的显著代谢变化的药物或状况,可以显示或导出为电子表格以供进一步分析。

图 4. 筛选干扰癌细胞能量代谢的激酶抑制剂。在安捷伦 Seahorse XF 实时 ATP 速率测定之前,将 THP-1 细胞暴露于各种激酶抑制剂 (n = 80) 1 小时。(A) 比较对线粒体、糖酵解和总 ATP 产生速率的影响。(B) 使用 ATP 速率指数比较激酶抑制剂诱导的能量表型变化
此外,由重复测定得到的不同输出参数的平均组合数据可以按升序或降序排序,从而允许根据测得的任何参数的影响对激酶抑制剂进行排序。如图 5 所示,当获得的 mitoATP 速率按降序排序时,一些激酶抑制剂显著抑制 THP-1 细胞中的 mitoATP 产生速率(图 5A),而较少数量的抑制剂看起来能够有效抑制 PBMC 中的 mitoATP 速率(图 5B)。通过比较对 mitoATP 产生速率和 ATP 速率指数的影响,选中几种抑制剂。例如,SU1498 是对 THP-1 细胞的 mitoATP 产生具有最强抑制作用的化合物之一,而对 PBMC 几乎没有影响,对癌细胞类型表现出高特异性。U0126 对 mitoATP 速率表现出中度影响,但对 THP-1 细胞也具有高特异性。相比之下,AG-879 对于两种细胞类型均有效,并且在 PBMC 中的作用略强。图 5C 显示出从 Seahorse Analytics 中排序的图表导出的mitoATP 速率的数据表视图。
已知 SU1498 能够抑制 VEGFR2 受体和相关信号传导并诱导线粒体功能障碍[11,12]。MEK 抑制剂 U0126 被视为一种潜在的抗白血病药剂,并且据报道能够抑制线粒体功能并以不依赖于MEK 的方式诱导代谢表型转变为有氧糖酵解[13,14]。据报道,ErbB2 激酶抑制剂 AG-879 可诱导癌细胞凋亡,但其对线粒体代谢的影响尚未得到充分研究。事实上,据报道,它在高浓度下能够抑制 Glut1 活性[15]。利用剂量反应研究,对这三种药物的效力进行了评价(图 6)。与预期一致,THP-1 与 PBMC 对 AG-879 的敏感性无显著差异。相比之下,SU1398 和 U0126 仅在 THP-1 细胞中有效抑制线粒体呼吸。三种药物都会诱导代谢变化,糖酵解活性相互增加,并且在短期孵育后对细胞活力无显著影响。

图 5. THP-1 选择性抗线粒体化合物的鉴别。根据对 THP-1 (A) 和 PBMC (B) 的 mitoATP 速率的影响对抑制剂进行排名。在安捷伦 Seahorse Analytics 中,将每个排序的数据集导出到 Microsoft Excel 电子表格文件中,并且突出显示了三种化合物 (C)。(n = 3,平均值 ± SEM)
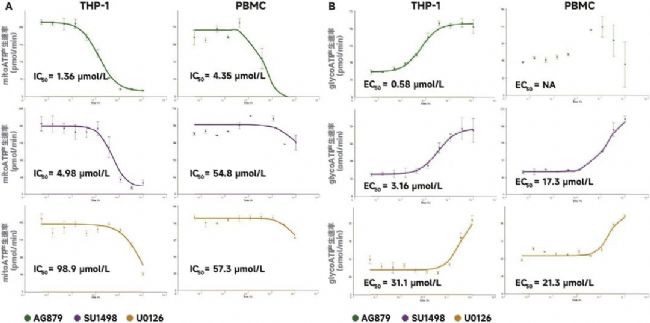
图 6. THP-1 和 PBMC 的 mitoATP 速率 (A) 和 glycoATP 速率 (B) 对三种选定激酶抑制剂的剂量反应。(n = 4,平均值 ± SD)
结论
安捷伦 XF 实时 ATP 速率测定是一种简单而稳定的检测方法,能够在癌症药物发现过程中鉴别相关代谢靶标通路。与专用分析软件相结合,提供了一种直接的方法来定量和比较癌细胞由于化学品或基因修饰引起的代谢改变,并区分线粒体与糖酵解能量代谢。该测定适合作为筛选可诱导癌细胞代谢表型变化而对细胞活力无显著影响的化合物的起始测定方法。此外,可以使用剂量反应测定来评价选定化合物的效力,或进行更全面的功能分析,以实现更详细的临床前研究。
参考文献
- Wolpaw, A.; Dang, C. V. Exploiting Metabolic Vulnerabilites of Cancer with Precision and Accuracy. Trends Cell Biol. 2018, 28, 201–212
- Chandel, N. S.; Martinez-Reyes, I. Cancer Metabolism: Looking Forward. Nat. Rev. Cancer 2021, 21, 669–680
- Stine, Z. E. et al. Targeting Cancer Metabolism in the Era of Precision Oncology. Nat. Rev. Drug Discov. 2022, 21, 141–162
- Romero, N. 等人. Quantifying Cellular ATP Production Rate Using Agilent Seahorse XF Technology(使用安捷伦Seahorse XF 技术定量分析细胞 ATP 产生速率),安捷伦科技公司白皮书,5991-9303EN,2018
- Carling, D. et al. AMP-Activated Protein Kinase: New Regulation, New Roles? Biochem. J. 2012, 445, 11–27www.agilent.com
- Hardie, D. G., Ross, F. A., Hawley, S. A. AMPK: a Nutrient And Energy Sensor That Maintains Energy Homeostasis. Nat. Rev. Mol. Cell Biol. 2012, 13, 251-262
- Agilent Seahorse XF Real-Time ATP Rate Assay Kit User Guide(安捷伦 Seahorse XF 实时 ATP 速率测定试剂盒用户指南),103592-100,安捷伦科技公司,2018
- Agilent Seahorse XF Media Selection Guide(安捷伦Seahorse XF 培养基选择指南),安捷伦科技公司,5994-7878EN,2020
- Bravo Seahorse Assay Workbench User Guide(Bravo Seahorse 测定工作台用户指南),安捷伦科技公司, 5994-0684EN, 2019
- 用于 Seahorse XFe96 样品前处理的 Bravo 自动化工作流程,安捷伦科技公司,https://www.agilent.com/en/video/bravo-xf-demonstration(2022 年 12 月 16 日访问)
- Boguslawski, G. et al. SU1498, an Inhibitor Of Vascular Endothelial Growth Factor Receptor 2, Causes Accumulation of Phosphorylated ERK Kinases and Inhibits Their Activity In Vivo and In Vitro. J. Biol. Chem. 2004, 279, 5716–5724
- Hao, T.; Rockwell, P. Signaling Through the Vascular Endothelial Growth Factor Receptor VEGFR-2 Protects Hippocampal Neurons from Mitochondrial Dysfunction and Oxidative Stress. Free Radic. Biol. Med. 2013, 63, 421–431
- Kerr, A. H. J. et al. An Investigation of the MEK/ERK Inhibitor U0126 in Acute Myeloid Leukemia. Ann. N. Y. Acad. Sci. 2003, 1010, 86–89
- Freeman, M. R. et al. Metabolic Perturbation by U0126 Identifies a Role for Glutamine in Resveratrol-Induced Cell Death. Cancer Biol. Ther. 2011, 12, 966–977
- Vera, J. C. et al. Direct Inhibition of the Hexose Transporter GLUT1 by Tyrosine Kinase Inhibitors. Biochemistry 2001, 40, 777–790

仅供科研使用,不用于临床诊断用途。

标签:
代谢分析





