通过增加类器官模型进行肿瘤信号通路研究助力疾病临床治疗
中山大学附属孙逸仙纪念医院Liang ping Su于2023年1月11日发表在Science translational medicine(19.319/Q1)上题为“Targeting Src reactivates pyroptosis to reverse chemoresistance in lung and pancreatic cancer models”的文章,即体内外研究中,通过细胞系、类器官、CDX模型,发现靶向Src可重新激活肿瘤细胞焦亡逆转肺和胰腺癌症模型的化疗耐药性。
研究项目背景:
胰腺癌和肺癌在治疗过程中经常对化疗诱导的细胞凋亡产生耐药性,这表明靶向非凋亡相关通路,如焦亡,可能是一种替代的癌症治疗策略。文章证明β5-integrin通过ASAH2驱动的鞘脂代谢重编程抑制化疗诱导的典型焦亡,从而赋予癌症化疗耐药。临床上,高β5-integrin表达与癌症患者预后差和化疗反应相关。机制上,蛋白质组学和脂质组学分析表明,β5-integrin通过Src信号通路转录激活STAT3信号,上调鞘脂代谢酶神经酰胺酶(ASAH2)的表达,从而降低代谢物神经酰胺浓度从而阻止化疗诱导的典型焦亡。利用癌细胞系、患者来源的肿瘤类器官、CDX模型, 发现Src或神经酰胺酶抑制剂通过在体外和体内重新激活焦亡,可以挽救化疗耐药的胰腺癌和肺癌细胞对化疗的反应。
研究路线图:
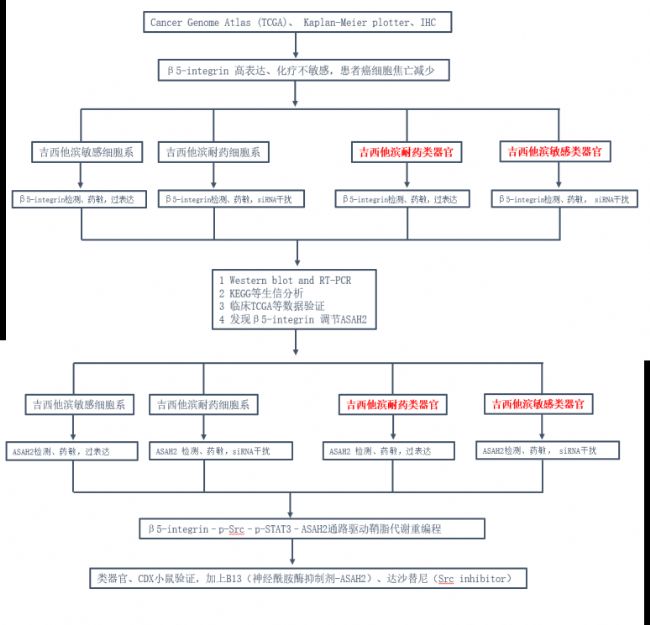
研究结果:
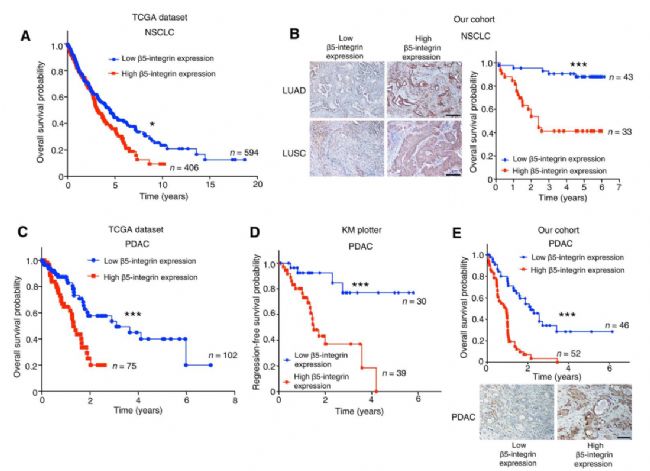
1、TCGA数据库等分析发现 β5-integrin高表达时,多种癌症相关患者的化疗反应和预后都比较差;
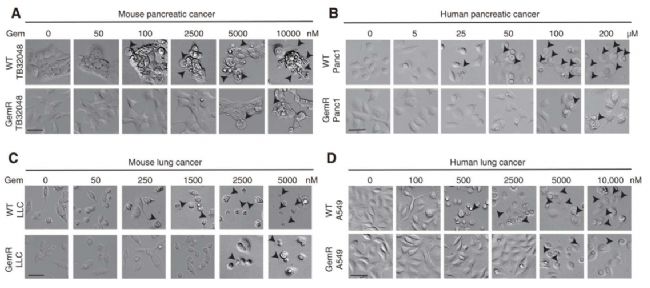
2、高剂量但不是低剂量的化疗药物处理可以在化疗敏感癌细胞中诱导焦亡;
3、β5-integrin通过Src-STAT3信号通路上调ASAH2表达以调节胰腺癌和肺癌肿瘤发生与化疗耐药;
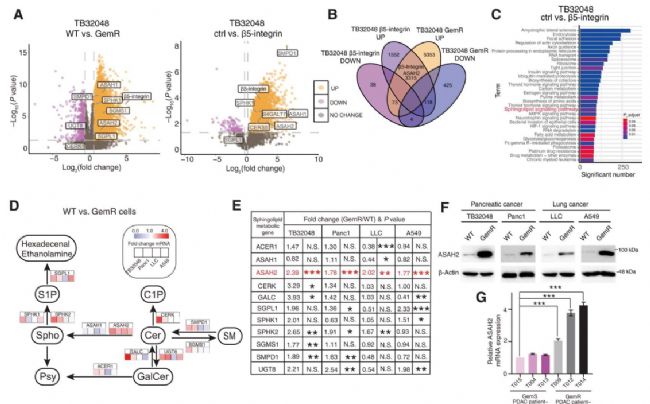
4、β5-integrin-p-Src-p-STAT3-ASAH2驱动鞘脂代谢重编程;
抑制化疗诱导焦亡,同时通过神经酰胺酶抑制剂(B13)和Src抑制剂(达沙替尼)处理,逆转录了吉西他滨耐药
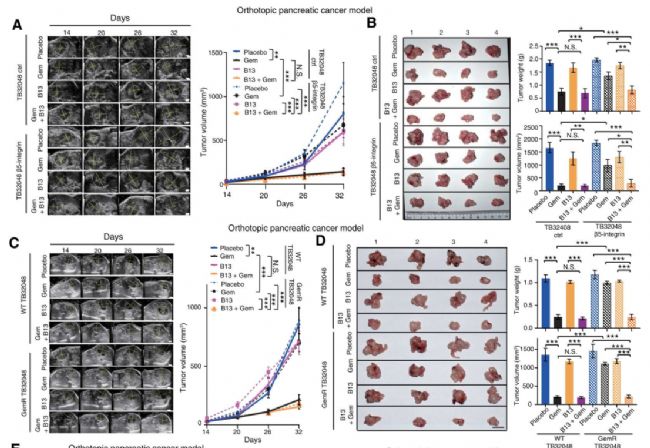
总而言之,作者除了应用传统的细胞系模型和CDX模型外,通过增加类器官模型来进行通路研究验证,增加了文章的亮点。类器官模型更接近真实世界的体内状态,这对肿瘤的研究提供了更加优秀的模型,为相关肿瘤疾病的临床治疗提供了新的思路。





