细胞被支原体污染后的特征及支原体检测试剂盒使用方法
很多小伙伴都疑惑,细胞被支原体污染后的特征是什么?如何鉴别细胞被支原体污染了?今天,我带大家分享两个支原体污染的案例,共同探寻一下细胞被支原体污染后的特征。

图1 感染支原体的EBTr(牛胚气管细胞)
先来观察一下被支原体污染的牛胚气管细胞(图1),由成纤维样逐渐变得类上皮样;质膜铺展,溃烂;轮廓不清,边界模糊。再看右图,细胞处于边增殖边凋亡的状态,漂浮凋亡细胞过多。
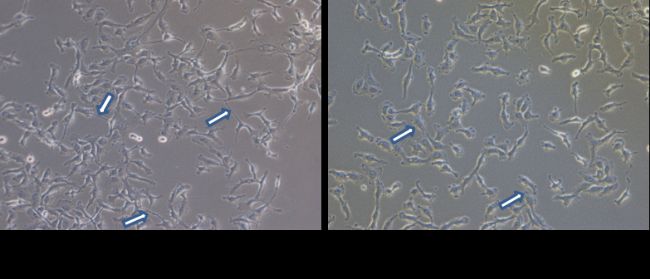
图2 感染支原体的HT1080(人纤维肉瘤细胞)
接下来再观察一下被支原体污染的人纤维肉瘤细胞HT1080(图2),由上皮样逐渐变得类成纤维样,胞体细长,和前面的牛胚气管细胞形态变化刚好相反;伪足伸长,出现明显的拉丝现象,表明细胞可能在“痛苦”地迁移。使用了支原体杀除试剂,彻底根除了支原体以后,如右图所示,细胞逐渐恢复了上皮样形态,拉丝减少。

图3 细胞膜上的支原体集落
接下来,给大家展示贴附在细胞膜上的支原体集落(图3),支原体是目前已知最小的原核生物,直径大小在0.1-0.3um,比细菌还要小。支原体可在培养液、细胞膜、细胞内增殖。单个支原体需要借助于电镜才可以观察到具体形态,图中膜上的黑点为支原体集落。细胞背景干净,形态没有大的变化,但质膜粗糙,布满黑点。
总结下来,细胞被支原体污染的主要特征如下:
✔ 增殖减慢;
✔ 上清液澄澈;
✔ 背景干净;
✔ 细胞形态异常(拉丝、铺展);
✔ 更换新的培养液细胞状态没有恢复。
细胞被支原体污染后的共性表现为细胞增殖减慢、上清液澄澈、背景干净,这3点可以明确地排除真、细菌污染。值得一提的是,当给细胞的营养体系不佳时,细胞也会表现出形态异常,所以,我们可以给细胞更换新的培养液,如果细胞也没有恢复正常形态,此时判断细胞极有可能被支原体“附身”了。
上述的判断方法需要丰富的经验积累,日常细胞培养中,我们还可以用PCR扩增试剂盒检测细胞是否有支原体污染。
支原体检测试剂盒(PCR法)使用方法
1、样品准备
取适量待检细胞培养上清于洁净的PCR管中(如果是血清样本,可用 Mycoplasma Free Water 稀释),利用PCR仪95℃热处理5min后作为模板;
2、PCR体系配制
每次实验需设置阴性对照(将1μL待检样品换成等量的Mycoplasma Free Water)与阳性对照(在1μL待检样品中加入0.5μL Positive Control后一起作为Template),实验时戴一次性口罩与手套,谨慎操作,防止操作不当引入外源支原体污染;
3、PCR程序设置
表2
| Step | Temperature | Time | Cycles |
| Initial Denaturation | 98℃ | 2 min | 1 |
| Denaturation | 98℃ | 20S | |
| Annealing | 56℃ | 25S | 30 |
| Extension | 72℃ | 10S | |
| Final extension | 72℃ | 5min | 1 |
| Hold | 4-16℃ | Forever |
4、凝胶电泳
取10μL PCR产物,使用1%琼脂糖凝胶进行电泳检测;
5、结果分析
每次实验通过与阴性对照、阳性对照检测结果比较确认样品支原体污染情况,阳性条带大小500bp左右。如阴性对照检测结果中有条带很有可能是PCR体系中出现污染,建议重新实验确认结果。如有必要,也可对PCR产物进行常规测序,以确定具体的支原体种属。





