国家重点实验室汤海洋教授团队发现新冠感染相关心肌损伤的新机制
COVID-19相关的心功能障碍是引起患者死亡的主要危险因素之一。新冠感染导致心肌炎的概率很低,比没有感染新冠的心肌炎发生概率有所增加,也有研究报道COVID-19患者会出现不同程度的心功能障碍和心脏损伤1。IL-18是IL-1家族的促炎细胞因子,作为非活性前体合成,由Caspase 1加工成活性形式后释放。内源性IL-18已被证明会导致心肌缺血后的收缩功能障碍,而过量的IL-18可介导心脏炎症、纤维化和室性心动过速2。然而,IL-18在COVID-19相关的心功能障碍中的调控和作用尚不清楚。
2023年3月9日,呼吸疾病国家重点实验室汤海洋教授团队在Nature旗下刊物Signal Transduction and Targeted Therapy杂志在线发表了题为“SARS-CoV-2 Spike Protein Induces IL-18-mediated Cardiopulmonary Inflammation Via Reduced Mitophagy”的研究论文。该研究揭示了SARS-CoV-2诱发心功能障碍的机制,阐明了IL-18在COVID-19相关的心功能障碍中的作用,为缓解心脏损伤提供了理论基础和新的治疗靶点。

首先,根据临床样本,作者发现IL-18在COVID-19患者的血清和肺组织中表达明显增加,并且增加的IL-18水平与患者生存率和住院负担相关:IL-18水平越高,患者生存率越低,住院时间越久。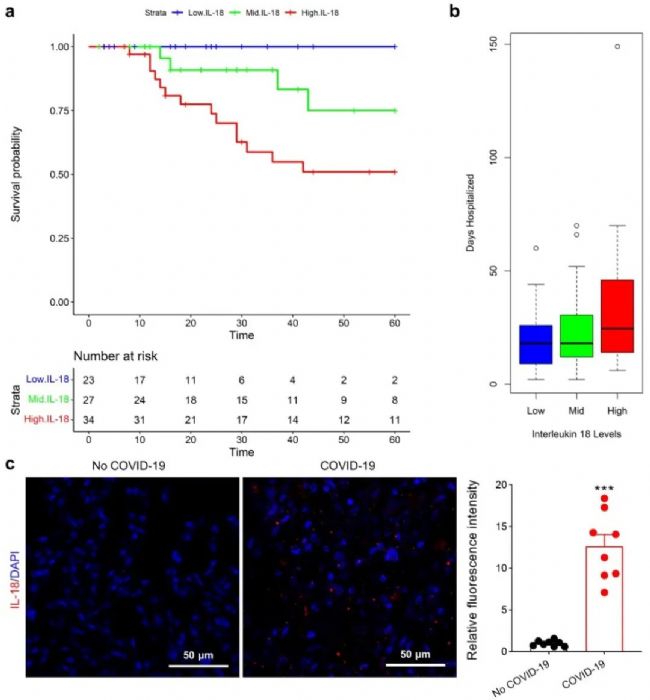
接着,作者以人源化ACE2转基因小鼠(hACE2)为研究对象,利用SARS-CoV-2 Spike蛋白经气管插管刺激小鼠肺部建立COVID-19动物模型。与IgG对照组相比,Spike蛋白处理组的心脏组织中IL-18和炎性小体NLRP3表达增加,NF-κB信号通路被激活,心肌出现胶原沉积,并且心律失常、左心室舒张功能障碍风险增加。 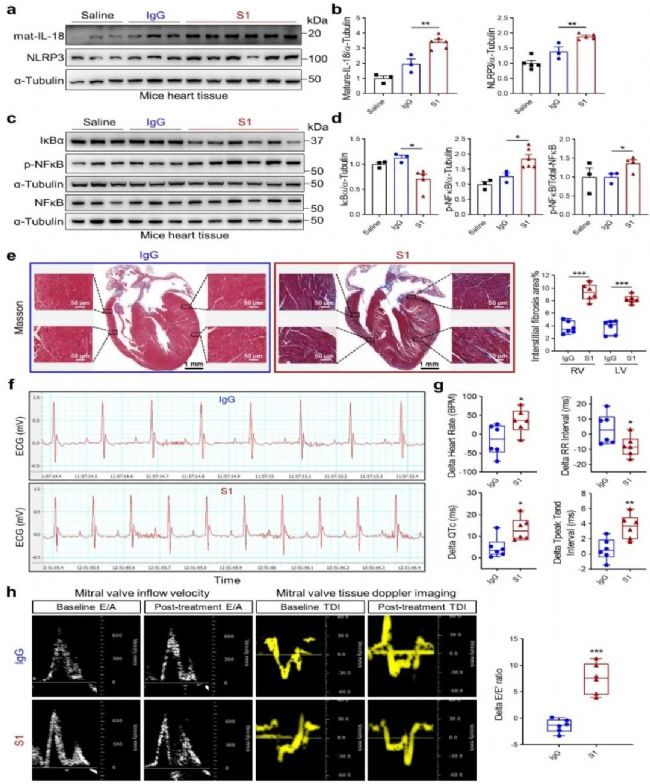
为了验证IL-18在心脏损伤中的直接作用,作者利用IL-18的诱饵受体IL-18BP注射COVID-19动物模型,发现IL-18BP可以抑制心脏组织中NF-κB激活,改善心肌胶原沉积和左心室舒张功能。 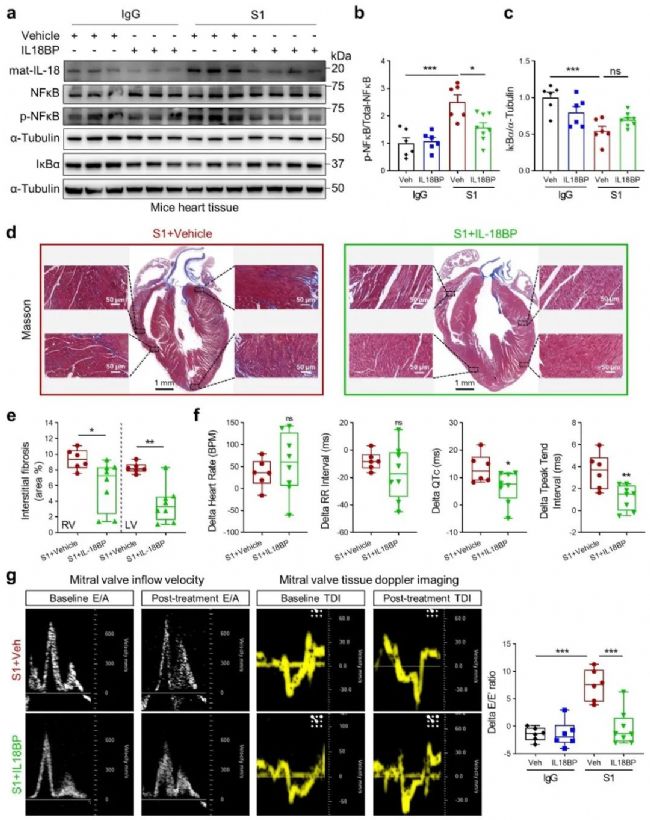
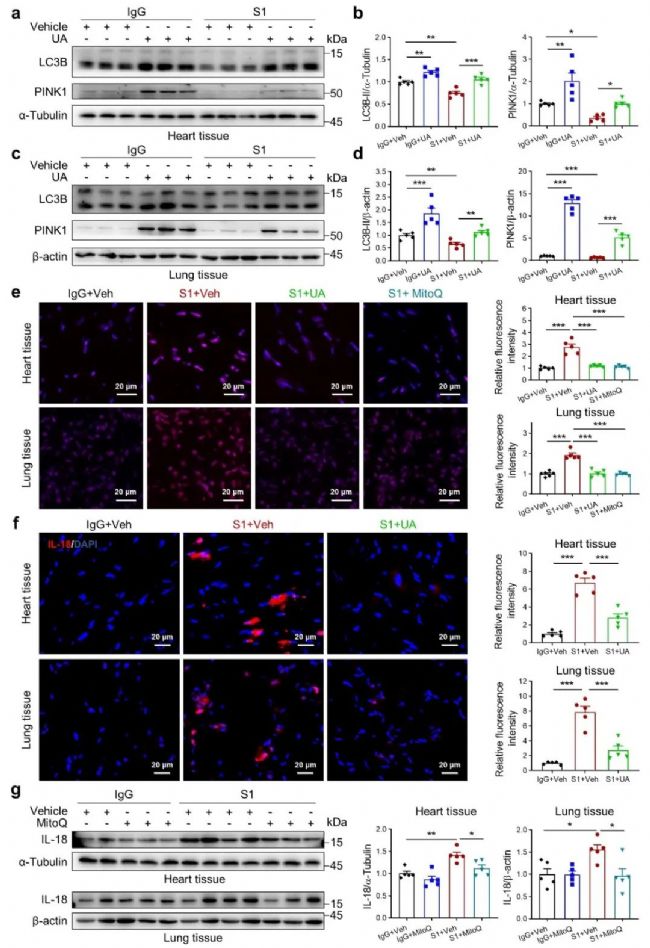
作者在体外实验中进一步验证了线粒体自噬在IL-18活化中的作用。通过透射电子显微镜和免疫印迹实验显示,在人心血管内皮细胞和肺血管内皮细胞中,Spike蛋白同样能够诱导IL-18和线粒体ROS产生,抑制线粒体自噬的发生。CCCP和MitoQ刺激均可减少IL-18的表达。此外,IL-18BP可以抑制Spike蛋白诱导的血管通透性增加。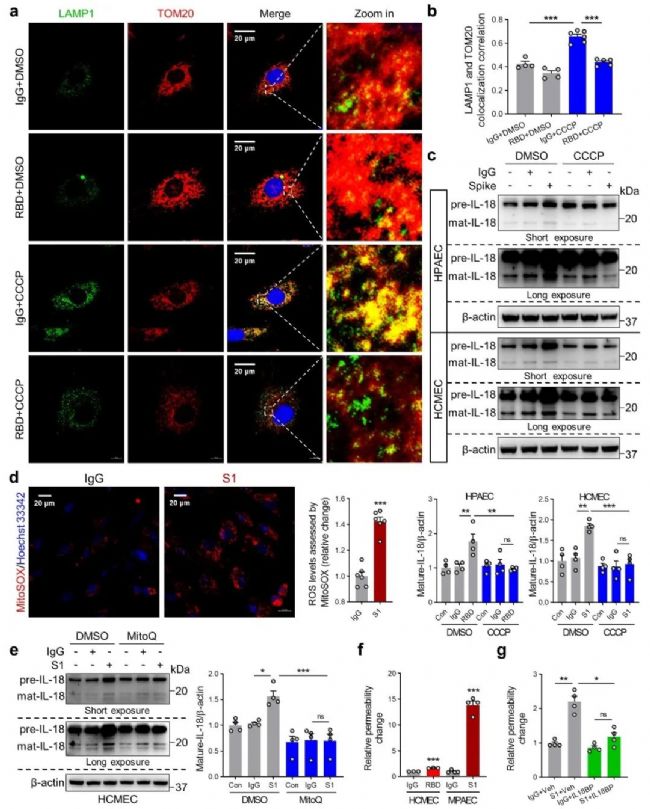
综上所述,该研究表明线粒体自噬缺乏和炎症小体激活之间的联系在COVID-19发病过程中发挥重要作用,并提示IL-18和线粒体自噬是潜在的治疗靶点。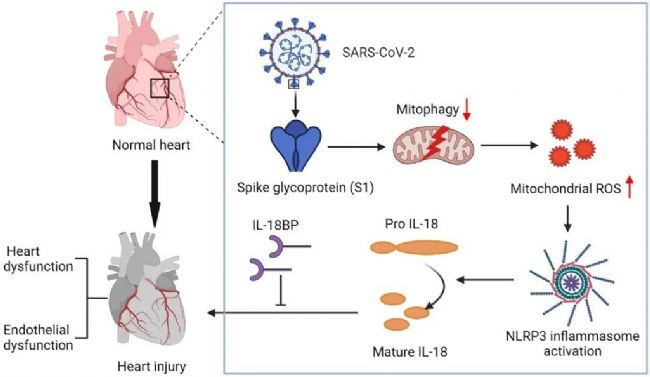
呼吸疾病国家重点实验室汤海洋教授和美国印第安纳大学Ankit A. Desai教授为该论文的共同通讯作者,广州医科大学附属第一医院博士后梁书鑫和西北农林科技大学博士毕业生鲍长磊为论文的共同第一作者。该研究由国家重点研发计划、国家自然科学基金、广东省钟南山医学基金等资助。
论文链接:https://doi.org/10.1038/s41392-023-01368-w
参考文献:1. Guo T, Fan Y, Chen M, Wu X, Zhang L, He T, Wang H, Wan J, Wang X and Lu Z. Cardiovascular Implications of Fatal Outcomes of Patients With Coronavirus Disease 2019 (COVID-19). JAMA cardiology. 2020;5:811-818.2. Gupta A, Fei YD, Kim TY, Xie A, Batai K, Greener I, Tang H, Ciftci-Yilmaz S, Juneman E, Indik JH, Shi G, Christensen J, Gupta G, Hillery C, Kansal MM, Parikh DS, Zhou T, Yuan JX, Kanthi Y, Bronk P, Koren G, Kittles R, Duarte JD, Garcia JGN, Machado RF, Dudley SC, Choi BR and Desai AA. IL-18 mediates sickle cell cardiomyopathy and ventricular arrhythmias. Blood. 2021;137:1208-1218.
2023年3月9日,呼吸疾病国家重点实验室汤海洋教授团队在Nature旗下刊物Signal Transduction and Targeted Therapy杂志在线发表了题为“SARS-CoV-2 Spike Protein Induces IL-18-mediated Cardiopulmonary Inflammation Via Reduced Mitophagy”的研究论文。该研究揭示了SARS-CoV-2诱发心功能障碍的机制,阐明了IL-18在COVID-19相关的心功能障碍中的作用,为缓解心脏损伤提供了理论基础和新的治疗靶点。

首先,根据临床样本,作者发现IL-18在COVID-19患者的血清和肺组织中表达明显增加,并且增加的IL-18水平与患者生存率和住院负担相关:IL-18水平越高,患者生存率越低,住院时间越久。

接着,作者以人源化ACE2转基因小鼠(hACE2)为研究对象,利用SARS-CoV-2 Spike蛋白经气管插管刺激小鼠肺部建立COVID-19动物模型。与IgG对照组相比,Spike蛋白处理组的心脏组织中IL-18和炎性小体NLRP3表达增加,NF-κB信号通路被激活,心肌出现胶原沉积,并且心律失常、左心室舒张功能障碍风险增加。

为了验证IL-18在心脏损伤中的直接作用,作者利用IL-18的诱饵受体IL-18BP注射COVID-19动物模型,发现IL-18BP可以抑制心脏组织中NF-κB激活,改善心肌胶原沉积和左心室舒张功能。

众所周知,线粒体自噬是清除损伤线粒体的重要途径,其缺乏会导致功能障碍的线粒体积累,进一步释放线粒体ROS,从而驱动炎性小体激活导致IL-18释放。为了探究线粒体自噬在COVID-19动物模型IL-18活化中的作用,作者利用线粒体自噬诱导剂urolithin A (UA)和靶向线粒体ROS清除剂Mitoquinone (MitoQ)进行动物实验,结果表明在hACE2小鼠心肺组织中,UA能够诱导线粒体自噬,并通过减少Spike蛋白诱导的ROS产生,抑制IL-18表达。同样地,MitoQ处理后也抑制了IL-18表达。

作者在体外实验中进一步验证了线粒体自噬在IL-18活化中的作用。通过透射电子显微镜和免疫印迹实验显示,在人心血管内皮细胞和肺血管内皮细胞中,Spike蛋白同样能够诱导IL-18和线粒体ROS产生,抑制线粒体自噬的发生。CCCP和MitoQ刺激均可减少IL-18的表达。此外,IL-18BP可以抑制Spike蛋白诱导的血管通透性增加。

综上所述,该研究表明线粒体自噬缺乏和炎症小体激活之间的联系在COVID-19发病过程中发挥重要作用,并提示IL-18和线粒体自噬是潜在的治疗靶点。

呼吸疾病国家重点实验室汤海洋教授和美国印第安纳大学Ankit A. Desai教授为该论文的共同通讯作者,广州医科大学附属第一医院博士后梁书鑫和西北农林科技大学博士毕业生鲍长磊为论文的共同第一作者。该研究由国家重点研发计划、国家自然科学基金、广东省钟南山医学基金等资助。
论文链接:https://doi.org/10.1038/s41392-023-01368-w
参考文献:1. Guo T, Fan Y, Chen M, Wu X, Zhang L, He T, Wang H, Wan J, Wang X and Lu Z. Cardiovascular Implications of Fatal Outcomes of Patients With Coronavirus Disease 2019 (COVID-19). JAMA cardiology. 2020;5:811-818.2. Gupta A, Fei YD, Kim TY, Xie A, Batai K, Greener I, Tang H, Ciftci-Yilmaz S, Juneman E, Indik JH, Shi G, Christensen J, Gupta G, Hillery C, Kansal MM, Parikh DS, Zhou T, Yuan JX, Kanthi Y, Bronk P, Koren G, Kittles R, Duarte JD, Garcia JGN, Machado RF, Dudley SC, Choi BR and Desai AA. IL-18 mediates sickle cell cardiomyopathy and ventricular arrhythmias. Blood. 2021;137:1208-1218.





