悬浮培养HEK293细胞包装病毒载体的过程优化
基因转移的有效性和安全性决定了基因治疗的有效性。为了保护细胞外环境中的遗传物质免于降解,必须使用用于基因传递的载体系统。其被定义为用于将基因递送至靶细胞及其核中的载体。
一种被广泛使用的载体类型就是病毒载体,其已经进化为递送DNA(如腺相关病毒AAV)或RNA(如慢病毒LV)以复制到宿主细胞中。这些病毒载体都具有各自的优势,可采用贴壁培养、微载体悬浮培养(详见“应用微载体包装AAV病毒载体”)以及无血清悬浮培养等方式。无论如何,规模化生产病毒载体的可靠工艺,都是其临床转化的重要挑战。本文以需要采用转染方式包装病毒载体的LV和AAV为例,概述其悬浮培养HEK293细胞包装病毒载体的过程优化。
在此之前,先看一下各个病毒载体的特点以及外源基因进入细胞的方式。
各个病毒载体的特点
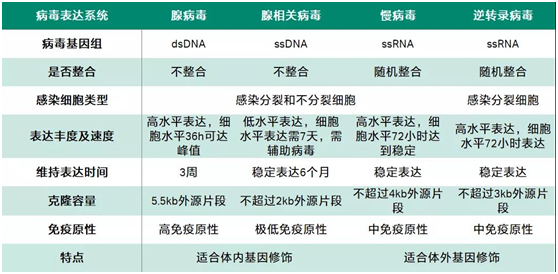
表1 不同病毒载体的特点
外源基因进入细胞的方式
常见转染方法:
· 化学转染:PEI、脂质体(昂贵)
· 物理转染:电穿孔、基因注射、显微注射(需要设备)
· 病毒:腺病毒、逆转录病毒
对于LV及AAV的转染过程,工业生产一般使用基于PEI的转染方法。细胞表面和DNA都带负电荷,PEI等转染试剂表面带正电荷,使用PEI包裹带负电荷的DNA,然后穿过带负电荷的细胞膜,进行病毒载体的包装。
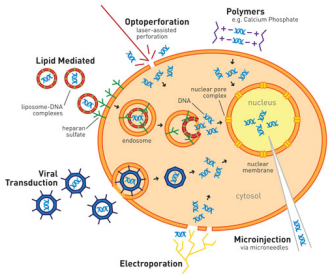
图1 外源基因进入细胞的方式
Case1: 悬浮培养HEK293细胞包装LV过程优化
LV是出芽方式分泌,包装后的LV一般用于感染免疫细胞,使其表达出Car-T细胞Car的部分。
1、实验方法
1) 细胞株:HEK293SF-3F6
2) 反应器:一次性搅拌式反应器
3) 截留装置:0.8-0.45 µm
4) 培养方式:采用灌流培养的方式实现细胞密度的提高
2、实验结果:
2.1 转染时细胞密度对病毒滴度的影响
1) 转染时细胞密度:
LCD:1×106 cells/ml
HCD:5×106cells/ml
2) 采用灌流培养的方式实现细胞密度的提高,在使用LC-SFM培养基情况下,每天一个灌体积的灌流速率,可使细胞密度达到1×107 cells/ml,不仅增加了细胞密度,也移除了代谢副产物如乳酸、氨等。
3) 不管在LCD还是在HCD条件下转染,单个细胞产毒效率都在2 TU/cell左右。
4) 在LCD条件下,转染后3天病毒滴度达到峰值,约1×106 TU/ml,在HCD条件下,病毒滴度峰值可达5×106 TU/ml,转染时较高的细胞密度可以得到更高的病毒滴度。
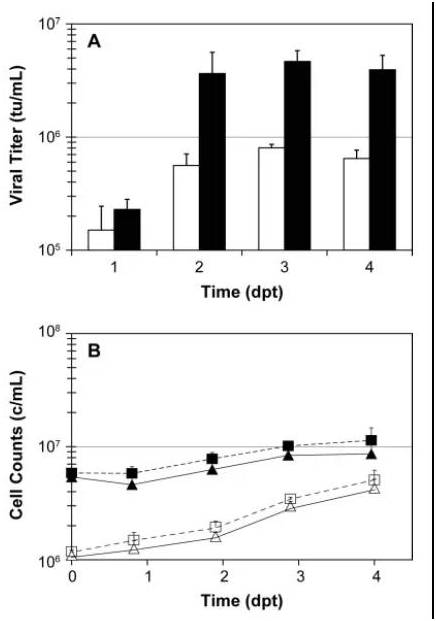
病毒梯度,LCD(open bars),HCD(solid bars)。(B)细胞密度。总细胞计数(squares),活细胞计数(triangles),HCD(solid symbols),LCD(open symbols)
2.2 培养基对病毒滴度的影响
1) 优化培养基包括某品牌LC-SFM L; LC-SFM GL以及HyClone培养基SFMTransfx-293,代号HyQ。
2) 在使用LC-SFM L和 LC-SFM GL时,不论LCD还是HCD条件下,单个细胞产毒效率均为2 TU/ml。
3) 在使用HyQ (SFMTransfx-293)时,LCD转染条件下有很高的单个细胞产毒效率为6 TU/ml,但是HCD条件下,单个细胞转染效率减少为2 TU/ml,主要是因为HCD条件下,细胞结团严重,并在容器液面边缘形成一圈死细胞。造成这个现象的原因是PEI有一定毒副作用,为了降低PEI的使用量,降低原来1 µg DNA/106cells的使用量,选择0.4-0.6 µg DNA/106cells的使用量,转染后3天得到最高病毒滴度,为9×106TU/ml。
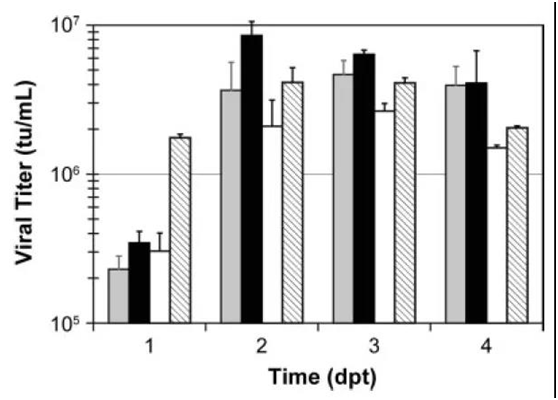
图3 不同类型培养基对LV生产的影响
转染阶段:HCD条件下使用LC-SFM L培养基 (solid grey bars), HCD条件下使用LC-SFM GL培养基 (solid black bars),LCD条件下使用SFMTransfx-293培养基(open bars),HCD条件下使用SFMTransfx-293培养基(hatched bars)
2.3 转染后添加剂丁酸钠的浓度对病毒滴度的影响
1) 使用HyQ (SFMTransfx-293)培养基,在HCD转染条件下,转染后16h添加丁酸钠,优化其添加浓度,丁酸钠优化浓度范围为0.1-5 mM。
2) 转染后丁酸钠添加量大于2 mM时,会降低细胞密度;随着丁酸钠含量的增加,病毒滴度增加。在5 mM丁酸钠添加量条件下,转染后2天可达最大病毒滴度,为1×108 TU/ml。
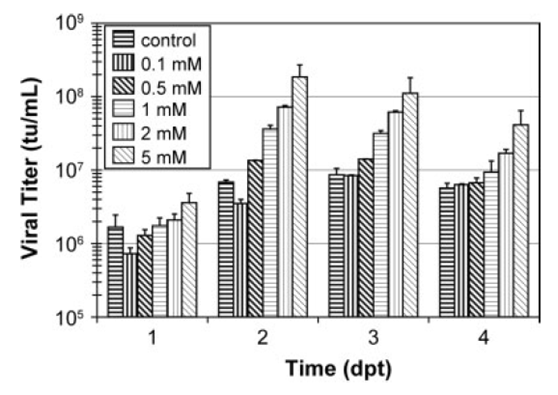
图4 丁酸钠不同添加浓度对LV生产的影响,所有实验组均在SFMTransfx-293培养基中进行,在HCD条件下,使用0.4 µg DNA/106cells,丁酸钠使用量列于图中。
2.4 悬浮培养HEK293细胞包装LV过程优化汇总
1) 转染时,较高的细胞密度有利于提高病毒滴度;
2) HyClone培养基SFMTransfx-293能够得到更高的单个细胞产毒效率,但在高密度转染条件下容易结团,需要降低PEI的使用量,建议0.4-0.6 µg DNA/106cells;
3) 转染后丁酸钠的添加可以增加病毒滴度,但是也容易影响细胞活性,从而降低活细胞密度。
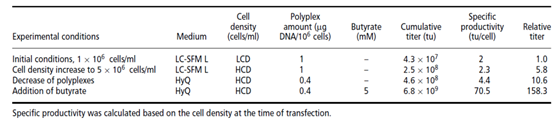
4) 通过上述三步优化,最终LV病毒滴度从1×106TU/ml提高到1×108TU/ml。
若收毒时采用灌流的方式,可以得到近一个数量级的病毒量的提升。
表2 过程优化对病毒总量(转染后Day4)的影响
Case2: 悬浮培养HEK293细胞包装AAV转染过程优化
腺相关病毒(AAV)载体是领先的基因传递平台,但载体的生产仍然是一个挑战。需要新的方法来提高AAV的产量并降低成本。过去提高AAV产量的努力集中在一次优化单个变量上,但是这种方法没有考虑到有助于向量生成的多个因素的相互作用。在这里,我们利用实验设计(DOE)方法来优化HEK293T悬浮细胞系统中的rAAV生产。
1、实验方法
1) 细胞株:HEK293T
2) 培养基:HyCell TransFx-H
3) 反应器:一次性搅拌式反应器XDR
4) DoE实验设计:
2、实验结果:
在转染时活细胞密度为1×106cells/ml条件下,结果显示一组独特的参数,转基因质粒的浓度更高,较短的孵育时间,丁酸钠的添加等条件,详述如下:
1) DNA浓度:1 µg/uL,借由案例1可知,高细胞密度下,可降低此值;
2) PEI/DNA比例:2,较高的比例并不能带来更好的病毒滴度;
3) 转染体积:5%,过高过低的转染体积均不利于转染效率;
4) 转染复合物孵育时间:20 min,过长的孵育时间,将使复合物体积变大,不利于其进入细胞;
5) 温度:37 oC;
6) DNA比例:Rep/cap:helper:transgen plasmid=1:1:2
7) 转染后丁酸钠的添加:5 mM,过多的丁酸钠会造成细胞活率的降低,但可以显著提高病毒滴度。

图5 DoE实验设计:转染条件(温度、孵育时间、转染体积、添加剂浓度)对转染效率的影响

图6 DoE实验设计:转染条件(DNA比例、PEI/DNA比例、DNA浓度、添加剂浓度)对病毒滴度的影响
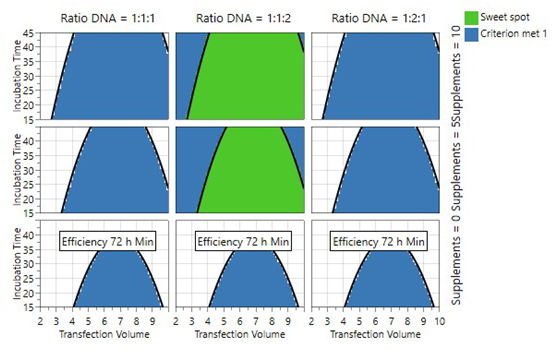
图7 转染条件DoE实验中sweet spot界定
总结
规模化生产病毒载体的可靠工艺,是其临床转化的重要挑战,对于需要采用转染方式包装病毒载体的LV和AAV来说,其悬浮培养的方式将带来更便利的可放大性,那么对转染阶段的条件优化,包括转染时细胞密度,PEI/DNA比例,添加剂的使用等将显得尤为重要,此时可采用OFAT单因素法或者DoE的实验设计方式,必要时可采用灌流的方式用于细胞密度的扩增、代谢副产物的移除以及病毒收获。
一种被广泛使用的载体类型就是病毒载体,其已经进化为递送DNA(如腺相关病毒AAV)或RNA(如慢病毒LV)以复制到宿主细胞中。这些病毒载体都具有各自的优势,可采用贴壁培养、微载体悬浮培养(详见“应用微载体包装AAV病毒载体”)以及无血清悬浮培养等方式。无论如何,规模化生产病毒载体的可靠工艺,都是其临床转化的重要挑战。本文以需要采用转染方式包装病毒载体的LV和AAV为例,概述其悬浮培养HEK293细胞包装病毒载体的过程优化。
在此之前,先看一下各个病毒载体的特点以及外源基因进入细胞的方式。
各个病毒载体的特点

表1 不同病毒载体的特点
外源基因进入细胞的方式
常见转染方法:
· 化学转染:PEI、脂质体(昂贵)
· 物理转染:电穿孔、基因注射、显微注射(需要设备)
· 病毒:腺病毒、逆转录病毒
对于LV及AAV的转染过程,工业生产一般使用基于PEI的转染方法。细胞表面和DNA都带负电荷,PEI等转染试剂表面带正电荷,使用PEI包裹带负电荷的DNA,然后穿过带负电荷的细胞膜,进行病毒载体的包装。

图1 外源基因进入细胞的方式
Case1: 悬浮培养HEK293细胞包装LV过程优化
LV是出芽方式分泌,包装后的LV一般用于感染免疫细胞,使其表达出Car-T细胞Car的部分。
1、实验方法
1) 细胞株:HEK293SF-3F6
2) 反应器:一次性搅拌式反应器
3) 截留装置:0.8-0.45 µm
4) 培养方式:采用灌流培养的方式实现细胞密度的提高
2、实验结果:
2.1 转染时细胞密度对病毒滴度的影响
1) 转染时细胞密度:
LCD:1×106 cells/ml
HCD:5×106cells/ml
2) 采用灌流培养的方式实现细胞密度的提高,在使用LC-SFM培养基情况下,每天一个灌体积的灌流速率,可使细胞密度达到1×107 cells/ml,不仅增加了细胞密度,也移除了代谢副产物如乳酸、氨等。
3) 不管在LCD还是在HCD条件下转染,单个细胞产毒效率都在2 TU/cell左右。
4) 在LCD条件下,转染后3天病毒滴度达到峰值,约1×106 TU/ml,在HCD条件下,病毒滴度峰值可达5×106 TU/ml,转染时较高的细胞密度可以得到更高的病毒滴度。

病毒梯度,LCD(open bars),HCD(solid bars)。(B)细胞密度。总细胞计数(squares),活细胞计数(triangles),HCD(solid symbols),LCD(open symbols)
2.2 培养基对病毒滴度的影响
1) 优化培养基包括某品牌LC-SFM L; LC-SFM GL以及HyClone培养基SFMTransfx-293,代号HyQ。
2) 在使用LC-SFM L和 LC-SFM GL时,不论LCD还是HCD条件下,单个细胞产毒效率均为2 TU/ml。
3) 在使用HyQ (SFMTransfx-293)时,LCD转染条件下有很高的单个细胞产毒效率为6 TU/ml,但是HCD条件下,单个细胞转染效率减少为2 TU/ml,主要是因为HCD条件下,细胞结团严重,并在容器液面边缘形成一圈死细胞。造成这个现象的原因是PEI有一定毒副作用,为了降低PEI的使用量,降低原来1 µg DNA/106cells的使用量,选择0.4-0.6 µg DNA/106cells的使用量,转染后3天得到最高病毒滴度,为9×106TU/ml。

图3 不同类型培养基对LV生产的影响
转染阶段:HCD条件下使用LC-SFM L培养基 (solid grey bars), HCD条件下使用LC-SFM GL培养基 (solid black bars),LCD条件下使用SFMTransfx-293培养基(open bars),HCD条件下使用SFMTransfx-293培养基(hatched bars)
2.3 转染后添加剂丁酸钠的浓度对病毒滴度的影响
1) 使用HyQ (SFMTransfx-293)培养基,在HCD转染条件下,转染后16h添加丁酸钠,优化其添加浓度,丁酸钠优化浓度范围为0.1-5 mM。
2) 转染后丁酸钠添加量大于2 mM时,会降低细胞密度;随着丁酸钠含量的增加,病毒滴度增加。在5 mM丁酸钠添加量条件下,转染后2天可达最大病毒滴度,为1×108 TU/ml。

图4 丁酸钠不同添加浓度对LV生产的影响,所有实验组均在SFMTransfx-293培养基中进行,在HCD条件下,使用0.4 µg DNA/106cells,丁酸钠使用量列于图中。
2.4 悬浮培养HEK293细胞包装LV过程优化汇总
1) 转染时,较高的细胞密度有利于提高病毒滴度;
2) HyClone培养基SFMTransfx-293能够得到更高的单个细胞产毒效率,但在高密度转染条件下容易结团,需要降低PEI的使用量,建议0.4-0.6 µg DNA/106cells;
3) 转染后丁酸钠的添加可以增加病毒滴度,但是也容易影响细胞活性,从而降低活细胞密度。
4) 通过上述三步优化,最终LV病毒滴度从1×106TU/ml提高到1×108TU/ml。
若收毒时采用灌流的方式,可以得到近一个数量级的病毒量的提升。
表2 过程优化对病毒总量(转染后Day4)的影响

Case2: 悬浮培养HEK293细胞包装AAV转染过程优化
腺相关病毒(AAV)载体是领先的基因传递平台,但载体的生产仍然是一个挑战。需要新的方法来提高AAV的产量并降低成本。过去提高AAV产量的努力集中在一次优化单个变量上,但是这种方法没有考虑到有助于向量生成的多个因素的相互作用。在这里,我们利用实验设计(DOE)方法来优化HEK293T悬浮细胞系统中的rAAV生产。
1、实验方法
1) 细胞株:HEK293T
2) 培养基:HyCell TransFx-H
3) 反应器:一次性搅拌式反应器XDR
4) DoE实验设计:

2、实验结果:
在转染时活细胞密度为1×106cells/ml条件下,结果显示一组独特的参数,转基因质粒的浓度更高,较短的孵育时间,丁酸钠的添加等条件,详述如下:
1) DNA浓度:1 µg/uL,借由案例1可知,高细胞密度下,可降低此值;
2) PEI/DNA比例:2,较高的比例并不能带来更好的病毒滴度;
3) 转染体积:5%,过高过低的转染体积均不利于转染效率;
4) 转染复合物孵育时间:20 min,过长的孵育时间,将使复合物体积变大,不利于其进入细胞;
5) 温度:37 oC;
6) DNA比例:Rep/cap:helper:transgen plasmid=1:1:2
7) 转染后丁酸钠的添加:5 mM,过多的丁酸钠会造成细胞活率的降低,但可以显著提高病毒滴度。

图5 DoE实验设计:转染条件(温度、孵育时间、转染体积、添加剂浓度)对转染效率的影响

图6 DoE实验设计:转染条件(DNA比例、PEI/DNA比例、DNA浓度、添加剂浓度)对病毒滴度的影响

图7 转染条件DoE实验中sweet spot界定
总结
规模化生产病毒载体的可靠工艺,是其临床转化的重要挑战,对于需要采用转染方式包装病毒载体的LV和AAV来说,其悬浮培养的方式将带来更便利的可放大性,那么对转染阶段的条件优化,包括转染时细胞密度,PEI/DNA比例,添加剂的使用等将显得尤为重要,此时可采用OFAT单因素法或者DoE的实验设计方式,必要时可采用灌流的方式用于细胞密度的扩增、代谢副产物的移除以及病毒收获。





