HOXB4 在保护 BMSCs 对抗 ALI/ARDS 中的作用
败血症是一种生理、生物学和生化异常的复杂临床综合征。它由宿主对感染的失调反应发展而来。肺是最容易感染败血症的器官,并可发展为急性呼吸窘迫综合征(ARDS)。肺泡 II 型上皮细胞和毛细血管内皮细胞 (EC) 损伤是急性肺损伤 (ALI)/ARDS 发展的主要潜在原因。以往的研究集中于肺泡II型上皮细胞,但越来越多的证据表明肺泡毛细血管EC损伤可能在促进ALI/ARDS进展中发挥更关键的作用。
间充质干细胞 (MSCs) 是一个重要的干细胞家族,具有巨大的治疗潜力。基于 MSC 的细胞疗法由于多种因素,包括多种旁分泌因子的分泌、协助组织修复、免疫调节和减少细菌感染的严重程度而成为一种有潜力的治疗ARDS的方法。迄今为止,一些临床研究已经证实了 MSCs 对 ARDS 的治疗效果,包括由 2019 年冠状病毒 (COVID-19) 引起的 ARDS。
近日,由中山大学附属第一医院重症医学科、转化医学研究中心以及中山大学肺部疾病研究所的专家团队对此领域进行了深入研究。在预实验中发现,在脂多糖 (LPS) 相关ALI/ARDS动物模型中,用 Ghrelin(生长激素释放肽)预处理骨髓间充质干细胞 (BMSCs) 可显著增强其治疗效果。肺泡腔渗出液的显著减少证明了这一点,通过对 Ghrelin 预处理的 BMSCs 上清液的转录组测序发现,同源框 B4 (HOXB4) 显著上调。
HOXB4 是同源盒 (HOX) 基因家族的成员,在细胞更新和分化的调控中具有重要作用。然而,关于 ALI/ARDS 中 HOXB4 与 BMSCs 之间相互作用的研究很少。此外,尚不清楚HOXB4是否能增强BMSCs对ALI/ARDS的治疗效果,其潜在的分子机制值得研究。因此,该研究旨在探讨 HOXB4 在保护 BMSCs 对抗 ALI/ARDS 中的作用。相关研究成果发表在 Journal of Inflammation Research 题为《Overexpression of HOXB4 Promotes Protection of Bone Marrow Mesenchymal Stem Cells Against Lipopolysaccharide-Induced Acute Lung Injury Partially Through the Activation of Wnt/β-Catenin Signaling》。
实验结果:
共培养方案在 Transwell 室中建立,上室分别与野生型(WT)BMSCs、BMSCs载体(Vector )和HOXB4过表达BMSCs孵育,下室与ECs共同孵育。实验分为五组:对照组、EC+LPS组、BMSCWT+EC+LPS组、 BMSCVector+EC+LPS组、 BMSCHOXB4+EC+LPS组。
BMSC HOXB4共培养促进ECs增殖、迁移和成管能力
EdU 增殖实验结果显示,与对照组相比,LPS刺激后ECs的增殖能力明显降低。与不同组BMSCs共培养后,EC增殖能力显示差异性增加,与BMSCWT和BMSCVector共培养组相比,BMSCHOXB4共培养显著提高LPS诱导损伤后EC的增殖能力(图1 A、B)。
划痕实验结果显示,LPS刺激后ECs的迁移能力降低,与不同组的 BMSCs 共培养后增加。与BMSCWT和BMSCVector共培养组相比,BMSCHOXB4共培养组ECs的迁移能力显著增强(图1 C、D)。
最后,为了评估 BMSCHOXB4在体外血管生成中的作用,进行了EC 管形成试验。如图1 E,LPS 组几乎没有管形成。然而,与BMSCWT和BMSCVector共培养组相比,与BMSCHOXB4共培养显著促进EC管形成能力(图1 F)。
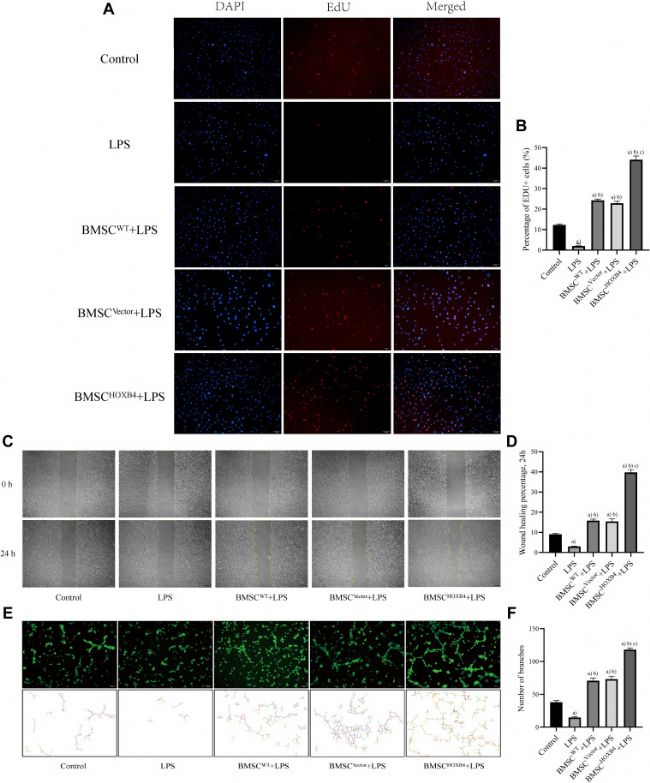
图 1
BMSCHOXB4共培养减弱 ECs 的凋亡和血管通透性
采用TUNEL 和 AV-FITC/PI 检测BMSCHOXB4在 LPS 诱导的 EC 细胞凋亡中的作用。
LPS 刺激后 EC 细胞凋亡显著增加,TUNEL 阳性细胞的增加证明了这一点;BMSC 共培养表现出不同程度的抗 EC 凋亡;与BMSCWT和BMSCVector共培养组相比,BMSCHOXB4组显著降低EC凋亡(图2 A、B)。同样,AV-FITC/PI 检测结果显示,与 BMSCWT(凋亡率:44.31%)和 BMSCVector(凋亡率: 43.10%) 共培养组相比,BMSCHOXB4 共培养组的凋亡率(凋亡率:28.62%)显著降低(图2 C、D)。
血管通透性是衡量ECs屏障功能的指标之一。因此,我们通过内皮细胞渗漏试验测量了血管通透性(图2 E),发现LPS处理后ECs的通透性显著增加,与BMSCs共培养后ECs的通透性显著降低,其中BMSCHOXB4共培养组的血管通透性显著低于BMSCWT和BMSCVector共培养组(图2 F)。
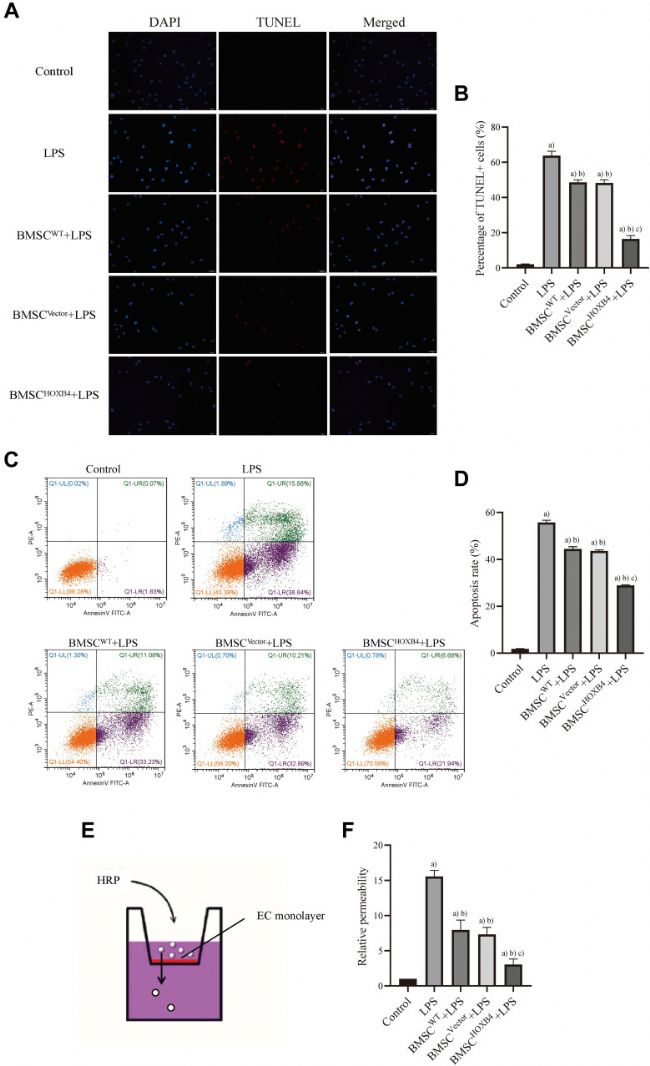
图 2
BMSCHOXB4共培养通过激活 Wnt/β-Catenin 通路防止LPS 诱导的 EC 损伤
为了研究 HOXB4 对 ECs 保护作用的分子机制,采用蛋白质印迹评估了 β-catenin、VE-cadherin、BAX 和 BCL-2 的表达(图3 A)。
与LPS和BMSCWT共培养组相比,BMSCHOXB4共培养组ECs中β-catenin和VE-cadherin的表达显著升高;抗凋亡蛋白 BCL-2 的表达显著增加,而凋亡蛋白 BAX 的表达显著降低(图3 B-E)。值得注意的是,与对照组相比,LPS 组中 β-catenin 的表达水平降低(图3 B),表明 LPS 诱导的 EC 损伤与 Wnt/β-catenin 通路的抑制密切相关。
接下来研究了 BMSCHOXB4 共培养是否在 LPS 诱导的 EC 损伤中调节 Wnt/β-catenin 通路。研究表明 LPS 诱导的 Wnt/β-catenin 通路抑制被 BMSCHOXB4 共培养减弱,导致 β-catenin 水平显著高于LPS 组。相反,Wnt/β-catenin 通路的特异性抑制剂 XAV-939 可逆转保护作用,伴随着 BAX 的上调,以及 BCL-2 和 VE-cadherin 的下调。
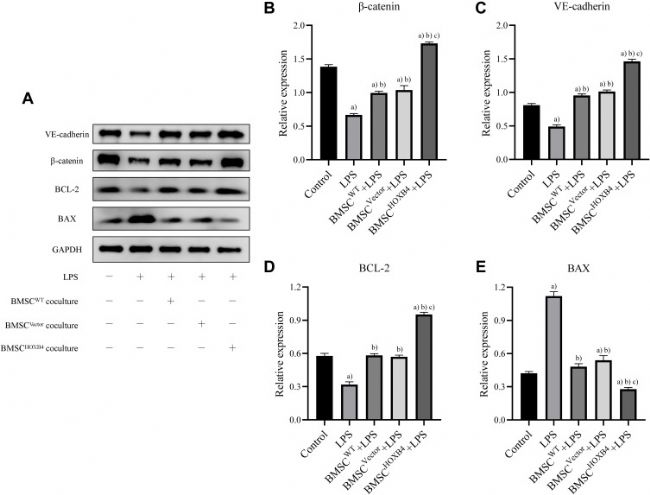
图 3
炎症因子的测量
ELISA法测定细胞培养液中炎症因子的水平(图 4)。LPS处理后,促炎因子(IL-1β、IL-6、TNF-α)升高,与 BMSCs 共培养后,IL-1β、IL-6、TNF-α水平存在差异性降低(图4 A-C)。
与BMSCWT 相比,BMSCHOXB4共培养组 IL-6和TNF-α水平显著降低,而IL-1β的水平在BMSCHOXB4和BMSCWT 共培养组中没有差异。
同样,LPS刺激后抗炎因子IL-4和IL-10显著降低(图4 D、E),与 BMSCWT 共培养组相比,BMSCHOXB4 共培养组 IL-10 水平显著升高,但 BMSCHOXB4和 BMSCWT 共培养组的IL-4 水平无统计学差异。
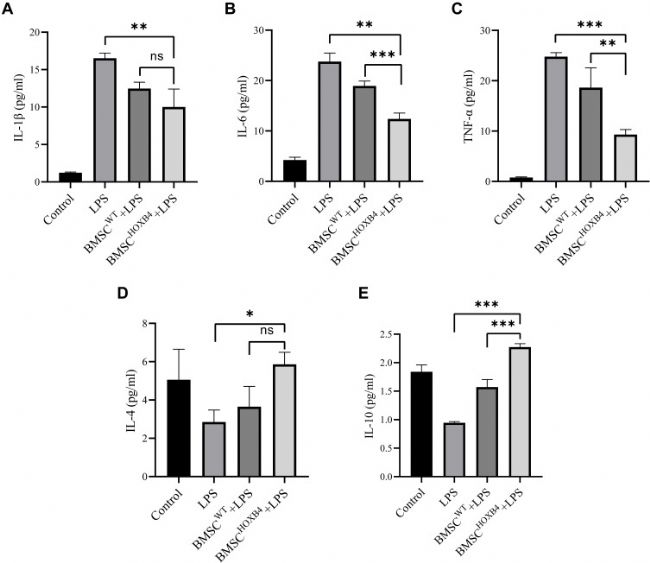
图 4
实验结论:
总之,该研究结果表明,LPS 诱导的 EC 损伤归因于 β-catenin 的减少,而与 BMSCHOXB4共培养显然逆转了 Wnt/β-catenin 信号通路的失活。这表明 BMSCs 可以通过改变 Wnt/β-catenin 信号通路来保护 ECs 免受 LPS 诱导的细胞损伤。而未来需要进一步的体内研究来确定 BMSCHOXB4 的植入是否可以成为治疗 ALI/ARDS 的有吸引力的策略。
参考文献:Lin S, Chen Q, Zhang L, Ge S, Luo Y, He W, Xu C, Zeng M. Overexpression of HOXB4 Promotes Protection of Bone Marrow Mesenchymal Stem Cells Against Lipopolysaccharide-Induced Acute Lung Injury Partially Through the Activation of Wnt/β-Catenin Signaling. J Inflamm Res. 2021 Jul 27;14:3637-3649. doi: 10.2147/JIR.S319416. PMID: 34349541; PMCID: PMC8326777.
小编旨在分享、学习、交流生物科学等领域的研究进展。如有侵权或引文不当请联系小编修正。微信搜索公众号“Naturethink”,学习更多关于流体机械力学刺激细胞培养相关知识吧!





