机械转导的 HIF-1α 稳定在牙周膜成纤维细胞中的作用
为了改善牙齿的健康和美观,正畸治疗致力于矫正错位的牙齿,因为牙齿咬合不正可能引发龋齿或牙周炎等疾病。对于正畸牙齿移动 (OTM),使用可移动或固定的正畸器具在牙齿移动方向上施加机械力。这会在牙周韧带诱发张力区和压力区,从而通过压迫血管影响局部灌注。
这伴随着无菌炎症反应,其特征是细胞因子和趋化因子的释放增加,导致炎症细胞和免疫细胞进一步吸引到牙周膜。其他炎症因子,如前列腺素 (PG),主要是 PG-E2(通过诱导前列腺素合酶 2 (PTGS-2) 产生),通过调节成骨细胞和破骨细胞的分化直接影响 OTM。
牙周韧带成纤维细胞 (PDLF) 是牙周韧带的主要细胞群,邻近免疫细胞。PDLF 在 OTM 过程中受到压缩或拉伸的机械应变。这些细胞通过分泌趋化因子和白细胞介素,负责细胞外基质的重塑和介导OTM 的炎症反应。
牙周膜的适应性反应除了局部血管形成的变化外,还包括细胞内和细胞外基质的重组。机械应变和氧气供应的减少伴随着低氧诱导因子1α (HIF-1α) 表达的增加,它主要负责组织在缺氧条件下的复氧反应。
为了重建牙周膜中的氧气供应,在对 PDLF 施加压缩应变后,血管内皮生长因子 (VEGF) 的表达得到增强。牙周韧带受压区域血管供应的更新有助于破骨细胞的募集和分化,这也是牙周组织愈合和重塑的重要过程。
尽管观察到在牙周韧带 OTM 过程中,HIF-1α 和 VEGF 是稳定和上调的,但尚不清楚是机械应变本身还是由血管压迫引起的缺氧条件导致了HIF-1α的稳定和随后的 PTGS-2、PG-E2 和 VEGF 表达的上调,从而通过增加 RANKL 介导的破骨细胞生成使 OTM 成为可能。
先前的研究表明,HIF-1α 的稳定是由于机械应变,而不是体外 PDLF 的缺氧条件。然而,到目前为止,尚不清楚正畸器具施加于 PDLF 的应变的机械转导是如何介导导致 HIF-1α 稳定的生物学反应,以及随后的 PDLF 介导的假炎症反应在多大程度上依赖于 HIF-1α 稳定。
整合素作为细胞粘附分子和细胞内信号受体,介导细胞迁移、增殖和分化,调节细胞内信号转导通路。由整合素激活的众多信号通路包括机械拉伸 PDLF 中的低分子量鸟苷三磷酸酶 Rab 和 Rho,以及成骨细胞中的丝裂原活化蛋白 (MAP) 激酶 。越来越多的证据表明,先前报道的 HIF-1α 的稳定性和细胞信号在正畸应变反应中的相关变化是整合素介导的黏着斑事件的下游。
基于此,包括德国雷根斯堡大学医院正畸科、德国波恩大学正畸系等在内的研究团队进一步研究,于 International Journal of Molecular Sciences 上发表了题为《Role and Regulation of Mechanotransductive HIF-1α Stabilisation in Periodontal Ligament Fibroblasts》的论文。
该研究的目的是阐明硫酸乙酰肝素整合素的相互作用和激酶下游磷酸化对先前观察到的 HIF-1α 在压缩应变下的机械转导的稳定性的作用,并研究在拉伸应变下是否也发生这种作用。
此外,实验试图研究在体外模拟正畸牙移动的环境中,血管生成 VEGF 的下游表达以及 PDLF 诱导的PTGS-2 及其产物 PG-E2 在多大程度上依赖于 HIF-1α 的稳定。
这样可以更好地了解细胞和分子水平上 OTM 的调控,在未来可能通过靶向调控这些过程,使新的治疗方法成为可能。
部分实验过程:
HIF-1α 的稳定具有应变依赖性
首先,实验测试了不同机械应变方案对缺氧诱导因子 1α (HIF-1α) 蛋白稳定性的影响。PDLF 承受压缩或拉伸应变 48 小时。拉伸应变的应用未能稳定 HIF-1α 蛋白(p = 0.3939;图1 a、b)。与拉伸应变相反,施加压力(压缩应变)增强了 HIF-1α 蛋白的表达(p < 0.0001;图1 a、b)。
通过对常见的 HIF-1α 靶基因的分析,我们发现拉伸应变对前列腺素合酶2 (PTGS-2) 基因的表达有轻微但显著的诱导作用(p < 0.0001),而压缩应变对 PTGS-2 基因的表达有强烈的诱导作用(p < 0.0001; 图1 c)。血管内皮生长因子(VEGF)的基因表达不受拉伸应变的影响(p = 0.7083),而施加压力显著提高了 VEGF 基因表达 (p = 0.0003;图1 d)。
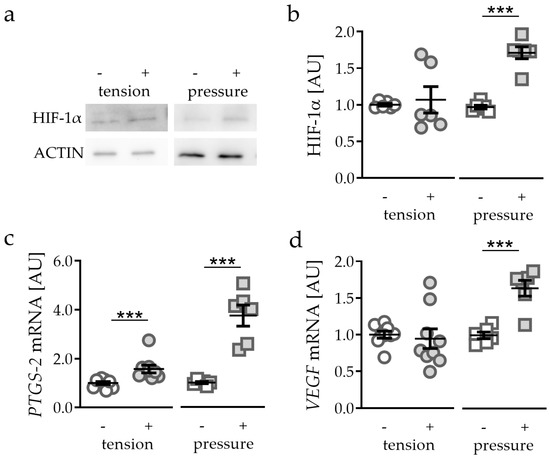
图 1 拉伸应变和压缩应变对 HIF-1α 蛋白表达的影响
压缩应变过程中通过 DMOG对PDLF中HIF-1α稳定的影响
由于没有检测到拉伸应变对 HIF-1α 表达的影响,在接下来的实验中将重点放在压缩应变上。为了进一步研究 HIF-1α 在正畸牙齿移动过程中的作用,通过使用 DMOG(二甲基草酰甘氨酸)化学稳定HIF-1α 。
因此,在没有压缩应变(p = 0.0002)和存在压缩应变(p = 0.0002;图2 a,b)的情况下,通过DMOG 处理检测到更多的HIF-1α蛋白。
值得注意的是,DMOG 处理后压力对HIF-1α表达的影响被截断(p = 0.9709)。在不存在 ( p < 0.0001) 和存在压力(p = 0.0052)的情况下,通过 DMOG 处理提高了PTGS-2 的基因表达(图2 c)。
令人惊讶的是,实验检测到压缩应变和 DMOG 联合作用下 PTGS-2 基因的表达进一步增加(p = 0.0406;图2 c)。因此,在没有压缩应变(p < 0.0001)和存在压缩应变(p < 0.0001;图 2 d)的情况下,通过 DMOG 诱导的 HIF-1α 稳定化增强了 PG-E2 的分泌。
在没有(p < 0.0068)和存在额外压力 (p = 0.0026)时,DMOG均能增强 VEGF 基因的表达(图2 e)。实验没有检测到在DMOG稳定的同时施加压力对 VEGF 基因的表达有任何进一步的诱导效应(p = 0.5532)。
实验发现在没有压缩应变的控制条件下,DMOG 的分泌增强(p < 0.0001;图 2 f),使用DMOG 并施加压力会下调 VEGF 分泌(p = 0.0090;图2f )。

图 2 压缩应变与使用DMOG处理和不使用DMOG处理对HIF-1α蛋白表达的影响(a,b),PTGS-2/PG-E2表达(c,d),VEGF表达(e,f)
此外,实验使用 YC-1 (3-(5′-hydroxymethyl-2′-furyl)-1-benzylindazole)抑制了 PDLF 中压力诱导的 HIF-1α 稳定化。结果发现,当 YC-1 抑制 HIF-1α 的稳定时,压力甚至会增加了 PG-E2 的分泌;施加压力增加了 VEGF 基因表达;使用 YC-1 抑制 HIF-1a 稳定后,这种效应被截断。
实验结论:
实验发现 HIF-1α 不是通过拉伸应变稳定的,而是通过压缩应变稳定的。HIF-1α 稳定对前列腺素和 VEGF 的合成有诱导作用。正如预期的那样,HIF-1α 不稳定降低了 VEGF 表达,而前列腺素的合成增加。
通过surfen或genistein抑制整合素机械转导抑制了HIF-1α的稳定。VEGF 表达下降,但前列腺素合成没有减少。通过整合素机械转导和下游激酶的磷酸化促进HIF-1α的稳定,这似乎对VEGF的诱导是必不可少的。
参考文献:Kirschneck C, Thuy M, Leikam A, Memmert S, Deschner J, Damanaki A, Spanier G, Proff P, Jantsch J, Schröder A. Role and Regulation of Mechanotransductive HIF-1α Stabilisation in Periodontal Ligament Fibroblasts. Int J Mol Sci. 2020 Dec 15;21(24):9530. doi: 10.3390/ijms21249530. PMID: 33333756; PMCID: PMC7765204.
文章来源:http://www.naturethink.com/?news/112.html
小编旨在分享、学习、交流生物科学等领域的研究进展。如有侵权或引文不当请联系小编修正。微信搜索公众号“Naturethink”,学习更多关于流体机械力学刺激细胞培养相关知识!





